高三化学二卷专项训练一(实验试题)
1、试完成下列两小题
(1)化学实验必须注意安全,下列做法存在安全隐患的是 (选填序号)。
A.氢气还原氧化铜实验中,先加热氧化铜后通氢气
B.蒸馏石油时,加热一段时间后发现未加碎瓷片,立刻拨开橡皮塞并投入碎瓷片
C.实验室做钠的实验时,余下的钠屑投入到废液缸中
D.配制浓硫酸与酒精混合液时,将1体积的酒精倒入3体积的浓硫酸中
E.皮肤上沾有少量浓硝酸时,立刻用大量水冲洗,再涂上稀碳酸氢钠溶液
F.制乙烯时,用量程为300℃的温度计代替量程为200℃的温度计,测反应液的温度
(2)在进行研究性学习的过程中,某同学把AgNO3溶液滴入K2HPO4溶液,即得黄色沉淀。经过查阅资料得知:K2HPO4溶液呈碱性;Ag2HPO4和Ag3PO4均为黄色沉淀,只是Ag2HPO4的颜色略浅。该同学认为不能简单地根据颜色的深浅,来确定沉淀是何物。为此,他设计了一个分析实验的方案:先测K2HPO4溶液的pH值;在K2HPO4溶液中滴加硝酸银溶液的同时,不断测定溶液的pH值,直到沉淀量达到最大为止。实际实验中,随着AgNO3溶液的滴入,溶液的pH最终为3—4之间。
①请你判断沉淀量达到最大值时的黄色沉淀是__________________。(填“Ag3PO4”或“Ag2HPO4”)
②根据上述实验结果,请写出K2HPO4 与AgNO3的化学方程式:_____________________ ______。
③请你写出该实验的分析方案中是怎样得出实验结果的:___________________________________。
2、(1)下列实验操作或对实验事实的叙述中存在错误的是__ ____(填序号)
A、用50 mL酸式滴定管准确量取25.00 mL 酸性KMnO4溶液,放入锥形瓶中待用
B、在测定硫酸铜晶体的结晶水时,将灼烧硫酸铜晶体的坩埚放在空气中冷却,然后称量
C、中和热的测定所需的玻璃仪器有烧杯、温度计、量筒
D、实验室中进行的下列实验需水浴加热:①乙酸乙酯的制备②葡萄糖的银镜反应
E、配制1 mol•L-1的NaOH溶液时,下列操作会造成所配浓度偏低:①溶解后烧杯未多次洗涤 ②定容时仰视刻度线 ③容量瓶中原有少许蒸馏水
F、实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉
G、容量瓶检漏:在容量瓶中注入适量的水,塞上玻璃瓶塞,左手五指托住瓶底,右手食指顶住瓶塞,反复倒置数次,观察是否漏水
H、不用其他试剂无法鉴别下列四种溶液:Na2CO3、Al2(SO4)3、NaCl、NaHSO4
I、可以用分液漏斗分离下列三组液态混合物:硝基苯和水、油酸和水、乙酸乙酯和乙醇
J、实验室保存少量液溴和白磷常用水封
(2)某研究性学习小组拟用明矾制取Al2(SO4)3晶体和K2SO4晶体。
①实验室除明矾外,已备好的用品有蒸馏水、氨水、pH试纸,还缺少的试剂有 。
②制得Al2(SO4)3与K2SO4物质的量之比小于 。
(3)“磨砂”是增加玻璃仪器密封性的一种处理工艺 ,可使仪器不漏液或不漏气。在下列仪器中:①试管;②分液漏斗;③细口试剂瓶;④广口试剂瓶;⑤集气瓶;⑥滴瓶;⑦酸式滴定管;⑧碱式滴定管,肯定用不到“磨砂” 处理的有 (填序号)。
(4)碱式氯化铜 (不溶于水的绿色结晶)是一种农药,化学式为:CuCl2·3Cu(OH)2·xH2 O。为验证其组成并确定X值,某学生设计了以下几步实验
①取a g碱式氯化铜的晶体制成粉末。
②将晶体加热至确认质量不再变化为止(铜仍为二价),冷却后称其质量为b g。
③另取a g碱式氯化铜的晶体,溶于足量硝酸中,得到溶液。
④向③得到的溶液中加入足量的硝酸银溶液,最后得到纯净固体,称量为c g。
若以上操作均正确,试回答下列问题:
A.将晶体制成粉末,所用的主要化学仪器是 (填仪器名称)。以上四步中,用到玻璃棒的步骤有 (填序号)
B.步骤②灼烧后得到的固体应为: 。
C.步骤④主要包括:加入足量硝酸银溶液→ → → 晾干→称量
3、⑴ 下列实验操作或对实验事实的描述不正确的是 (填序号)
① 已烷中混有已烯,加入足量的溴水,充分振荡,静置分层后分离
② 配置硫酸铜溶液时应向溶液中加入少量的铜粉
③ 实验室可以用双氧水和二氧化锰制取少量的氧气
④ 向氨水中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加氨水现象相同
⑤ 向某溶液中先通入Cl2再滴加KSCN溶液时溶液变红,证明该溶液一定含有Fe2+
⑥ 将Fe(NO3)2溶液加热蒸发至干并灼烧,最后得到红棕色粉末
⑦ 分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积一样多
⑧在试管中放入几片碎滤纸,滴几滴90%的浓硫酸,再将滤纸捣成糊状,微热并冷却后先滴入几滴CuSO4溶液再加入过量的NaOH溶液加热至沸腾,可观察到红色沉淀生成
(2) 某校化学兴趣小组学生进行如下实验。
a、硫酸铜溶解度的测定:
 用两个相同的石墨电极电解饱和CuSO4溶液,阴极的电极反应式是 Cu2++2
Cu。已知饱和CuSO4溶液的质量为60 g,通电10 min后,溶液恰好变为无色。称量发现两电极质量差为4 g,此温度下CuSO4的溶解度是:20 g 。
用两个相同的石墨电极电解饱和CuSO4溶液,阴极的电极反应式是 Cu2++2
Cu。已知饱和CuSO4溶液的质量为60 g,通电10 min后,溶液恰好变为无色。称量发现两电极质量差为4 g,此温度下CuSO4的溶解度是:20 g 。
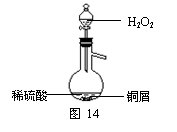
b、某同学查询资料得知:铜屑放入稀硫酸中不发生反应,若在稀硫酸中加入H2O2,铜屑可逐渐溶解。实验小组同学设计实验装置如右图,验证该实验,该反应的化学方程式是:HSO=CuSO+2HO 。
若将H2O2和稀硫酸加入烧瓶中的顺序颠倒,实验得到的结论是 铜屑放入HO中不发生反应,若在HO中加入稀硫酸,铜屑可逐。
4、铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:

⑴ 试剂1是 ,试剂2是 ,加入新制氯水后溶液中发生的离子反应方程式是 , ;
⑵ 加入试剂2后溶液中颜色由淡黄色转变为淡红色是因为 ,
写出+2价Fe在空气中转化为+3价Fe的化学方程式 ;
 ⑶ 该同学猜想血红色溶液变为无色溶液的原因是溶液中的+3价铁被还原为+2价铁,你认为该同学的猜想合理吗?
。若你认为合理,请说明理由(若你认为不合理,该空不要作答)
;若你认为不合理请提出你的猜想并设计一个简单的实验加以验证(若你认为合理,该空不要作答)
。
⑶ 该同学猜想血红色溶液变为无色溶液的原因是溶液中的+3价铁被还原为+2价铁,你认为该同学的猜想合理吗?
。若你认为合理,请说明理由(若你认为不合理,该空不要作答)
;若你认为不合理请提出你的猜想并设计一个简单的实验加以验证(若你认为合理,该空不要作答)
。
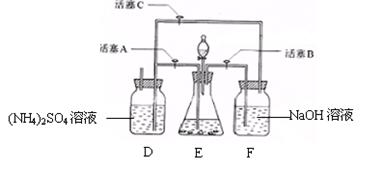
5、摩尔盐[(NH4)2SO4·FeSO4·6H2O]在空气中比一般亚铁盐稳定,是分析化学中常见的还原剂。某研究性学习小组设计了右面的实验装置来制备摩尔盐。
实验步骤:
(1)把30%NaOH溶液和废铁屑混合、煮沸、冷却,将洗涤铁屑后的NaOH溶液装入F中。
(2)在E中用处理过的Fe屑和稀H2SO4反应制取FeSO4。
(3)将硫酸亚铁溶液与硫酸铵溶液混合,结晶得摩尔盐。 试回答下列问题:
(1)F中的NaOH溶液的主要作用是
(2)Fe屑和稀H2SO4反应产生的氢气可赶走装置中的氧气及(NH4)2SO4溶液中的溶解氧,操作时应先关闭活塞 ,并同时打开活塞 。
请写出Fe屑和稀H2SO4反应产生的氢气的另外一个作用
(3)使摩尔盐结晶可采取两种方法:①蒸发溶液、再自然冷却结晶;②不蒸发溶液、直接自然冷却结晶。你认为较好的方法是 。(填序号)
(4)原料利用率高,副产品少,产生的有害废物少,保护环境是“绿色化学”的主要内涵。
请写出此实验中能体现“绿色化学”的具体做法(至少写出两点):
、 。
6、 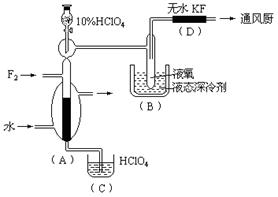 制取氟的氧氯化物X可采用特制的耐氟容器,使氟气缓缓地与10%的HClO4反应。X中各元素的质量分数为:Cl占30%,O占54%,F占16%。其实验装置如下图所示:
制取氟的氧氯化物X可采用特制的耐氟容器,使氟气缓缓地与10%的HClO4反应。X中各元素的质量分数为:Cl占30%,O占54%,F占16%。其实验装置如下图所示:
已知有关有资料如下:
①无水KF易吸F2、HF和H2O ②X的熔点为-167℃,沸点为-15.9℃,易分解或接触有机物发生爆炸 ③F2的沸点为-188℃,HF的沸点为19.54℃,O2的沸点为-183℃
试回答:
(1)X的化学式是
(2)实验中生成X的化学方程式是
(3)D装置的作用是
(4)B中冷却剂选用液氧的理由是
(5)A中填充环状物的作用是
(6)有人用石墨为填充剂,结果无X生成。石墨加入导致不能生成X的主要理由是
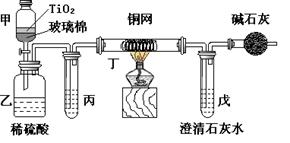 7、电镀厂曾采用有氰电镀工艺,处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2。环保工作人员在密闭系统中用右图装置进行实验,以证明处理方法的有效性,并通过测定二氧化碳的量确定CN-被处理的百分率。
7、电镀厂曾采用有氰电镀工艺,处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2。环保工作人员在密闭系统中用右图装置进行实验,以证明处理方法的有效性,并通过测定二氧化碳的量确定CN-被处理的百分率。
将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200 mL(其中CN-的浓度为0.05 mol·L-)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
⑴甲中反应的离子方程式为 ,乙中反应的离子方程式为 。
⑵乙中生成的气体除N2和CO2外,还有HCl及副产物Cl2等。丙中加入的除杂试剂是饱和食盐水,其作
用是 ,丁在实验中的作用是 ,装有碱石灰的干燥管的作用是 。
⑶戊中盛有含Ca(OH)2 0.02mol的石灰水,若实验中戊中共生成0.82 g沉淀,则该实验中测得CN-被处理
的百分率等于 。该测得值与工业实际处理的百分率相比总是偏低,简要说明可能的原因 气体留在装置中。请提出一个能提高准确度的建议(要有可操作性,且操作简单) 。
8、某研究性学习小组在探究铜锌与浓盐酸反应,设计了如下实验方案
一、实验用品:纯锌片,37%的浓盐酸,铜片,蒸馏水,氯化铜溶液。
甲:将锌放入浓盐酸中,反应速率较快
乙:将实验过程记录下来,并交流。
|
|
根据上述资料与交流材料回答下列列问题
⑴乙反应速率明显比甲快,原因是: 。
⑵丙、丁根据铜位于金属活动顺序表氢之后,与盐酸不反应,对乙产生的气体体积比甲大的事实。作出如下推断:
①丙认为是溶解在溶液中的H2逸出,你认为是否有道理,理由是: 。
②丁作了如下猜想,是否成立,请你设计实验方案。
| 丁猜想 | 验证方法 | 预测现象及结论 |
| 丁认为铜片中可能含有锌等杂质 |
⑶戊注意到乙中(3)中的白色沉淀,分析:不可能是CuCl2,因为CuCl2溶液显蓝色或绿色,也不可能是氯化锌,因为稀释后溶液更稀,不会析出。并利用资料①②大胆猜想,白色沉淀是生成的氯化亚铜。请你帮他设计验证方案(若有多个只设计两个方案):
| 戊 | 预计验证方法 | 预测的现象与结论 |
| 白色沉淀是氯化亚铜 | ||
⑷指导老师肯定了戊的猜想,请结合资料③,写出铜与足量浓盐酸在加热条件下反应生成无色溶液及气体,化学方程式可能是: 。
乙的实验步骤(3)稀释,生成沉淀,实际上是一个平衡问题,请写出这一平衡关系:
(用离子方程式表示)。
⑸就铜与浓盐酸反应若进一步探讨,你认为下一步实验方案: 。
答案:
1、(1)ABCD
(2) ①Ag3PO4 ②3AgNO3+K2HPO4= Ag3PO4+2K NO3+H NO3
③若滴加AgNO3液时得到的沉淀是Ag2HPO4,在"HPO42-完全沉出时",是KNO3的溶液,其pH值不可能明显小于7。而实验事实是:随着AgNO3液的滴入,溶液的pH值逐渐降低,最终降为3—4.可见溶液中H NO生成,所以黄色沉淀Ag3PO4。
2、(1) BCDEGHI
(2)①硫酸溶液、氢氧化钾溶液
②1︰4
(3)①⑧(2分)
(4)A.研钵(1分)②③④(3分)
B.CuO (2分)
C.过滤(1分) 洗涤(1分)
3、(1) ①②⑤⑦(4分)
(2) a、Cu2++2e-==Cu 20 g (3分)
b、Cu+H2O2+H2SO4=CuSO4+2H2O。(1分)
铜屑放入H2O2中不发生反应,若在H2O2中加入稀硫酸,铜屑可逐渐溶解。(2分)
4、⑴ 稀盐酸 KSCN溶液 2Fe2++Cl2=2Fe3++2Cl-
Fe3++SCN-=[Fe(SCN)]2+
⑵ 少量的Fe2+转化为Fe3+,加入KSCN后显红色
4Fe(OH)2+2H2O+O2=4Fe(OH)3
⑶ 不合理 我的猜想是[Fe(SCN)]2+离子中的SCN-被过量的氯水氧化。设计的实验为在褪色后溶液加入FeCl3溶液,仍不变红色(或在褪色后溶液加入加入KSCN溶液,变红色)
5、(1)除去混在氢气中的酸性气体(2分)
(2)A B、C (各1分,共2分)
将E中的产生的硫酸亚铁溶液压入D中(2分)
(3)②(2分)
(4)用氢氧化钠溶液除去混在氢气中的酸性气体;氢氧化钠溶液重复使用;用氢气驱赶氧气,防止亚铁盐被氧化;等其它合理答案(每空2分,共4分)
6、(1)ClO4F (2)HClO4+F2=ClO4F+HF (3)吸收生成的HF (4)因为液氧提供的低温可以使X成为固体,便于X的分离 (5)增大F2与HClO4的接触面积,以利于反应朝预定方向进行 (6)C与HClO4发生反应。
![]() 7、⑴ ClO- +CN- ======CNO- +Cl- ,
7、⑴ ClO- +CN- ======CNO- +Cl- ,
乙 3ClO- +2CNO- +2H+= 2CO2 +N2+H2O +3Cl- 。
⑵ 除去HCL 气体 ,除去Cl2 , 防止空气中的二氧化碳进入戊中影响实验结果。
⑶ 82 % 。 有部分的二氧化碳。 通入氮气 。
8、(1)铜、锌及浓盐酸一起组成了原电池,加快了反应速率(1分)
(2)①没有道理,因为氢气本身难溶于水(1分)
②(2分)
| 将铜片加入稀硫酸中,并微热 | 若无气体放出,则不含锌等活泼金属杂质;若有气体则有锌等杂质 |
(3)(4分)
| 戊 | 预计验证方法 | 预测的现象与结论 |
| 白色沉淀是氯化亚铜 | 白色沉淀加入稀盐酸中,通入氧气 | 溶液变蓝色,说明是一价铜 |
| 向氯化亚铜悬浊液中加入氯化钾浓溶液 | 若白色沉淀消失且得无色溶液,则原白色沉淀为氯化亚铜,否则不是。 |
(4)2Cu + 8HCl = 2H3[CuCl4] + H2↑(或:2Cu +4HCl = 2H[CuCl2] +H2↑;2Cu +6HCl=2H2[CuCl3] +H2↑);
(2分)CuCl4]3-(aq)
![]() CuCl(s) + 3Cl-(aq)[(或: [CuCl2]-(aq)
CuCl(s) + 3Cl-(aq)[(或: [CuCl2]-(aq) ![]() CuCl(s) + Cl-(aq); [CuCl3]3-(aq)
CuCl(s) + Cl-(aq); [CuCl3]3-(aq) ![]() CuCl(s) + 2Cl-(aq)]
CuCl(s) + 2Cl-(aq)]
(5)(2分)用变量控制法探讨铜与盐酸发生反应生成氢气和白色沉淀,盐酸的适宜浓度(其它合理答案均给分)