高三化学二卷典型题训练六
1、某化学研究性学习小组讨论Fe3+和SO32-之间发生怎样的反应,提出了两种可能:一是发生氧化还原反应:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;二是发生双水解反应:2Fe3++3 SO32-+6H2O=2Fe(OH)3(胶体)+3H2SO3。为了证明是哪一种反应发生,同学们设计并实施了下列实验,请填写下列空白:
实验Ⅰ:取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色液体是 。向红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是 。将溶液分成两等份,其中一份加入KSCN溶液,溶液变成血红色,反应的离子方程式为 。另一份加入BaCl2稀溶液,有少量白色沉淀生成,产生该白色沉淀的离子方程式是 。
实验Ⅱ:换用稀释的FeCl3和Na2SO3溶液重复实验Ⅰ。实验Ⅰ、Ⅱ产生的现象完全相同。由上述实验得出的结论是 。若在FeCl3浓溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的化学方程式是 。从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,分析其原因可能是:① ;② .
1、实验Ⅰ:氢氧化铁胶体(或胶体)(1分);先产生红褐色沉淀,后沉淀逐渐溶解,溶液变为黄色,有气泡产生(2分);Fe3++3SCN-=Fe(SCN)3(1分);Ba2++SO42-=BaSO4↓(1分)。实验Ⅱ:Fe3+与SO32-同时发生氧化还原反应和双水解反应(2分)2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑(2分)
①SO32-有较强的还原性,CO32-没有还原性(1分);②SO32-水解能力较CO32-小(1分)
2、部分单质和化合物的转化关系如图(有关反应条件及部分反应物或生成物已略去),已知:C、D、E、F均为单质,B、C、D、E在常温常压下是气体;反应②在工业上常用于检验C;J、K均为不溶于水的沉淀,其中J为红褐色。
请回答下列问题:
(1)A的电子式:_______________;(2)反应①的化学方程式是________________________;
(3)H→I的离子方程式是____________________________________;
(4)写出工业上用反应②检验C的操作步骤及相关现象: ___________________________;
(5)当有1.12L(标准状况)D生成时,反应①中转移的电子数为___________;
(1)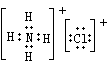 (2)2NH4Cl
(2)2NH4Cl![]() H2↑+Cl2↑+2NH3↑(3)2Fe2+ +Cl2=2Fe3+ +2Cl-
H2↑+Cl2↑+2NH3↑(3)2Fe2+ +Cl2=2Fe3+ +2Cl-
(4)用浓氨水靠着氯气管道移动,若有白烟出现,说明此处氯气泄漏(5)0.1NA(或6.02×1022)
3、科学家预测“氢能”将是未来最理想的新能源。
(1)实验测得,1克氢气燃烧生成液态水放出142.9 kJ热量,则表示氢气燃烧热的热化学方程式为( )
A.2H2(g) + O2(g) = 2H2O(l); △H =-142.9 kJ
B.H2(g) + 1/2O2(g) = H2O(l); △H =-285.8 kJ
C.2H2(g) + O2(g) = 2H2O(l);△H =-571.6kJ
D.H2(g) + 1/2O2(g) = H2O(g);△H = -285.8kJ
(2)根据“绿色化学”的思想,为了制备H2,某化学家设计了下列化学反应步骤:![]()
![]()
![]()
![]() ①CaBr2+H2O CaO+2HBr ②2HBr+Hg HgBr2+H2
①CaBr2+H2O CaO+2HBr ②2HBr+Hg HgBr2+H2
③HgBr2+CaO HgO+CaBr2 ④2HgO 2Hg+O2↑
你认为该方法的主要缺点是 。
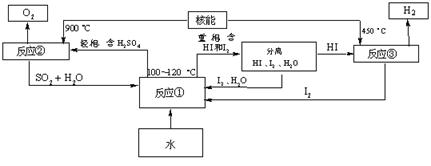 (3)利用核能把水分解,制出氢气,是目前许多国家正在研究的课题。下图是国外正在研究中的一种流程(硫—碘热循环法),其中用了过量的碘。
(3)利用核能把水分解,制出氢气,是目前许多国家正在研究的课题。下图是国外正在研究中的一种流程(硫—碘热循环法),其中用了过量的碘。
请写出反应①的化学方程式: 。
用硫—碘热循环法制取氢最大的优点是 。
(4)也有人认为利用氢气作为能源不太现实。你的观点呢?请说明能够支持你的观点的两点理由。
答案:(1)B (2分)(2)循环过程需要很高的能量,且使用重金属汞,会产生污染。 (2分)
(3) SO2+I2+2H2O![]() 2HI+H2SO4 (2分)SO2和I2可循环使用,无污染。 (2分)
2HI+H2SO4 (2分)SO2和I2可循环使用,无污染。 (2分)
(4)不现实,理由是现有的制取氢气方法耗能大,制取的成本太高,另外是氢气的熔沸点太低,给储存和运输带来困难。
或:现实,制取氢气用水为原料,来源丰富;氢气燃烧的产物是水,不会给环境带来任何污染等。
4、已知一个碳原子上连有两个羟基时,易脱水形成碳氧双键。请根据下图回答。
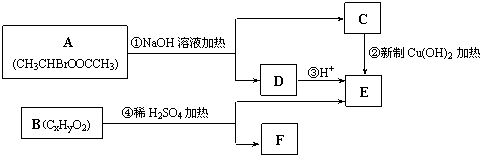
(1) E中含有的官能团的名称是_____________,反应②的反应类型是_____________,
C跟新制的氢氧化铜反应的化学方程式为 。
(2) 已知B的相对分子质量为162,其燃烧产物中n(CO2)∶n(H2O)=2∶1。则B的分子式为_____________,F的分子式为______________。
(3) 在电脑芯片生产领域,高分子光阻剂是光刻蚀0.11 μm线宽芯片的关键技术。F是这种高分子光阻剂生产中的主要原料。F具有如下特点:①能跟FeCl3溶液发生显色反应;②能发生加聚反应;③芳环上的一氯代物只有两种。F在一定条件下发生加聚反应的化学方程式为 。
(4)化合物G是F的同分异构体,它属于芳香族化合物,能发生银镜反应。G可能有________种结构,写出其中任一种同分异构体的结构简式________________。
(1) 羧基;氧化反应;CH3CHO+2Cu(OH)2 CH3COOH+Cu2O↓+2H2O(2) C10H10O2;C8H8O;
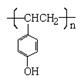
(3) n HO— —CH=CH2
(4)四; 、
5、已知: 4NH3十5O2 ![]() 4NO+6H2O
4NO十3O2十2H2O=4HNO3
4NO+6H2O
4NO十3O2十2H2O=4HNO3
设空气中氧气的体积分数为0.20,氮气体积分数为0.80,请完成下列填空及计算:
(1)amolNO完全转化为HNO3需要氧气_______ mol。
(2)为使NH3恰好完全氧化为一氧化氮,氨-空气混合物中氨的体积分数为________(保留2位小数)。
(3)20.0mol的NH3用空气氧化,产生混合物的组成为:NO18.0mol、O212.0 mol、N2150.0 mol和一定量的硝酸,以及其它成分。(高温下NO和O2不反应)
计算氨转化为NO和HNO3的转化率。
(4) 20.0mol 的NH3和一定量空气充分反应后,再转化为HNO3。
①在下图中画出HNO3的物质的量n(A)和空气的物质的量n(B)关系的理论曲线。
②写出当125mol≤n(B)≤200mol时,n(A)和n(B)的关系式______________________。
【答案】(1)0.75a mol (2)0.14 (3)氨转化为NO的转化率为97.5%;氨转化为HNO3的转化率为7.5%
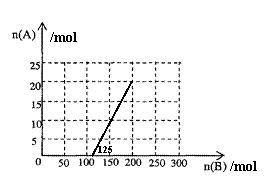 (4)①
(4)①
②3n(A)=0.8[n(B)-125][125mol≤n(B)≤200mol]