高三化学二卷典型题训练一
1、硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铁的氧化物为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+。实验步骤如下:

(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有 。
(a) 容量瓶 (b) 烧杯 (c) 烧瓶
(2)步骤II取样分析溶液中的Fe2+、Fe3+的含量,目的是 。
(a) 控制溶液中Fe2+与Fe3+含量比 (b) 确定下一步还原所需铁的量
(c) 确定氧化Fe2+所需NaClO3的量 (d) 确保铁的氧化物酸溶完全
(3)用NaClO3氧化时反应方程式如下:6FeSO4 + NaClO3 + 3H2SO4 → 3Fe2(SO4)3 + NaCl + 3H2O
若改用HNO3氧化,则反应方程式如下:6FeSO4 + 2HNO3 + 3H2SO4 → 3Fe2(SO4)3 + NO↑ + 4H2O
已知1mol HNO3价格0.16元、1mol NaClO3价格0.45元,评价用HNO3代替NaClO3作氧化剂的得弊,利是 ,弊是 。
聚合硫酸铁溶液中SO42¯与Fe3+物质的量之比不是3:2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42¯与Fe3+物质的量之比。
(4)测定时所需的试剂是
(a) NaOH (b) FeSO4 (c) BaCl2 (d) NaClO3
(5)需要测定 和 的质量(填写化合物的化学式)。
(6)选出测定过程中所需的基本操作 (按操作先后顺序列出)。
(a) 溶解、分液 (b) 过滤、洗涤 (c) 蒸发、结晶 (d) 冷却、称量 (e)烘干或灼烧
2、A、B、C、D、E五种物质有如下转换关系:
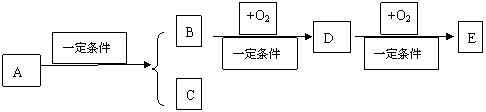

(1)若E是酸酐,且常温下为易挥发的固体,则D的化学式为: ,在一定温度、压强和催化剂作用下提高D转化为E的措施是 ;
(2)若组成A的元素均处在短周期,且B和C均为易溶于水的气体,B能使紫色石蕊试液变蓝,则A的化学式为: ;B转变为D的方程式: ;
(3)若C是可用作自来水消毒的气体,D、E是氧化物,D转变为E时增加氧的质量约为D的总质量的25.8%,则A的化学式为: ,E的电子式: ;
(4)若C是水,B是同系物中相对分子质量最小的物质,B和O2反应生成D是优点显著的D的工业制备方法,E能使紫色石蕊试液变红,则A的结构简式为: ;D转变为E的方程式: 。
3、醛类(R—CHO)分子中碳基上氧原子吸引电子能力强于碳原子,使羰基碳上带有部分正电荷,从而表现出以下两方面的性质:
(1)碳基碳接受带负电荷或带部分负电荷的原子或原子团进攻,而发生加成反应,称为亲核加成反应。
 (2)α一氢(R—CH2—CHO)表现出一定酸性,能与碱作用,产生碳负离子:R-–CH-CHO。
(2)α一氢(R—CH2—CHO)表现出一定酸性,能与碱作用,产生碳负离子:R-–CH-CHO。
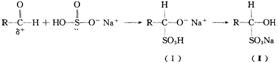
(l)醛与亚硫酸氢钠加成反应的过程如下:
为什么(I)会转化成(Ⅱ)?答:
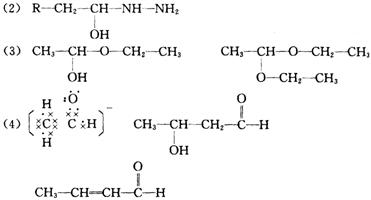
(2)已知R-CH2—CHO+NH2-NH2→A![]() R-CH2-CH=N—NH2,则A的结构简式为
R-CH2-CH=N—NH2,则A的结构简式为
(3)乙醛与乙醇在催化剂作用下,可生成半缩醛(C4H10O2)和缩醛(C6H14O2)。试写出半缩醛的结构简式和缩醛的结构简式:
半缩醛 ;缩醛 。
(4)试写出乙醛与OH-作用产生的碳负离子的电子式 ,
该碳负离子又可进攻另一分子乙醛,而发生加成反应:2CH3CHO![]() C(分子式:C4H8O2)
C(分子式:C4H8O2)![]() D
D
则C、D的结构简式为:C ,D 。
4、物质X是中学化学中的常见物质,X既能与稀硫酸反应,又能与氢氧化钠溶液反应。
(1)若X为氧化物,X的化学式是___________________________。
(2)若X为单质,X用于焊接钢轨反应的化学方程式是_________________________。
 (3)若X与稀硫酸反应生成无色没有气味的气体A,与浓氢氧化钠溶液加热反应生成气体B。等物质的量的A和B在水溶液中反应又生成X。
(3)若X与稀硫酸反应生成无色没有气味的气体A,与浓氢氧化钠溶液加热反应生成气体B。等物质的量的A和B在水溶液中反应又生成X。
X与稀硫酸反应的离子方程式是______________;
X与足量稀氢氧化钠溶液反应的离子方程式是_______。
①在宇航器中,可以不断的将座舱内的空气通过盛有金属过氧化物(以过氧化钠为例)的容器,以除去A。反应的化学方程式是_________________________。
②科学家设计出新的航天飞船内的空气更新系统。其中一步是A和氢气在200℃~250℃时,镍催化剂作用下,生成甲烷和另一种物质。该反应的化学方程式是_____________。
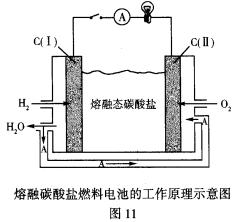
③熔融碳酸盐燃料电池的工作原理如图11所示:
C(Ⅰ)的电极名称是_______(填正极或负极)。该燃料电池的总反应化学方程式是_____________。
5、以天然气、焦炭、水、空气为初始原料,可以制得若干化工产品:
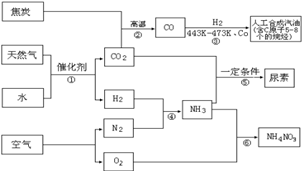 (1)反应③的H2也由反应①得到。若反应①、②、③的转化率均为100%,则将反应①中得到的CO2和H2全部用于合成人工汽油却不能得到理想的产品。
(1)反应③的H2也由反应①得到。若反应①、②、③的转化率均为100%,则将反应①中得到的CO2和H2全部用于合成人工汽油却不能得到理想的产品。
ⅰ)通过计算说明原因。
ⅱ)若要得到理想的产品,则CO2的使用量只要达到反应①中CO2产量的 ;(填数值范围)
(2)通过反应①④⑤合成尿素。若反应④中N2和H2的投料比为V(N2)∶V(H2)=1∶3,
氨合成塔中NH3的体积分数始终保持在25%,要使N2的最终转化率超过95%,则N2和H2至少需要经过 次循环(首次反应不计为1次循环);
(3)通过反应①④⑥合成硝酸铵。若每步反应的转化率均超过95%,则最后得到的产物中N元素质量分数是多少?
高三化学二卷典型题训练一
答案
1、(1)b (2)b、c (3)利:原料成本较低 弊:产生气体对大气有污染
(4)a、c (5)Fe2O3、BaSO4 (6)b、e、d
2、(1)SO2,增加氧气的浓度 (2) NH4Cl 4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
(3)NaCl
![]() (4) CH3CH2OH 2 CH3CHO+O2
(4) CH3CH2OH 2 CH3CHO+O2![]() 2
CH3COOH
2
CH3COOH
3、(l)—SO4H的酸性强于—OH的酸性。
4、(1)Al2O3 (2)2Al+Fe2O3![]() 2Fe+Al2O3
(3)HCO3-+H+=H2O+CO2↑
2Fe+Al2O3
(3)HCO3-+H+=H2O+CO2↑
NH4-+HCO3-+2OH-=NH3·H2O+CO32-+H2O ①2CO2+2Na2O2=2Na2CO3+O2
②CO2+4H2![]() CH4+2H2O
③负极;2H2+O2=2H2O
CH4+2H2O
③负极;2H2+O2=2H2O
5、解:(1)①由CO和H2合成汽油的化学方程式为:
![]()
当n=5~8时![]()
而由CH4+2H2O![]() CO2+4H2、CO2+C
CO2+4H2、CO2+C![]() 2CO知,若反应①中CO2全部用于合成汽油,则
2CO知,若反应①中CO2全部用于合成汽油,则![]() ,故不能得到理想产品。
②
,故不能得到理想产品。
②![]()
(2)5 (3)最后得到的产物中N元素质量分数与每步反应的转化率无关。反应⑥的化学方程式为:
![]() 2NH3+2O2=NH4NO3+H2O,即最后得到的产物是NH4NO3和H2O,且物质的量之比为1∶1。
2NH3+2O2=NH4NO3+H2O,即最后得到的产物是NH4NO3和H2O,且物质的量之比为1∶1。
故最后的产物中ω(N)= =28.57%