高三化学二卷典型题训练三
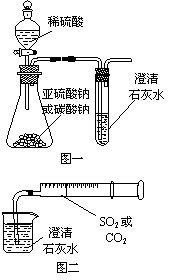 1、某同学用如图一所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2可以看到先浑浊后澄清的现象,但通入SO2没有看到浑浊现象。经过思考分析后,该同学改用图二的装置,将气体收集在注射器,缓缓地将气体一个气泡一个气泡地通入澄清石灰水中,都能看到石灰水先变浑浊再澄清的现象。
1、某同学用如图一所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2可以看到先浑浊后澄清的现象,但通入SO2没有看到浑浊现象。经过思考分析后,该同学改用图二的装置,将气体收集在注射器,缓缓地将气体一个气泡一个气泡地通入澄清石灰水中,都能看到石灰水先变浑浊再澄清的现象。
(1)本实验中生成CO2和SO2的有关反应的化学方程式为:
__________________________;_____________________。
(2)对比分析两组实验,你认为用图一装置实验时,通过SO2不能出现浑浊的原因可能是______________________。
(3)用图二装置进行实验,以相同速率通入CO2和SO2时,SO2产生浑浊、澄清的现象比CO2快的原因可能是__________________________________。
(4)用图一进行SO2与石灰水反应的实验时,从安全或环境角度考虑,该装置可如何改进?
___________________________________________________________。
2、在氮的化合物中,有一类盐叫亚硝酸盐.如亚硝酸钠(NaNO2)等.它们广泛用于印染、漂白等行业,在建筑行业用作防冻剂,在食品工业作防腐剂和增色剂;它是一种潜在致癌物质,过量或长期食用对人产生危害,由于亚硝酸钠有咸味,外观与NaCl相似,曾多次发生过被误当食盐食用的事件。
某同学查阅有关资料,了解到以下相关信息:
|

试回答下列问题:
(1)人体正常的血红蛋白中应含Fe2+.若误食亚硝酸盐(如NaNO2),则导致血红蛋白中Fe2+转化为Fe3+而中毒,服用维生素C可解毒.下列叙述不正确的是________.
A.亚硝酸盐是还原剂 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐被还原
(2)下列方法中,不能用来区别NaNO2和NaCl的是________.
A.测定这两种溶液的pH B.用AgNO3和HNO3两种试剂来区别
C.在酸性条件下加入KI淀粉试液来区别 D.分别在这两种溶液中滴加甲基橙
(3)一般的自来水中含多种离子,如Na+、Ca2+、Cl-、SO42-、NO3-等,专家提出不能喝“千滚水”(指多次煮沸的水),请你用化学知识解释其合理性 ______________________________________。
(4)为了测定某样品中NaNO3的含量,可以使用标准KMnO4溶液进行滴定,试回答:
①KMnO4溶液在滴定过程中作________(填“氧化剂” “还原剂”),该滴定过程________(填“要”或“不要”)另加指示剂.
②若滴定终点读数时目光俯视,则所得结果________(填“偏大”“偏小”“无影响”).
(5某同学在家中欲进行鉴别NaCl与NaNO2的实验,但他家中只有浓醋酸,请问该实验能否成功?说明理由。
(6)现有氮的三种常见氧化物组成的混和气体44.8L(体积已换算成标准状态),其中N2O4、NO体积分数都为20%。
①将该气体通入适量的NaOH溶液中恰好反应,则溶液中NaNO2的质量是 g;
②反应后的溶液蒸干灼烧则NaNO2物质的量 mol。
3、某自来水中含有Ca2+、Mg2+、Na+、K+、HCO3—、SO42—、Cl—,长期烧煮上述自来水会在锅炉内形成水垢。锅炉水垢不仅耗费燃料,而且有烧坏锅炉的危险,因此要定期清除锅炉水垢。已知部分物质20℃时的溶解度数据为
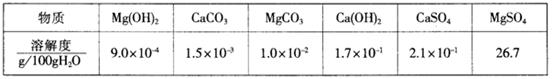
(1)请用化学方程式表示锅炉中的水垢含有Mg(OH)2的原因: 。
(2)锅炉中的水垢所含有的CaSO4不能直接用酸除去,需要加入试剂X,使其转化为易溶于盐酸的物质Y而除去。试剂X是 (填序号)。
CaSO4能转化为物质Y 的原因是(用文字叙述) 。
(3)除含CaSO4、Mg(OH)2外,锅炉水垢中还可能含有的物质是(写化学式) 。
(4)若所用自来水的硬度为33.6度(计算硬度是将Ca2+、Mg2+都看成Ca2+,并将其折算成相当于CaO的质量,通常1L水中含有10mg CaO称为1度)。1t这样的水中相当于含CaO的物质的量为 (水的密度为1g/cm3)。
(5)水中的Ca2+、Mg2+可以用一定浓度的M溶液进行测定,M与Ca2+、Mg2+都以等物质的量进行反应。现取含Ca2+浓度为0.40g/L的自来水样10mL,至锥形瓶中进行滴定,达到终点时,用去了浓度为0.01mol/L的M溶液20.00mL,则该自来水样中Mg2+的物质的量浓度是 。
4、某课外小组设计的实验室制取乙酸乙酯的装置如图4-1所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。
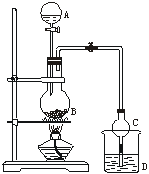
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH ②有关有机物的沸点:
![]()
请回答:
(1)浓硫酸的作用:_____________________________________;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:______________________________________________。
(2)球形干燥管C的作用是_____________________。若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示)__________________________;反应结束后D中的现象是___________。
(3)该小组同学在实验时才取了加入过量的乙醇,目的是 ,同时慢慢滴加乙酸并加热蒸馏,原因是 。
(4)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出_______;再加入(此空从下列选项中选择)_________;然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯。
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰
5、氮肥或土壤中的含氮量可以用酸碱滴定法测定。称取氮肥氯化铵0.2000 g于蒸馏瓶中,加蒸馏水溶解后加入过量浓NaOH溶液,加热使产生的氨气导入40.00 mL浓度为0.1004 mol/L的硫酸溶液中被吸收。然后用0.1600 mol/L的NaOH标准溶液滴定余量的硫酸,消耗NaOH标液20.11 mL。
(1)写出滴定反应方程式: 。选用的指示剂是 。
(2)滴定消耗NaOH物质的量为 mmol。
(3)吸收氨消耗的H2SO4物质的量为 mmol。
(4)氮肥试样中氮(相对原子量14)的质量分数为 。
高三化学二卷典型题训练三
答案
1、(1)Na2CO3+H2SO4=Na2SO4+CO2↑+H2O Na2SO3+H2SO4=Na2SO4+SO2↑+H2O
(2)SO2溶解度大,SO2与石灰水反应时SO2过量,直接反应生成酸式盐而看不到沉淀。
(3)SO2溶解度大,且对应的亚硫酸酸性比碳酸强,通入石灰水反应快。
(4)增加尾气吸收装置或防倒吸装置
2、(1)A (2)D (3)NO2-+Cl2+H2O=NO3-+2H++2Cl-
(4) ①氧化剂, 不要 ②偏小
(5)能,强酸制取弱酸,生成的HNO2分解为红棕色NO2气体。
(6)110.4、2.4
3、(1)Mg(HCO3)2 MgCO3↓+H2O+CO2↑,MgCO3+H2O Mg(OH)2+ CO2
(2)C(1分)碳酸钙的溶解度远远小于硫酸钙的溶解度
(3)CaCO3、MgCO3等
(4)6mol
(5)0.01mol/L
4、2.解析:乙酸乙酯的制备要注意浓H2SO4作用,Na2CO3溶液吸收时注意防止倒吸。
答案:(1)催化剂和吸水剂
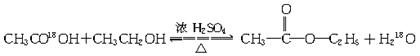
(2)冷凝和防止倒吸 CO![]() +H2O
+H2O![]() HCO
HCO![]() +OH- 红色褪去 且出现分层现象
+OH- 红色褪去 且出现分层现象
(3)增加乙醇的用量提高乙酸的转化率和提高产率;蒸馏出乙酸乙酯,减小生成物,反应正向进行,提高产率,同时逐滴加入乙酸是增加反应物的量,提高转化率。
(4)乙醇和水 C
5、(1)2 NaOH+H2SO4 = Na2SO4 + 2 H2O; 甲基橙
(2)3.218; (3)2.407; (4)16.85%