高三化学二卷典型题训练二
1、氢氧化铜是一种常用试剂。例如,利用新制氢氧化铜验证醛类物质的还原性。
I.新制氢氧化铜悬浊液的配制 实验室制取新制氢氧化铜悬浊液的操作方法:在试管里加入10%的氢氧化钠溶液2 mL,滴入2%的硫酸铜溶液4滴~6滴,振荡即成。这样操作的目的是 。下面是三个研究性学习组分别从不同层面开展研究性学习活动:
II.研究性学习小组甲:对教材实验结论"乙醛与新制氢氧化铜反应生成的红色沉淀是Cu2O"提出质疑,他们认为红色沉淀不一定是氧化亚铜。为了确定红色沉淀的成分,开展了如下研究:提出猜想:
。查阅资料:①氧化亚铜属于碱性氧化物;②+1价的铜离子在酸性条件下易发生自身氧化还原反应;③在空气中灼烧氧化亚铜生成氧化铜。
设计方案:方案1:取该红色沉淀溶于足量的稀硝酸中,观察溶液颜色变化
方案2:取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣
方案3:称取红色沉淀ag,在空气中充分灼烧至完全变黑,并在干燥器里冷却,再称重,反复多次至到固体恒重,称得质量为bg,比较a,b关系
方案4:取红色固体沉淀装入试管里,加入酸化的硝酸银溶液,观察是否有银白色银析出。你认为合理的方案是 。
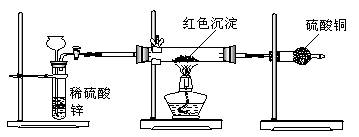 |
III.研究性学习小组乙针对小组甲的质疑,设计新的探究方案,装置如图所示。你认为要测定上述红色沉淀成分必须测定下列哪些物理量: 。①通入氢气体积;②反应前,红色沉淀+硬质试管的总质量;③完全反应后红色固体+硬质试管的总质量;④实验前,干燥管质量;⑤硬质试管质量;⑥锌粒质量;⑦稀硫酸中含溶质的量;⑧实验后,干燥管质量
 IV.研究性学习小组丙上网查阅新闻得知,"2005年诺贝尔化学奖授予了三位研究绿色化学的科学家"。绿色化学强调对环境友好,实现零排放。"变废为宝"符合绿色化学要求。他们收集上述红色沉淀制备化学试剂--蓝矾。请你帮助他们设计一个简单且符合绿色化学要求的实验方案: 。
IV.研究性学习小组丙上网查阅新闻得知,"2005年诺贝尔化学奖授予了三位研究绿色化学的科学家"。绿色化学强调对环境友好,实现零排放。"变废为宝"符合绿色化学要求。他们收集上述红色沉淀制备化学试剂--蓝矾。请你帮助他们设计一个简单且符合绿色化学要求的实验方案: 。
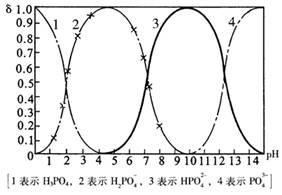
2、磷酸(H3PO4)在溶液中能够以H3PO4、H2PO4—、HPO42—、和PO43—四种粒子形式存在,当溶液的pH发生变化时,其中任一种粒子的物质的量占四种粒子总物质的量的分数δ也可能发生变化。下图是H3PO4溶液中,各种粒子的物质的量分数δ随pH的变化曲线:
(1)设磷酸总浓度为c(总),写出c(总)与各粒子浓度间的关系式 。
(2)向Na3PO4溶液中逐滴滴入稀盐酸,当pH从9降到6的过程中发生的主要反应的离子方程式为
。当pH=7时,溶液中主要存在的阴离子(OH—离子除外)是 。
(3)从图中推断NaH2PO4溶液呈 性(填“酸”、“碱”、或“中”),其原因是 。
(4)在Na3PO4溶液中,c(Na+)/ c(PO43—) 3(填“>”、“==”、或“<”);向该溶液中滴入几滴浓KOH溶液后,c(Na+)/ c(PO43—)的值减小,原因是 。
3、某试剂厂有银(含杂质铜)和硝酸(含杂质Fe3+)反应制取硝酸银.步骤如下:
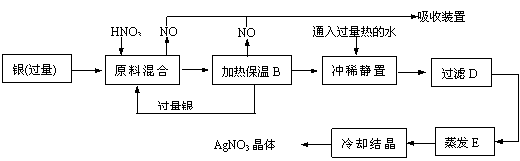
依据上述步骤,完成下列填空:
(1)溶解银的硝酸应该用 硝酸(填浓或稀)。原因是 (填序号,下同)
(a)减少过程中产生NOX的量 (b)减少原料银的消耗量 (c)节省硝酸物质的量
(2)步骤B加热保温的作用是 .
(a)有利于加快反应速率
(b)有利于未反应的硝酸挥发
(c)有利于硝酸充分反应,降低溶液中[H+]
(3)步骤C中是为了除去Fe3+、Cu2+等杂质,冲稀静置时发生的化学反应是
(a)置换反应 (b)水解反应 (c)氧化还原反应
产生的沉淀物化学式 .
4、工业上用甲苯生产对-羟基苯甲酸乙酯 ![]() (一种常见的化妆品防霉剂),其生产过程如下图(反应条件没有全部注明):
(一种常见的化妆品防霉剂),其生产过程如下图(反应条件没有全部注明):
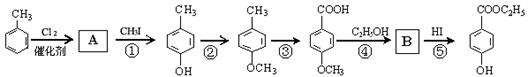
根据上述合成路线回答:
⑴ 有机物A的结构简式____________________。
⑵ 反应④的化学方程式(有机物写结构简式,要注明反应条件):_______________________________。
⑶ 反应③的反应类型(填编号)_____,反应⑤的反应类型(填编号)_____。
A.取代反应 B.加成反应 C.消去反应 D.酯化反应 E.氧化反应
⑷ 反应③的化学方程式______________________________________。
⑸ 在合成线路中,设计第③和第⑥这两步反应的目的是 。
5、已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,且Ksp(AgX)== 1.8×10-10,Ksp(AgY)== 1.0×10-12,Ksp(AgZ)== 8.7×10-17;
(1)根据以上信息,判断AgX、AgY、AgZ三者的溶解度(已被溶解的溶质的物质的量/1L溶液 表示)S(AgX)、S(AgY)、S(AgZ)的大小顺序为:
(2)若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-) (填“增大”、“减小”或“不变”)。
(3)在25℃时,若取0.188g的AgY(相对分子质量188)固体放入100mL水中(忽略溶液体积的变化),则溶液中Y-的物质的量浓度为
(4)由上述Ksp判断,在上述(3)的体系中,能否实现AgY向AgZ的转化,并简述理由:
高三化学二卷典型题训练二
答案
1、I.确保氢氧化钠过量,氢氧化铜呈悬浊状 2分
Ⅱ.红色沉淀可能是铜或铜与氧化亚铜的混合物(或红色固体中可能含有铜)(2分) ,
方案3 (1分) Ⅲ.②③⑤ (2分)
Ⅳ.在空气中充分灼烧该红色固体至全部转化成氧化铜,加入足量稀硫酸溶解,蒸发、结晶、过滤、洗涤,用滤纸吸干或通入惰气带走水分。
2、(1)c(总)== c(H3PO4)+ c(H2PO4—)+ c(HPO42—)+ c(PO43—)
(2)HPO42—+H+== H2PO4—(1分) H2PO4—(1分)、HPO42—
(3)酸(1分)H2PO4—在溶液中的电离程度大于水解程度
(4)>(1分),KOH抑制了PO43—的水解
3、(1)稀,(a)、(c) (2)(a)、(c) (3)(b),Fe(OH)3、Cu(OH)2
4、
⑴![]() ⑵
⑵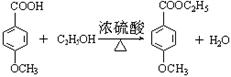
⑶E;A
⑷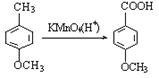
⑸防止酚羟基被后面的氧化剂氧化。
5、(1)S(AgX)>S(AgY)>S(AgZ)(1分)
(2)减小(1分) (3)1.0×10-6mol·L-1(2分)
(4)能(1分) Ksp(AgY)=1.0×10-12>Ksp(AgZ)= 8.7×10-17(2分)