高三化学下学期四月测试题1
(各地四月模考题选1)
不错会做的题,不失该得的分!
6.( 德州市) 下列叙述正确的是 ( )
①生活中用电解食盐水的方法制取消毒液是利用了盐的水解的原理
②乙醇和汽油都是可再生资源,所以应大力全面推广使用乙醇汽油
③建设三峡大坝需要使用大量水泥,水泥是硅酸盐材料
④夏天人们佩戴由添加氧化亚铜的二氧化硅玻璃制作的变色眼镜来保护眼睛
⑤太阳能电池可采用硅材料制作,其应用有利于环保、节能
A. ①②③ B. ②④ C. ③④⑤ D. ③⑤
7.(滨州市)设NA表示阿伏加德罗常数的值,下列叙述中正确的是 ( )
A.常温常压下,8.8gCO2和N2O的混合物中所含有的原子数为0.6NA
B.Cu和足量的稀硝酸反应产生4.48L气体时,转移的电子数为0.6NA
C.标准状况下,3.36L丁烷中含有的非极性键数为0.6NA
D.在1L 0.2mol·L-1的硫酸铁溶液中含有的铁离子数为0.6NA
8.(滨州市)一定能在下列溶液中大量共存的离子组是 ( )
A.水电离产生的c(H+)=1×10-12mol·L-1溶液:NH![]() 、Na+、Cl-、HCO
、Na+、Cl-、HCO![]()
B.能使pH试纸变深蓝色的溶液中:Na+、[Al(OH)4]-、S2-、CO![]()
C.含有大量Fe3+的溶液:SCN-、I-、K+、Br-
D.澄清透明的无色溶液中:ClO-、MnO![]() 、Al3+、SO
、Al3+、SO![]()
|
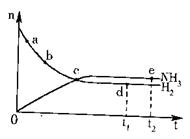
![]() N2(g)+3H2(g)
2NH3(g),△H<0,
N2(g)+3H2(g)
2NH3(g),△H<0,
在673K、30Mpa下n(NH3)和n(H2)随时间变化
的关系如图所示。下列叙述正确的是 ( )
A.点c处反应达到平衡
B.点a的正反应速率比点b的大
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,773K下反应至t1时刻,n(H2)比图中d点的值小
10、(全国统考雅礼卷)将0.01mol/L的NaOH溶液和0.02mol/L的一元弱酸HA等体积混合后,溶液显碱性,下列关系式中正确的是 ( )
A.c(HA)<c(A-) B.c(Na+)=c(A-)+c(OH-)
C.c(Na+)>c(A-) D.c(HA)+c(A-)=0.02mol/L
11.(滨州市)据悉,奥运会上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白色烟雾。撞击时发生的化学反应方程式为:5KclO3+6P=3P2O5+5KCl,则下列有关叙述错误的是 ( )
A.上述反应中氧化剂和还原剂的物质的量之比为5:6
B.产生白色烟雾的原因是生成的P2O5白色固体小颗粒(烟)吸水性很强,吸收空气中 的水分,
生成磷酸小液滴(雾)
C.上述反应中消耗3molP时,转移电子的物质的量为15mol
D.因红磷和白磷互为同分异构体,所以上述火药中的红磷可以用白磷代替
12.(滨州市)X、Y、Z为短周期元素,X原子最外层只有一个电子,Y原子的最外层电子数比内层电子数少4,Z的最外层电子数是内层电子总数的3倍。下列有关叙述正确的是 ( )
A.X肯定为碱金属元素 B.稳定性:Y的氢化物>Z的氢化物
| |
| |
|
①浓氨水和固体NaOH制NH3 ②大理石和稀盐酸制CO2
③过氧化氢溶液和二氧化锰制O2 ④稀硝酸和铜片制NO
⑤浓盐酸和二氧化锰制Cl2 ⑥电石和水制C2H2
⑦锌粒和稀硫酸制H2 ⑧乙醇和浓硫酸制C2H4
A.②③ B.①⑥⑦
C.②⑤⑧ D.①④⑥
选择题答题栏
| 题 号 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答 案 |
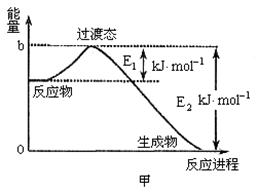
26. ( 德州市)(14分)(1)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成,而是在反应物到生成物的过程中经过一个高能量的过渡态。图甲是白磷(![]() )和
)和![]() 反应生成
反应生成![]() 过程中能量变化示意图,请写出白磷(
过程中能量变化示意图,请写出白磷(![]() )和
)和![]() 反应生成
反应生成![]() 的热化学方程式:
的热化学方程式:
_(△H用含![]() 和
和![]() 的代数式表示,其中E1、E2均大于0)。
的代数式表示,其中E1、E2均大于0)。
(2)常温下取0.2mol/L HCl溶液与0.2mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①混合溶液中由水电离出的![]() ________0.2mol/L HCl溶液中由水电离出
________0.2mol/L HCl溶液中由水电离出![]() ;(填“>”、“<”或“=”)
;(填“>”、“<”或“=”)
②求出混合物中下列算式的精确计算结果。
![]() =________mol/L,
=________mol/L,![]() =________mol/L。
=________mol/L。
③如果常温下取0.2mol/L MOH溶液与0.1mol/L HCl溶液等体积混合,测得混合溶液的pH<7,则说明MOH的电离程度________MCl的水解程度。(填“>”、“<”或“=”)
27. ( 德州市)(10分)已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图:(注意:其中有些反应的条件及部分生成物已略去)
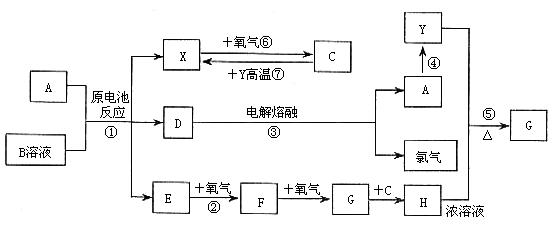
请填写下列空白:
(1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为________________________________________。
(2)反应②的化学方程式为________________________________
(3)反应⑤的化学方程式为________________________________
(4)原电池反应①中正极的电极反应式为________________________
(5)B溶液在工业上常被用作焊接时的除锈剂,其应用原理是___________________________________________。
28. ( 德州市)(22分)为了从含有![]() 的废液中回收Cu,某研究性学习小组的同学们设计了两种方案:回答下列问题:
的废液中回收Cu,某研究性学习小组的同学们设计了两种方案:回答下列问题:
(1)根据实验方案的内容和步骤补全下述实验方案中的①②③。
方案1:向废液中加入过量的铁粉,充分反应后,①__________。在所得滤渣中加入足量的②__________,
充分反应后,再过滤即得到铜。
方案2:在废液中加入适量的盐酸调节溶液的pH=1,用铜和石墨作电极进行电解。当观察到③_______________时,即停止电解,这时要回收的Cu已全部析出。
(2)方案1中涉及的四种阳离子的氧化性由强到弱的顺序为:____________________过滤操作时,需要用到的玻璃仪器是:____________________。
(3)方案2中铜作__________极,所发生的电极反应为(若有多个电极反应,请按照反应发生的先后顺序全部写出)_________________________________,另一电极所发生的电极反应为_________________________________。
(4)方案2在电极上直接回收铜,操作上比方案1简便,但方案2也有不足之处,主要表现为:__________________________________________________。
29.
(14分)( 德州市) 已知:有机物D(![]() )是组成人体蛋白质的氨基酸之一,它可由A通过以上反应合成制取。有机物A(
)是组成人体蛋白质的氨基酸之一,它可由A通过以上反应合成制取。有机物A(![]() )为食品包装中的常用防腐剂,常温下难溶于水, 可以使溴水褪色。有机物B(
)为食品包装中的常用防腐剂,常温下难溶于水, 可以使溴水褪色。有机物B(![]() ),其分子中没有支链,通常状况下为无色晶体,能与氢氧化钠溶液发生反应。
),其分子中没有支链,通常状况下为无色晶体,能与氢氧化钠溶液发生反应。
请回答下列问题: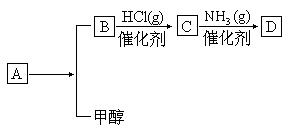
(1)B、D的结构简式分别是__________、__________。
(2)A可以发生的反应有__________(选填序号)
①加成反应 ②氧化反应 ③酯化反应 ④加聚反应
(3)B分子中所含的官能团名称是______________________________。
(4)B的具有相同官能团的同分异构体的结构简式是____________________。
(5)写出由B与甲醇反应制A的化学方程式是____________________。
高三化学测试题答案
(各地四月模考题1)
DABBCDDA
26. (14分,计算每空3分,其余每空2分)
(1)![]() ;△H
;△H![]() ;
;
(2)①> ②![]() ;
;![]() ③<
③<
27. (10分,每空2分)(1)![]() ;
;
(2)![]() ;
;
(3)![]() ;
;
(4)![]()
(5)![]() 水解显酸性,除去铁锈。
水解显酸性,除去铁锈。
28. (22分,每空2分)
(1)①过滤;②盐酸;③阴极上有气泡产生
(2)![]() ;
;![]() ;
;
(3)阴 ![]() ;漏斗、烧杯、玻璃棒;
;漏斗、烧杯、玻璃棒;
![]() ;
;![]()
(4)有污染性气体![]() 产生,使用了电解装置,成本较高等
产生,使用了电解装置,成本较高等
29. (14分) (1)![]() ;(2分)
;(2分)
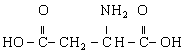 (2分)
(2分)
(2)①②④(2分)
(3)碳碳双键(1分) 羧基(1分)
(4)![]() (3分)
(3分)
(5)![]()
![]()
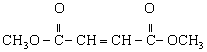
![]() (3分)
(3分)