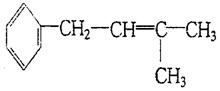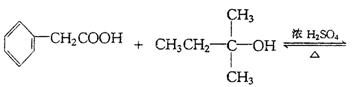高三化学下学期四月测试题
(各地四月模考题选2)
6. ( 德州市) 下列对阿佛加德罗常数数值描述最准确的是 ( )
A.
720g ![]() 所含的分子个数
B. 1mol HCl溶于水中
所含的分子个数
B. 1mol HCl溶于水中![]() 的个数
的个数
C.
22.4L ![]() 所含的分子数
D. 常温常压下,0.1mol羟基(—OH)所含电子的个数
所含的分子数
D. 常温常压下,0.1mol羟基(—OH)所含电子的个数
7、(全国统考雅礼卷)对于下列置换反应,其中不能在溶液中进行的是 ( )
A.非金属单质置换出金属单质 B.非金属单质置换出非金属单质
C.金属单质置换出金属单质 D.金属单质置换出非金属单质
8.(崇文区一模)下列叙述中不正确的是 ( )
A.一定浓度的醋酸钠溶液可使酚酞试液变红,其原因是发生了如下反应:
![]() CH3COO-+H2O
CH3COOH+OH-使得溶液中的c(OH-)>c(H+)
CH3COO-+H2O
CH3COOH+OH-使得溶液中的c(OH-)>c(H+)
B.在0.1mol/LNa2CO3溶液中:2c(Na+)=c(H2CO3)+c(CO2-3)+c(HCO3-)
C.在0.1mol/LNH4Cl溶液中:c(H+)+c(NH4+)=c(Cl-)+c(OH-)
D.将0.2mol/L的盐酸与0.1mol/L的NaAlO2溶液等体积混合,其溶液中离子浓度由小到大的顺序为:
c(OH-)<c(H+)<c(Al3+)<c(Na+)<c(Cl-)
9.(崇文区一模)现有等体积的Ba(OH)2、NaOH和NH3·H2O三种溶液,将它们分别与V1L、V2L、V3L等
浓度的盐酸混合,下列说法中正确的是 ( )
A.若混合前三溶液物质的量浓度相等,混合后溶液呈中性,则V1>V2>V3
B.若混合前三溶液pH相等,酸碱恰好完全反应,则V1>V2>V3
C.若混合前三溶液物质的量浓度相等,酸碱恰好完全反应,则V1>V2>V3
D.若混合前三溶液pH相等,将它们同等倍数稀释后,则NaOH溶液pH最大
10. ( 德州市) 下图为短周期的一部分,推断关于Y、Z、M的说法正确的是( )
| X | ||
| Y | ||
| Z | M | |
A. 非金属性:Y>Z>M
B. 原子半径:M>Z>Y
C. 气态氢化物的稳定性:Y<M<Z
D.
![]() 分子中各原子的最外层电子均满足
分子中各原子的最外层电子均满足![]() 稳定结构
稳定结构
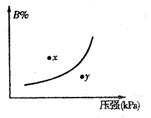
![]()
|
平衡时B的体积分数(B%)与压强变化的关系如图所示,下列
叙述中一定正确的是 ( )
①m+n>p
②x点表示的正反应速度大于逆反应速率
| |
④x点比y点时的反应速率慢
⑤若升高温度,该反应的平衡常数增大
A.①②⑤ B.只有②④ C.只有①③ D.只有①③⑤
12.(滨州市)盖斯定律认为:不管化学过程是一步完成或分为数步完成,这个过程的热效应是相同的。
已知:H2O(g)=H2O(l) △H1=-Q1kJ·mol-1
C2H5OH(g)=C2H5OH(l) △H2=-Q2kJ·mol-1
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) △H3=-Q3kJ·mol-1
若使23g酒精液体完全燃烧,最后恢复到室温,则放出的热量为(KJ) ( )
A.Q1+O2+Q3 B.0.5(Q1+Q2++Q3 )
C.0.5 Q1-1.5O2+0.5Q3 D.1.5 Q1-0.5O2+0.5Q3
13.(滨州市)将甲和乙气体同时通入过量丙溶液中,充分反应后一定产生沉淀的组合是 ( )
| 序号 | 甲 | 乙 | 丙 |
| ① | CO2 | SO2 | Ca(OH)2 |
| ② | HCl | CO2 | Ca(OH)2 |
| ③ | CO2 | SO2 | Ba(NO3)2 |
| ④ | NO2 | SO2 | BaCl2 |
| ⑤ | CO2 | NH3 | CaCl2 |
| ⑥ | O2 | NH3 | AlCl3 |
A.①②⑤ B.①③④⑤⑥ C.①②③④⑥ D.全部
选择题答题栏
| 题 号 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答 案 |
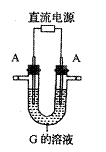
26.(崇文区一模)(8分)氯酸一种强酸,氯酸溶液浓度若超过40%就会迅速分解,产生一种酸性比它更强的酸,同时放出气体,该混合气体干燥后的平均相对分子质量为45,它可以使带有火星的木条复燃,又可以使湿润的淀粉碘化钾试纸变蓝后又褪色,试写出:
(1)气体与湿润的淀粉碘化钾试纸发生反应的离子方程式。 。
(2)氯酸分解的化学方程式: 。
(3)生成1mol更强酸时,转移电子的物质的量是 mol,生成气体在标准状况下的体积为 L。
27. ( 德州市)(8分)聚合氯化铝晶体的化学式为![]() ,它是一种高效无机水处理剂,它的制备原理是调节增大
,它是一种高效无机水处理剂,它的制备原理是调节增大![]() 溶液的pH,通过促进其水解而结晶析出。其制备原料主要是铝加工行业的废渣——铝灰,它主要含
溶液的pH,通过促进其水解而结晶析出。其制备原料主要是铝加工行业的废渣——铝灰,它主要含![]() ,还有
,还有![]() 等杂质。聚合氯化铝生产的工艺流程如下:
等杂质。聚合氯化铝生产的工艺流程如下:
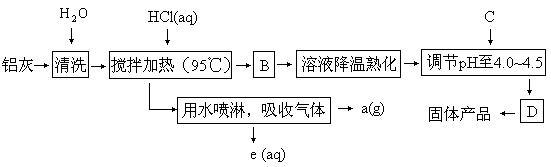
(1)搅拌加热操作过程中发生反应的离子方程式为:
____________________;____________________。
(2)生产过程中B和D的操作名称分别是__________和__________(B和D均为简单操作)
(3)反应中副产品a是____________________。
(4)生产过程中可循环使用的物质是__________(用化学式表示)。
(5)调节pH至4.0~4.5的目的是______________________________。
(6)实验室要测定水处理剂产品中n和x的值。为使测定结果更准确,需得到的晶体较纯净。生产过程中C
物质可选用____________________。
(A)NaOH (B)Al (C)氨水 (D)![]() (E)
(E)![]()
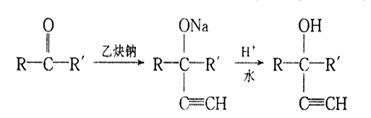
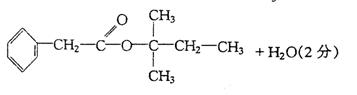
![]() 28.(8分)已知有两种有机反应,在一定条件下,羰基(—C—)可以与乙炔钠发生反应,如:
28.(8分)已知有两种有机反应,在一定条件下,羰基(—C—)可以与乙炔钠发生反应,如:
|
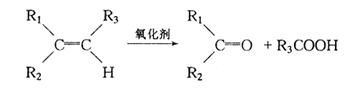
碳碳双键在一定条件下与氧化剂作用可得到羰基化合物,如:
|
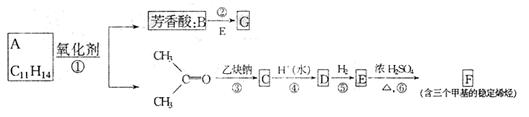
现有化合物A的一系列反应如下所示,起始物为只有一个侧链的芳香烃(某些反应的条件已略去)
|
试回答:
(1)A的结构简式是 。
(2)反应过程中属于加成反应的是(填编号) 。
(3)写出下列反应的化学方程式:B+E→G 。
(4)写出与B互为同分异构体,含有甲基和苯环且属于酯类的有机物有 种。
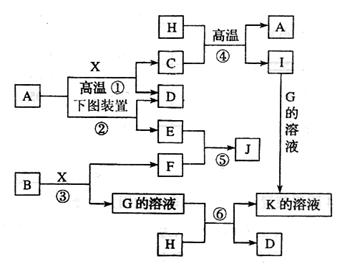
29.(14分)已知:A、H为常见的金属单质,D、F在常温下为气态单质,B为淡黄色固体,
J为红褐色沉淀。请按要求填空:
|
(1)写出B的电子式: 。
|
应式 。
(3)反应①的化学方程式是 。
反应④在生产中有重要应用,被称为 反应。
(4)反应⑥的离子方程式是 。
高三化学测试题答案
(各地四月模考题选2)
AABADBDC
26.(12分,每空3分)
(1)Cl2 + 2I- = 2Cl- + I2 ………………………………………………(3分)
(2)3HClO3 = HClO4 + 2O2↑+Cl2↑+ H2O ……………………………(3分)
(3)10 67.2 ……………………………………………………………(6分)
27. (20分)(1)![]() (3分)
(3分)
![]() (3分)
(3分)
(2)过滤,过滤 ( 4分)
(3)H2 (2分) (4)HCl(2分) (5)促进![]() 水解,使晶体析出。(3分)
水解,使晶体析出。(3分)
(6)B D(3分)
|
(1) (3分)
|
(3)
|
(4)5(4分)
|
|
(1) Na+[: O : O :]2—Na+ (3分)
|
(3)3Fe+4H2O Fe3O4+4H2↑ (3分)
铝热 (3分)
(4)2Al+2OH—+2H2O 2AlO![]() +3H2↑ (3分)
+3H2↑ (3分)