高三化学下学期四月测试题
四月模考题选3
6.保护环境是公民的责任和义务。下列说法正确的是 ( )
A.大量使用含磷洗涤剂会带来白色污染
B.减少使用氟氯代烷的目的是为了减少酸雨
C.硫酸厂的尾气用氨水吸收,生产中的污水含有硫酸等杂质可用烧碱中和处理
D.北京城区限制冬季燃煤供暖,是因为燃烧化石燃料会产生二氧化硫
7.下列各组物质中,能发生不同化学反应的是 ( )
①C与O2 ② P与Cl2 ③Fe与Cl2 ④ NaAlO2 溶液与H2SO4 溶液
⑤CO2与NaOH溶液 ⑥Cu与硝酸 ⑦ AgNO3溶液与氨水 ⑧AlCl3溶液与氨水
A.除③外 B.除③⑧外 C.除③⑦外 D.除⑥⑦⑧外
8.用NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.0.2 mol过氧化氢完全分解转移的电子数目为0.4NA
B.300 mL 2 mol / L蔗糖溶液中所含分子数为0.6 NA
C.在常温常压下,17 g硫化氢所含质子数目为8 NA
D.在标准状况下,2.24 L二氧化硫与氧气混合气体中所含氧原子数为0.2 NA
9.以下有关溶液(均在常温下)的结论不正确的是 ( )
A. pH>7的溶液中可能存在CH3COOH分子
B.![]() mol / L醋酸溶液100 mL与50 mL
mol / L醋酸溶液100 mL与50 mL ![]() mol / L氨水混合后能恰好完全中和
mol / L氨水混合后能恰好完全中和
C.pH =1的盐酸与pH =5的盐酸等体积混合后pH等于3
D.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量后者多
10.下列叙述正确的是 ( )
A.同周期元素的原子半径越小,气态氢化物还原性越弱
B.晶体中分子间作用力越强,分子越稳定
C.稀有气体原子序数越大,熔点越低
D.同主族金属的原子半径越大,熔点越高
11.化学用语是学习化学的重要工具。下列用来表示物质变化的化学用语中,正确的是 ( )
A.钢铁腐蚀时可能发生的正极反应 4OH– – 4e– ══ 2H2O + O2↑
B.表示中和热的离子方程式 H+ + OH–══ H2O; △H=–57.3 kJ/ mol
C.明矾水解反应的离子方程式 Al3+ + 3H2O══Al(OH)3 + 3H+
 D.硫酸铵浓溶液与氢氧化钠浓溶液混合的离子方程式 NH4+
+ OH– ══ NH3↑+ H2O
D.硫酸铵浓溶液与氢氧化钠浓溶液混合的离子方程式 NH4+
+ OH– ══ NH3↑+ H2O
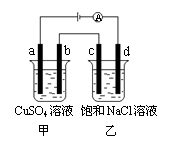
12.如图所示,a、b、c、d均为石墨电极,通电进行电解。下列说法错误的是( )
A.乙烧杯中c极的电极反应为 2Cl––2e– ══ Cl2↑
B.a、c两极产生气体的物质的量不相等
C.甲、乙两烧杯中溶液的pH均保持不变
D.甲烧杯中发生的反应为
 2CuSO4 + 2H2O
电 解 2Cu + O2 ↑ + 2 H2SO4
2CuSO4 + 2H2O
电 解 2Cu + O2 ↑ + 2 H2SO4
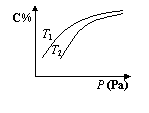
13.在密闭容器中,对于可逆反应A +3B ![]() 2C(气),平衡时C的体积分数
2C(气),平衡时C的体积分数
与温度和压强的关系如图所示,下列判断不正确的是 ( )
A.若正反应方向△H >0,则T1 > T 2
B.压强增大时,混合气体的平均相对分子质量增大
C.A可能为气体
D.B不一定为气体
选择题答题栏
| 题 号 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答 案 |
 26.(16分) A~M有如下图转化关系。已知D、L是相对分子质量相等的两种气体,且含有同一种元素,D是石油化工的重要基础原料,也是一种植物生长调节剂;A、E都是无色溶液,B是无色气体单质,反应②、③、④都是工业生产中的重要反应,H与J反应生成的溶液遇苯酚显紫色。(有些反应条件已省略)
26.(16分) A~M有如下图转化关系。已知D、L是相对分子质量相等的两种气体,且含有同一种元素,D是石油化工的重要基础原料,也是一种植物生长调节剂;A、E都是无色溶液,B是无色气体单质,反应②、③、④都是工业生产中的重要反应,H与J反应生成的溶液遇苯酚显紫色。(有些反应条件已省略)
(1) C的化学式_____________,D的电子式_____________。
(2)上述框图中的物质能使溴水褪色的气体是_________________(写化学式)
(3)反应①的化学方程式___________________________________________________
(4) H与J的稀溶液反应的离子方程式_________________________________________
(5) 已知生成1 mol I放出98.3 kJ的热量。写出反应③的热化学方程式 ,工业上进行这一反应的设备是 反应的适宜条件为 。
27.(16分)某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),按要求回答问题。
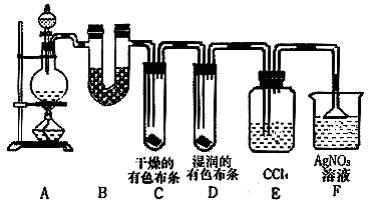
(1)下列方法中,可制得氯气的正确组合是 。
①MnO2和浓盐酸混合共热; ②MnO2、NaCl和浓硫酸混合共热;
③次氯酸钠和浓盐酸混合; ④K2Cr2O7和浓盐酸混合;
⑤KClO3和浓盐酸混合共热; ⑥KMnO4和浓盐酸混合。
A.①②⑥ B.②④⑥ C.①④⑥ D.全部可以
(2)若用含有0.2mol HCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2体积(标准状况下)总是小于1.12L的原因是
。
(3)①装置B的作用是 ,现象是 。
②装置C和D出现的不同现象说明的问题是 。
③装置E的作用是 。
④写出装置F中发生反应的离子方程式 。
(4)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在 与 之间(填装置字母序号),装置中应放入 试剂。
28. 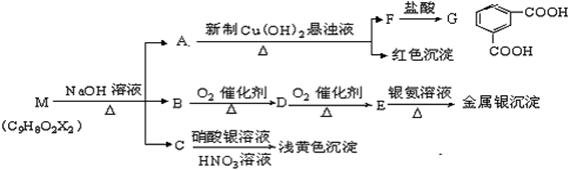 (15分)现有分子式为C9H8O2X2(X为一未知元素)的物质M,可在一定条件下发生上述一系列反应,试回答下列问题:
(15分)现有分子式为C9H8O2X2(X为一未知元素)的物质M,可在一定条件下发生上述一系列反应,试回答下列问题:
(1)A中所含的官能团为 (填名称),上述转化中其中属于氧化反应的共有 步
(填数字);M与NaOH溶液共热时的反应类型是 反应。
(2)M的结构简式为 。
(3)写出下列反应的化学方程式:①B→D: ;
②G与足量CH3CH2OH在浓硫酸催化加热时的反应:
(4)A酸化得到H,H有多种芳香族化合物的同分异构体,其中,要求同时满足以下条件:
①在苯环上只有一个取代基;②1molA与足量NaOH溶液反应,需要消耗2molNaOH。③该物质能发生银镜反应。该有机物与银氨溶液反应的化学方程式:
29.(14分)已知Fe3+的氧化性大于Cu2+,据此性质,某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路。用离子方程式表示其化学原理 。
某实验小组的同学对该厂生产印刷电路后所得的废液进行了分析:取50.00 mL废液,向其中加入0.64 g金属铜,金属铜全部溶解;又取50.00 mL 废液,向其中加入足量的AgNO3溶液,析出沉淀43.05 g。请回答以下问题 (此题的计算结果注意有效数字,即保留两位小数) :
(1)该厂生产后废液中所含金属离子有________________________;
(2)该厂原来使用的FeCl3溶液的物质的量浓度 (反应前后溶液的体积变化忽略不计);
(3)若向500.00 mL废液中加入足量的稀硝酸,在标准状况下生成NO气体4.48 L,则原废液中各金属阳离子的物质的量浓度之比为(要表示出对应的离子)__________________;
(4)另取500.00 mL废液,加入一定量铁屑,充分反应后有铜析出,则所得溶液中Fe2+的物质的量范围为 。
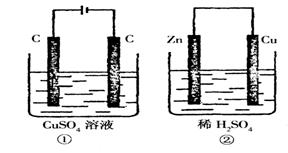 附10.如图所示的两个实验装置中,溶液的体积均为200mL,
附10.如图所示的两个实验装置中,溶液的体积均为200mL,
开始时电解质溶液的浓度均为0.1mol/L,工作一段时间
后, 测得导线中均通过0.02mol电子,若不考虑盐的
水解和溶液体积的变化,则下列叙述中正确的是:( )
A.产生气体的体积:①>②
 B.电极上析出物质的质量:①>②
B.电极上析出物质的质量:①>②
C.溶液的pH变化:①增大,②减小
D.电极反应式:①中阳极:4OH——4e—=O2↑+2H2O;②中负极:2H++2e—=H2↑
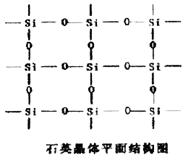
11.设NA为阿伏加德罗常数的值,下列叙述中不正确的是( )
A.已知石英晶体的平面结构如右图所示,60g石英中含有的硅原
子数为NA
B.将铜片溶解于稀硝酸中,每产生lmol气体转移电子数目为3NA
C.34g10%的双氧水中,含有的共价键数目为4NA
D.28gN2与CO的混合气体所含的原子数目为2NA
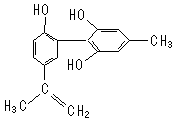 12.我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂。某种兴奋剂的结构简式如下图所示,有关该物质的说法正确的是
( )
12.我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂。某种兴奋剂的结构简式如下图所示,有关该物质的说法正确的是
( )
A.遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
B.滴入KMnO4(H+)溶液,观察紫色褪去,能证明结构中存在碳碳双键
C.1 mol该物质与浓溴水和H2反应时最多消耗Br2和H2分别为4 mol、 7 mol
D.该分子中的所有原子有可能共平面
高三化学测试题答案
四月模考题选3
| 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| D | B | D | C | A | D | C | D |
26.(共16分)
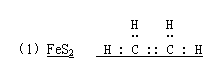

(2)C2 H4 SO2
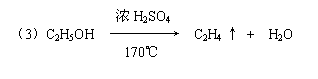

(4)Fe2O3 + 6 H+ ══ 2 Fe3+ + 3 H2O
(5)2 SO2(g)+ O2 (g) ![]() 2 SO3(g) ; △H=-196.6 kJ/mol
2 SO3(g) ; △H=-196.6 kJ/mol
接触室 催化剂 400- 500℃
27.(共16分)(1)D(2分)
(2)浓盐酸的浓度随着反应的进行变稀以后,将不再反应;加热时浓盐酸因挥发而损失(2分)
(3)①证明有水蒸气产生 白色变蓝色(其它合理答案也给分)(2分)②氯气无漂白性,次氯酸有漂白性 (2分)③吸收氯气(2分) ④Ag-+Cl-══AgCl↓(2分)
(4)E F (2分) 湿润的淀粉KI试纸(或湿润的有色布条)(2分)
 |
28(14分)(1)醛基(2分);4步(2分);取代(或水解)(2分) (2) (2分)
(3)①2CH3OH+O2 2HCHO +2H2O (2分)
②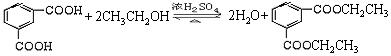 (2分)
(2分)
③![]() (3分)
(3分)
29.(共14分)2Fe3+ + Cu ══ 2Fe2+ + Cu2+ (2分)
(1)Fe3+、Fe2+、Cu2+ (少写或多写均不得分)
(2)2.00 mol/L (没有单位不得分)
(3) c(Fe3+) : c(Fe2+) : c(Cu2+) = 4:6:3 (只有“4:6:3”不得分,要表示出4:6:3对应的离子)
(4)1.20 < n(Fe2+)![]() 1.50
1.50
(此题的计算结果注意有效数字,即两位小数表示,否则整题扣1分)
10B 11C 12C