高三化学下学期四月测试题
四月模考题选4
6.某同学对改善环境提出下列建议:①开发新能源,减少化石燃料的燃烧 ②开发、生产无汞电池 ③分类回收垃圾 ④提倡使用一次性发泡塑料餐具和塑料袋 ⑤提倡使用手帕,减少餐巾纸的使用,你认为可采纳的是
A.①②③④ B.②③④⑤ C.①②③⑤ D.全部
7、证明某溶液中可能含有Fe2+而不含Fe3+,进行如下实验,实验的最佳顺序为 ( )
①通入足量氯气 ②加入足量KMnO4溶液
③加入少量NH4SCN
A.①③ B.③② C.③① D.①②③
8、下列各选项中所述的两个量,前者一定大于后者的是 ( )
A.0.10mol·L-1的醋酸溶液和0.01mol·L-1的醋酸溶液中水的电离程度
B.将pH=4的盐酸和醋酸分别稀释成pH=5的溶液,所加水的量
C.物质的量浓度相等的(NH4)2SO4溶液和(NH4)2CO3溶液中NH![]() 的浓度
的浓度
D.常温下,物质的量浓度相等的CH3COONa溶液和Na2CO3溶液的pH值
9、纽约大学的科学家最近研制出有“双腿”且能在盘子里“散步”的分子机器人,它是由26个氨基酸结合而成的多肽分子。下列说法中正确的是 ( )
A.这种分子机器人是一种新型分子
B.我们已可以用肉眼直接看到这种分子在“散步”
C.分子本身是不会运动的,其“散步”一定是在人的推动下进行的
D.这种分子的组成物质属于有机高分子化合物
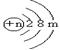 10、由 (,,(m、n均大于0)的原子构成的单质,与盐酸反应有可燃性气体生成。
10、由 (,,(m、n均大于0)的原子构成的单质,与盐酸反应有可燃性气体生成。
该结构中n和m的关系,正确的是 ( )
A.m>n B.0<n<10 C.m=10-n D.m<4
11、实验室有四个药品橱,已存放如下药品
| 药品橱 | 甲 橱 | 乙 橱 | 丙 橱 | 丁 橱 |
| 药 品 | 盐酸、硫酸 | 氢氧化钠、氢氧化钙 | 红磷、硫 | 铜、锌 |
实验室新购进一些活性炭,应将它存放在 ( )
A.甲橱 B.乙橱 C.丙橱 D.丁橱
12.工业上以CaO和HNO3为原料制备Ca(NO3)2·4H2O晶体。为确保制备过程中既不补充水分,也无多余的水分,所用硝酸溶液中溶质的质量分数应为 ( )
A.30% B.63% C.70% D.无法计算
13.有一种锂电池,它是由金属锂和石墨作电极材料,电解质溶液是由四氯化铝锂(LiAlCl4)
O
溶解在亚硫酸氯(Cl—S—Cl)中形成的,电池的总反应方程为:
8Li+3SOCl2=6LiCl+Li2SO3+2S 下列叙述正确的是 ( )
A.电池工作过程中,SOCl2被还原为Li2SO3 B.锂作电池的正极,石墨作电池的负极
C.若电解质溶液中混有少量水,对电池反应无影响
D.电池工作过程中,锂提供的电子与折出硫的物质的量比为4:1
选择题答题栏
| 题 号 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答 案 |
26.(10分)科学家从化肥厂生产的(NH4)2SO4中检出组成为N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO![]() 和N4H
和N4H![]() 两种离子存在,植物的根系极易吸收N4H
两种离子存在,植物的根系极易吸收N4H![]() 离子,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。请回答下列问题:
离子,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。请回答下列问题:
(1)N4和N2的关系正确的是( )
A.同种单质 B.同位素 C.同分异构体 D.同素异形体
(2)N4H4(SO4)2 (填“能”或“不能”)和草木灰混合施用。
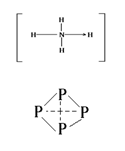
(3)已知白磷、NH![]() 、N4H
、N4H![]() 的空间构型均为正四面体,NH4+的结构式为
的空间构型均为正四面体,NH4+的结构式为
 +
+
(→表示共用电子对由N原子单方面提供),白磷(P4)的结构式
为
请画出N4H![]() 的结构式
的结构式
![]() (4)已知液氨中存在着平衡:2NH3
NH
(4)已知液氨中存在着平衡:2NH3
NH![]() +NH2-。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH
+NH2-。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH![]() 生成N4分子,请写出液氨与氢氧化铯反应的化学方程式
生成N4分子,请写出液氨与氢氧化铯反应的化学方程式
27.(16分)7、A、B、C是常见的金属化合物的水溶液,A溶液的焰色为黄色。M是常见的共价挥发性氢化物,N为M的最高价氧化产物的水溶液,将M分别通入A、B的反应如下
图所示,M与C溶液不发生反应。
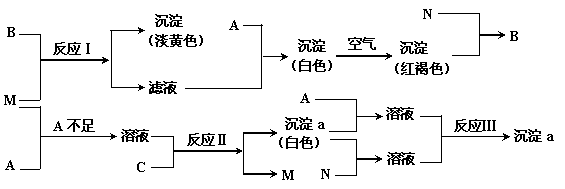
⑴写出化学式:A ,B ,M ,N ;
⑵写出下列反应的离子方程式:
反应Ⅰ: ; 反应Ⅱ: ;反应Ⅲ: 。
28.(18分)2005年的诺贝尔化学奖颁给了3位在烯烃复分解反应研究方面做出突出贡献的化学家。烯烃复分解反应实际上是在金属烯烃络合物的催化下实现C=C双键两边基团换位的反应。如下图表示了两个丙烯分子进行烯烃换位,生成两个新的烯烃分子——丁烯和乙烯。

现以石油裂解得到的丙烯为原料,经过下列反应可以分别合成重要的化工原料I和G。I和G在不同条件下反应可生成多种化工产品,如环酯J。
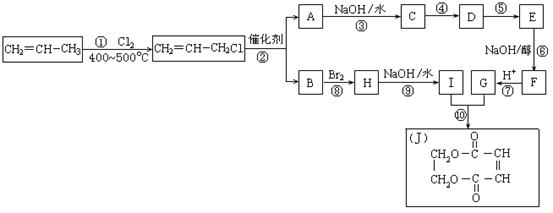 请按要求填空:
请按要求填空:
⑴写出下列反应的反应类型:
①:______________,⑥:______________,⑧:______________。
⑵反应②的化学方程式是___________________________________________。
⑶反应④、⑤中有一反应是与HCl加成,该反应是________(填反应编号),设计这一步反应的目的是_________________________________________,物质E的结构简式是_______________ ________。
⑷反应⑩的化学方程式是___________________________________________。
⑸C的同分异构体很多,写出满足下列条件的同分异构体的结构简式:①含有酯基 ②能发生银镜反应:
|
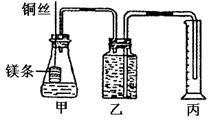
(1)请将该实验的主要操作步骤补充完全:
①配制浓度均为1mol·L-1的盐酸和醋酸溶液;
②用 量取10.00mL 1mol·L-1盐酸和醋酸分别加入两个锥形瓶中;
③分别称取除去表面氧化膜的镁带ag,并系于铜丝末端,a的数值要大于 。
④在广口瓶中装足量的水,按图连接好装置并检查装置的气密性。
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触),至反应完全,记录
和反应后量筒中水的体积。
⑥反应结束后待温度恢复到室温,读出量筒中水的体积为VmL。(包括导管里的水)
(2)本实验中应选用 (填序号)的量筒。
A.100mL B.200mL C.500mL
(3)若水蒸气的影响忽略不计,在实验室条件下,气体摩尔体积的计算式为:
Vm= L·mol-1
(4)简述速率不等的原因
(5)写出醋酸和镁带反应的离子方程式:
高三化学测试题答案
四月模考题选4
6.C 7.C 8.C 9.A 10.D 11.C 12.C 13.D
26. (1)D(2分)
(2)不能(2分)
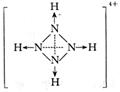
(3)
(4)8NH3+4CsOH=N4+4CsNH2+6H2↑+4H2O(3分)
27.⑴A、NaOH B、Fe2(SO4)3 M、H2S N、H2SO4
⑵Ⅰ、2Fe3++H2S=2Fe2++S↓+2H+
Ⅱ、Al3++3HS-+3H2O=Al(OH)3↓+3H2S
Ⅲ、Al3++3AlO2-+6H2O=4Al(OH)3↓
28、(共18分)
⑴ 取代反应 消去反应 加成反应 (3分)
⑵![]() (2分)
(2分)
⑶ ④ 保护A分子中碳碳双键不被氧化 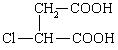 (6分)
(6分)
(4)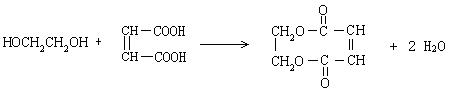 (3分)
(3分)
⑸HCOOCH2CH2CH3 HCOOCH(CH3)2 (4分)
29.(1)②酸式滴定管(2分) ③0.12(3分) ⑤反应时间(2分)
(2)B(2分)
(3)0.2V(3分)
(4)盐酸为强酸,醋酸为弱酸,相同浓度的盐酸和醋酸,盐酸电离出H+浓度要大。(3分)
(5)Mg+2CH3COOH Mg2++2CH3COO-+H2↑(3分)