高三化学下学期月考试卷
时间:90分钟 总分:110分
可能用到的原子量:H-1 Li-7 C-12 N-14 O-16 F-19 Al―27
P-31 S―32 Cl-35.5 Fe―56 Cu―64 Ag―108
一、选择题(共54分),每小题3分,只有一个正确选项,答案写在答题栏中。
1.旨在限制发达国家温室气体排放量、抑制全球范围内气候持续变暖的《京都议定书》随着俄罗斯的加入,将于2005年2月16日正式生效。我国二氧化碳的排放量位居世界第二,为减少二氧化碳这种温室气体的排放,下列措施不切实际的是
A.大力开发氢能源 B.充分利用太阳能
C.不使用含碳能源 D.提高能源利用率
2.下列有关物质的结构或性质的叙述错误的是
A.由极性键形成的分子不一定是极性分子
B.水是一种非常稳定的化合物,这是由于氢键所致
C.石英、食盐、金属钠、干冰的熔点依次降低
D.分子晶体中一定存在分子间作用力,可能有共价键
3.下列关于硅和二氧化硅的叙述不正确的是
A. 晶体硅和二氧化硅晶体的结构都类似于金刚石
B. 晶体硅和二氧化硅晶体都常用来制造电子部件
C. 硅和二氧化硅都不与酸(氢氟酸除外)反应
D. 硅和二氧化硅都广泛存在于自然界中,天然单质硅叫硅石
4.下列物质提纯的方法正确的是
A.除去混在NO2中的NO:将气体与过量O2混合
B.除去混在CO2中的SO2:将气体依次通过足量酸性KMnO4溶液和浓硫酸
C.除去KCl溶液中的K2CO3:加入过量BaCl2溶液后过滤
D.除去乙酸中混有的乙醇:向混合液中加入生石灰后蒸馏
5.居室装修用石材的放射性常用![]() 作为标准,居里夫人(Marie Curie)因对Ra元素的研究两度获得诺贝尔奖。下列叙述中正确的是
作为标准,居里夫人(Marie Curie)因对Ra元素的研究两度获得诺贝尔奖。下列叙述中正确的是
A.一个![]() 原子中含有138个中子
原子中含有138个中子
B.Ra元素位于元素周期表中第六周期ⅡA族
C.RaCl2的熔点比CaCl2高
D.Ra(OH)2是一种两性氢氧化物
6.2004年7月德俄两国化学家共同宣布,在高压下氮气会聚合生成高聚氮,这种高聚氮的晶体中每个氮原子都通过三个单键与其它氮原子结合并向空间发展构成立体网状结构。已知晶体中N-N键的键能为160 kJ·mol-1,而N≡N的键能为942 kJ·mol-1(键能表示形成化学键释放的能量或者破坏化学键消耗的能量)。则下列有关说法不正确的是
A.键能越大说明化学键越牢固,所构成物质越稳定
B.高聚氮晶体属于原子晶体
C.高聚氮晶体中n(N)∶n(N-N)=1∶3
D.用作炸药或高能材料可能是高聚氮潜在的应用
7用NA表示阿伏加德罗常数的值,下列说法中正确的是
A.4 g重水(D2O)中所含质子数为0.2 NA
B.4.48 L N2与CO的混合物所含分子数为0.2 NA
C.6.2 g白磷与红磷的混合物中所含磷原子数为0.2 NA
D.12.5 mL 16 mol·L-1浓硫酸与足量铜反应,转移电子数为0.2 NA
8.某无色溶液中滴入酚酞试液显红色,该溶液中可以大量共存的离子组是
A.Mg2+、Al3+、HCO3-、SO32- B.K+、Ca2+、MnO4-、Cl-
C.Ba2+、Na+、AlO2-、NO3- D.NH4+、Fe3+、SO42-、SCN-
9.下列反应的离子方程式书写正确的是
A.溴化亚铁溶液中通入过量氯气:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
B.碳酸氢铵溶液与足量烧碱溶液反应:HCO3-+OH-=CO32-+H2O
C.铁屑溶于过量稀硝酸:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
D.苯酚钠溶液中通入足量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32-
10.A、B、C为三种短周期元素,A、B在同周期, A、C的最低价离子分别为A2-和C-,B2+和C-具有相同的电子层结构。下列说法中正确的是
A.原子序数:A>B>C B.原子半径:A>B>C
C.离子半径:B2+>C->A2- D.原子核外最外层电子数:A>C>B
11.关于某无色溶液中所含离子的鉴别,下列判断正确的是
A.加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有Cl-存在
B.加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有SO42-存在
C.通入Cl2后,溶液变为黄色,加入淀粉溶液后溶液变蓝,可确定有I-存在
D.加入盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定有大量CO32-
12.类推的思维方法在化学学习和研究中常回产生错误的结论,因此类推出的结论要经过实践的检验才能决定其正确与否.下列几种类推结论中正确的是
A.Mg失火不能用CO2灭火;Na失火也不能用CO2灭火
B.Fe3O4可写成FeO·Fe2O3;Pb3O4可写成PbO·Pb2O3
C.不能用电解熔融AlCl3来制取金属铝;也不能用电解熔融MgCl2来制取金属镁
D.Fe与S不能直接化合生成Fe2S3;Al与S也不能直接化合也可以生成Al2S3
13.ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:
2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O下列说法正确的是
2ClO2↑+K2SO4+2CO2↑+2H2O下列说法正确的是
A.KClO3在反应中得到电子 B.ClO2是氧化产物
C.H2C2O4在反应中被还原 D.1 molKClO3参加反应有2mol电子转移
14.在一定的温度下,向饱和的烧碱溶液中放入一定量的过氧化钠,充分反应后恢复到原来
的温度,下列说法正确的是
A.溶液中溶液中Na+浓度增大,有O2放出
B.溶液中OH-总数不变,有O2放出
C.溶液的pH增大,有O2放出
D.溶液中Na+总数减少,有O2放出
15.把![]() M和
M和![]() N混合于
N混合于![]() 的密闭容器中,发生反应
的密闭容器中,发生反应![]() ,5min后达平衡,容器内压强变小,已知Q的速率为
,5min后达平衡,容器内压强变小,已知Q的速率为![]() min,则下列说法错误的是
min,则下列说法错误的是
A、M的反应速率为![]() min B、平衡时N的转化率为20%
min B、平衡时N的转化率为20%
C、平衡时P的浓度为![]() D、平衡时容器内的压强为原来的0.8倍
D、平衡时容器内的压强为原来的0.8倍
16.在容积为672![]() 的烧瓶中充满
的烧瓶中充满![]() 、
、![]() 混合气体,将其倒立在水槽里并缓慢通入280
混合气体,将其倒立在水槽里并缓慢通入280![]()
![]() ,恰好完全反应,且烧瓶内充满液体,下列表达正确的是(均为标况下)
,恰好完全反应,且烧瓶内充满液体,下列表达正确的是(均为标况下)
A、总反应为![]()
B、总反应为![]()
C、生成![]() 的浓度约为
的浓度约为![]()
D、生成![]() 的物质的量约为
的物质的量约为![]()
17. 甲、乙两位同学各取相同的![]() 溶液
溶液![]() ,甲将溶液加热蒸发掉
,甲将溶液加热蒸发掉![]() 后冷却到20℃析出
后冷却到20℃析出![]() 晶体,乙将溶液蒸发掉
晶体,乙将溶液蒸发掉![]() 水后也冷却到20℃,析出
水后也冷却到20℃,析出![]() 晶体,则原
晶体,则原![]() 溶液的质量分数为
溶液的质量分数为
A、32% B、24.2% C、22.2% D、16.7%
18.最新研究表明生命起源于火山爆发,是因为火山爆发产生的气体中含有1%的羰基硫(COS),已知羰基硫分子中所有原子均满足八电子结构,下列有关说法中正确的是( )
A.羰基硫的电子式为 B.羰基硫属于非极性分子
C.羰基硫中三个原子处于同一直线上 D.羰基硫沸点比CO 低

 选择题答案
选择题答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
二、 填空题:( 每空两分共24分)
16.为防止碘缺乏病,,通常在食盐中加入KIO3。
⑴用淀粉碘化钾溶液和稀硫酸可定性检验出食盐中的IO3-,表示该反应的离子方程式是
_______________________________________,若要确认食盐中还含有K+,方法是_______________________________________________。
⑵工业上以石墨和铁为电极电解KI溶液制取KIO3。电解时,石墨作________(填“阳极”
或“阴极”),石墨电极上的电极反应式是_______________________,电解过程中铁电极附近溶液pH__________(填“变大”、“变小”或“不变”)。
17. 有四种同族的物质,它们的沸点(℃,P=1.01×105Pa)如下表所示:
| ① | He -268.8 | Ne -249.5 | Ar (x) | Kr -151.7 |
| ② | F2 -187.0 | Cl2 -33.6 | (a) 58.7 | I2 184.0 |
| ③ | HF (y) | HCl -84.0 | HBr -67.0 | HI -35.3 |
| ④ | H2O (z) | H2S -60.2 | (b) -42.0 | H2Te -1.8 |
试根据上表回答下列问题:
(1)常温下,a为_______色液体;b的分子式为:_______。
(2)写出②系列中物质主要化学性质的递变规律(任写一种)_____________________ ___________________________
(3)除极少数情况外,上述四种系列中物质的沸点与相对分子质量之间均存在一定的关系,该关系是________________________________________________。
(4)上表中,_______和_______两种物质的沸点较同系列其它物质反常,反常的主要原因是___________________ _________________ ___
三、推断题(每空2分共10分)
18.下图表示各物质之间的转化关系。已知:A、B、I都是XY2型化合物,且阳离子相同,A、B晶体中阴、阳离子个数比都是1∶1,但I晶体中阴、阳离子个数比是2∶1,I常用作干燥剂。
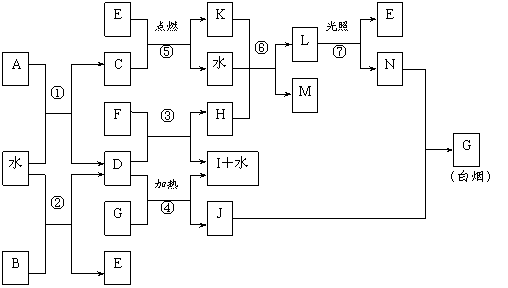 |
请按要求填空:
⑴G的电子式是_______________;
⑵反应⑥的化学方程式是__________________________________,反应⑤在空气中发生时的现象是________________________________,已知C的燃烧热是1300 kJ·mol-1,表示C的燃烧热的热化学方程式是________________________________________。
⑶根据上图中物质之间的转化关系及题中所给信息判断,B的化学式是_________。
四、实验题:(每空两分共14分)
19.工业上用固体硫酸亚铁制取颜料铁红(Fe2O3),反应原理是:
2FeSO4 ![]() Fe2O3+SO2↑+SO3↑。某研究性学习小组用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeSO4的质量。(SO2沸点为-10.02℃)
Fe2O3+SO2↑+SO3↑。某研究性学习小组用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeSO4的质量。(SO2沸点为-10.02℃)
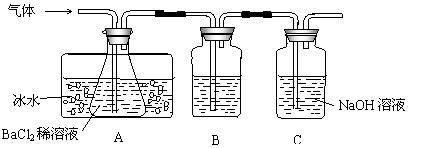 |
请回答相关问题:
(1)A瓶所盛试剂的作用是 ;B瓶所盛的试剂是 ;C瓶所盛试剂的作用是 。
(2)A瓶要用冷水冷却的原因是 。
(3)将此反应生成的气体通入A瓶BaCl2溶液中,则 。(填编号)
A.析出BaSO3沉淀 B.析出BaSO4沉淀
C.逸出SO3气体 D.逸出SO2气体
理由是 。
(4)反应后若用A瓶内的混合物来测定已分解的FeSO4的质量,其实验操作的第一步是(简述操作步骤)
。
五、计算题(共7分)
20.在100![]() 溶液中加入
溶液中加入![]() 混合固体,加热后充分反应,下图表示加入固体质量与产生气体体积(标况下)关系:
混合固体,加热后充分反应,下图表示加入固体质量与产生气体体积(标况下)关系:
试计算:
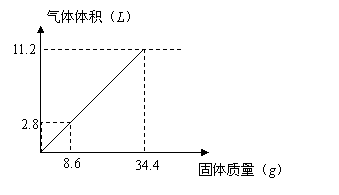 |
(1)![]() 溶液的物质的量浓度。(3分)
溶液的物质的量浓度。(3分)
(2)若![]() 溶液为
溶液为![]() ,固体为
,固体为![]() 时充分反应时产生气体的体积(标况)(3分)
时充分反应时产生气体的体积(标况)(3分)
(3)若![]() 溶液为
溶液为![]() ,固体仍为
,固体仍为![]() 时充分反应时产生气体的体积(标况)(2分)
时充分反应时产生气体的体积(标况)(2分)
化学试卷答案
总分:110分
一、选择题答案(共54分),每小题3分,
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | C | B | D | B | A | C | C | C | A | A | C | B | A | D | D | B | C | C |
二、 填空题:( 每空两分共24分)
19.IO3-+5I-+6H+=3I2+3H2O 取食盐做焰色反应实验,若透过蓝色钴玻璃观察焰色呈紫色,说明有K+。
⑵阳极 I-+3H2O-6e-=IO3-+6H+ 变大
20. (1)深红棕色:H2Se。
(2)单质的氧化性越来越弱 或氢化物的稳定性越来越弱 或其他
(3)相对分子质量越大,熔沸点越高。
(4)HF H2O ;分子中含有氢键,所以熔沸点较高
三、推断题(每空2分共10分)
21.⑴![]()
⑵Ca(ClO)2+CO2+H2O=CaCO3+2HClO
火焰明亮并伴有浓烈黑烟
CH≡CH(g)+![]() O2(g)→2CO2(g)+H2O(l);ΔH=-1300 kJ·mol-1
O2(g)→2CO2(g)+H2O(l);ΔH=-1300 kJ·mol-1
⑶CaO2
四、实验题:(每空两分共14分)
22. (1)检验并吸收SO3;品红试液;吸收SO2 。
(2) SO3与H2O反应,放出大量的热 。
(3)B、D。 SO2、SO3的混合气体溶于水,发生反应SO3+H2O=H2SO4,同时放出大量的热,使SO2的溶解度减少而逸出SO2气体,又由H2SO4与BaCl2反应析出BaSO4沉淀,在酸性溶液中不可能产生BaSO3沉淀。
(4)A瓶中滴入BaCl2溶液,直至不再产生新的沉淀。
五、计算题(共8分)
23⑴ NH4+ ~ OH- ~ NH3↑
0.5 0.5
∴c(NaOH)===5mol·L-1
⑵n(NH3)==0.125mol
![]()
![]() 80x+132y=8.6 x=0.025mol
∴=
80x+132y=8.6 x=0.025mol
∴=
x+2y=0.125 y=0.05mol
设51.6g有 amol NH4NO3,2amol (NH4)2SO4
80a+132×2a=51.6 a=0.15mol
共n(NH4+)=0.15+0.15×2×2=0.75mol
而n(NaOH)=0.14×5=0.7mol ∴NaOH不足
V(NH3)==0.7×22.4=15.68L
⑶n(NaOH)=0.18×5=0.9mol>0.75mol ∴ NH4+不足
∴V(NH3)=0.75×22.4=16.8L