高三化学四月月考试题
可能用到的相对原子质量:H-1 C-12 O-16 Br-80 Ag-108
6.下列叙述正确的是 ( )
A.同一主族的元素,原子半径越大,其单质的熔点越高
| |
的最高化合价X<Y
C.晶体熔化时,化学键不一定发生断裂
D.将pH=2,体积相同的盐酸和醋酸溶液均稀释100倍后,分别加入足量的相同颗粒大
小的锌,产生H2的起始速率相同,醋酸放出的氢气多
7.NA表示阿伏加德罗常数,下列叙述中正确的是 ( )
A.100mL 1mol/L CH3COONa溶液含CH3COO—的数目是0.1NA
B.通常状态下,NH4+和NH2—各1mol含有的电子数均为10NA
C.标准状况下,11.2L溴乙烷中含0.5NA个溴原子
D.已知熔融条件下的反应:Fe2O3+3Na2O2=2Na2FeO4+Na2O,则234g Na2O2发生反应,
转移的电子数为12NA
8.下列离子方程式正确的是 ( )
A、三氯化铝溶液中加入过量氨水:Al3++3OH―![]() Al(OH)3↓
Al(OH)3↓
B、4mol/L的NaAlO2溶液和7mol/L的HCl等体积互相均匀混合:
4AlO2―+7H++H2O![]() 3Al(OH)3↓+Al3+
3Al(OH)3↓+Al3+
C、K37ClO3与浓盐酸(HCl)在加热时生成氯气:
K37ClO3 + 6HCl = K37Cl + 3Cl2↑+ 3H2O
D、将0.1mol/L盐酸数滴缓缓滴入0.1mol/L25mLNa2CO3溶液中,并不断搅拌:
2H++CO32-![]() CO2↑+H2O
CO2↑+H2O
![]() 9.由于反应条件的改变使某容器的平衡mA(g)+nB(g) pC(g);△H<0向正反应方向发
9.由于反应条件的改变使某容器的平衡mA(g)+nB(g) pC(g);△H<0向正反应方向发
生了移动。新的平衡状态与原平衡状态相比,下列判断正确的是 ( )
A.容器内的温度一定升高 B.正反应速度可能变大,也可能变小
C.容器中C物质的浓度一定升高 D.容器中B物质的浓度一定降低
10.要求设计实验证明,某种盐的水解是吸热的,有四位学生分别作出如下回答,其中正确的是( )
A.甲学生:在醋酸钠溶液中滴入酚酞试液,加热后若红色加深,说明盐类水解是吸热的
| |
C.丙学生:在盐酸中加入相同温度的氨水,若实验过程中混和液温度下降,说明盐类水解是吸热的
D.丁学生:在醋酸钠溶液中加入醋酸钠晶体,若溶液温度下降,说明盐类水解是吸热的
11.下列各组离子一定能大量共存的是 ( )
A.含有大量Fe3+的溶液中:NH4+、Na+、I-、SCN-
B.在强碱溶液中:Na+、K+、AlO2-、CO32-
C.在c(H+)=1×10-13mol·L-1的溶液中:NH4+、Al3+、SO42-、NO3-
D.在pH=1的溶液中:K+、Fe2+、Cl-、NO3-
12.关于下列各装置图的叙述中,不正确的是 ( )
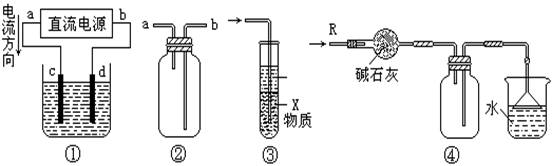
|
A.装置①中,d为阳极、c为阴极
B.装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体
C.装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸
D.装置④可用于干燥、收集NH3,并吸收多余的NH3
13.把SO2通入Fe(NO3)3溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,这时若滴入BaCl2溶液,会产生白色沉淀。在上述一系列变化过程中,最终被还原的是 ( )
A.SO2 B.Cl - C.Fe3+ D.NO3 -
26.(17分)
![]() Ⅰ:在一定条件下,反应xA + yB zC达到平衡.
Ⅰ:在一定条件下,反应xA + yB zC达到平衡.
(1)若A、B、C均为气体,减压后平衡向逆反应方向移动,则x、y、z间的关系是______.
(2)已知C是气体,且x + y = z,在增大压强时,若平衡发生移动,则一定向(填“正”
或“逆”)反应方向移动.
(3)已知B、C是气体,当其他条件不变时,增大A的物质的量,平衡不移动,则A为
_____态.
(4)加热后C的质量分数减少,则正反应是_________(填“放热”或“吸热”)反应.
Ⅱ:短周期中的A、B、C、D、E5种元素,原子序数依次增大,A、D同主族;A、B
的原子序数之和等于C的原子序数;C2-离子与D+离子的核外电子数相等;B原子与D+
离子核外电子数之和等于E原子的核外电子数,且D、E两元素能形成微粒个数比为1∶
1的离子化合物.
(1)A、B、C、D、E的元素符号依次为_______、_______、_______、_______、_______.
(2)D、E元素可组成化合物甲,用石墨为电极电解甲的水溶液时,阳极的电极反应式
为____________________________________________,阴极区溶液的pH_______.
(3)A、C元素可组成原子个数比为1∶1的共价化合物乙,将E单质通入乙的水溶液中,
生成一种强酸,并有气体放出,反应的化学方程式为_________________________
________________________________.
(4)A、B、C、D、E中的任意三种元素可组成多种化合物,X和Y是其中的两种,X
和Y都是既含离子键又含共价键的离子化合物;将X、Y分别溶于水时,X能促进
水的电离,而Y能抑制水的电离,X水溶液的pH<7,Y水溶液的pH>7.
将0.2mol·L-1的X溶液与0.1mol·L-1的Y溶液等体积混合后,溶液呈碱性.请判断:
①X的化学式为__________,Y的化学式为_________ .
②混合溶液中各种带电微粒的物质的量浓度由大到小的顺序为
______________________________________________________.
27.(14分) 向溴水中加入足量的乙醛溶液,可以看到溴水褪色,对产生该现象的原因有如下三种猜想:
①溴水与乙醛发生取代反应;
②由于乙醛分子中有不饱和键,溴水与乙醛发生加成反应;
③由于乙醛具有还原性,溴水将乙醛氧化为乙酸。为探究哪种猜想正确,一研究性学习小组提出了如下两种实验方案:
方案一:检验褪色后溶液的酸碱性;
方案二:测定反应前溴水中Br2的物质的量(忽略反应前溶液中Br—离子的物质的量)和反应后溶液中Br—离子的物质的量。
⑴方案一是否可行 填“是”或“否”),
理由是 。
⑵假设测得反应前溴水中Br2的物质的量为amol,若测得反应后n(Br—)= mol,
则说明溴水与乙醛发生取代反应;若测得反应后n(Br—)= mol,则说明溴水与
乙醛发生加成反应;若测得反应后n(Br—)= mol,则说明溴水将乙醛氧化为乙酸。
⑶按物质的量之比为1:5配制1000mLKBrO3—KBr溶液,该溶液在酸性条件下完全反应可生成0.5molBr2。 取该溶液10mL加入足量乙醛溶液,使其褪色,然后将所得溶液稀释为100mL,准确量取其中10mL,加入过量的AgNO3溶液,过滤、洗涤、干燥后称量得到固体0.188g。若已知CH3COOAg易溶于水,试通过计算判断溴水与乙醛发生反应的类型为 (选填猜想序号)。
⑷写出上述测定过程中的三个反应的离子方程式:
①KBrO3和KBr在酸性条件下的反应 : ;
②溴水与乙醛的反应: ;
③测定Br—离子含量的反应: ;
28.(15分)A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件均未列出,部分生成物已经略去)。
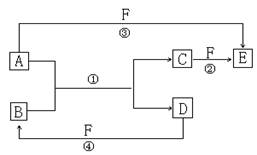
(1)若A、D、F都是非金属单质,且A、D所含元素同主族,A、F所含元素同周期,则物质B的名称是 ,分子E的电子式是 。
(2)若A是常见金属单质,与B的水溶液反应生成C和D。D、F是气体单质。则A所对应的元素在周期表位置是 ,反应②(在水溶液中进行)的离子反应方程式是 。
(3)若A、D为短周期元素所组成的单质,一种为金属,另一种为非金属。且③④两个反应都有红棕色气体生成,则反应①、④的化学方程式分别为
① ;
④ 。
29.(14分)由C、H、O三种元素组成的有机物A,相对分子质量104。将0.1molA充分燃烧后,将产物依次通入足量浓硫酸和氢氧化钠溶液,浓硫酸增重7.2g,氢氧化钠溶液增重17.6g。
回答下列问题:
(1)有机物A的分子式为 。
(2)A能发生消去反应,也能与碳酸氢钠反应。A中含有的官能团的名称是 。
(3)A与浓硫酸共热可生成一种由五个原子构成的环状化合物B。写出化学方程式
。
(4)A与浓硫酸共热还可以生成一种能使Br2的四氯化碳溶液褪色的化合物C。写出A生成C的化学方程式 。
反应类型 。
利用C可以合成高分子化合物D,D的结构简式是 。
(5)A的一种同分异构体E,经测定分子结构中含有一个—CH3,两个—CH—;能与银氨溶液反应产生银镜现象。写出E与Ag(NH3)2OH溶液反应的化学方程式
。
参考解答
6C 7B 8 B 9 B 10A 11 B 12A 13D
26.(17分)Ⅰ(1)x+y>z(1分);(2)逆(1分);(3)液态或固态(1分);(4)放热(1分)。Ⅱ(1)H、N、O、Na、Cl(各1分);(2)2Cl--2e-=Cl2↑(1分),大于7(或升高)(1分);(3)Cl2+H2O2=2HCl+O2↑(答HClO+H2O2=HCl+O2↑+H2O可得分)(2分);(4)①NH4Cl或NH4NO3(1分),NaOH(1分);②c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+)或c(NO3-)>c(NH4+)>c(Na+)>c(OH-)>c(H+)(2分)。
27.(14分) ⑴否(1分),溴水中含有HBr,溶液本身呈酸性(2分);
⑵a 0 2a(各1分) ⑶③(2分)
⑷①BrO3-+5Br-+6H+=3Br2+3H2O (2分)
②CH3CHO+Br2+H2O→CH3COOH+2H++2Br-(2分)
③Ag++Br-=AgBr↓(2分)
28.(15分)(1)二氧化硅(2分) ![]() (2分)
(2分)
(2)第四周期、第VIII族(2分) 2Fe2++Cl2===2Fe3++2Cl- (3分)
(3)2Mg+CO2![]() 2MgO+C(3分) C+4HNO3(浓)
2MgO+C(3分) C+4HNO3(浓) ![]() CO2↑+4NO2↑+2H2O(3分)
CO2↑+4NO2↑+2H2O(3分)
29.(14分)(1)C4H8O3(2分) (2)羟基、羧基(2分)
|
![]()
![]()
![]() (3)CH2—CH2—CH2—COOH
O+H2O (2分)
(3)CH2—CH2—CH2—COOH
O+H2O (2分)
![]()
![]() OH
CH2——C
OH
CH2——C
|
![]()
![]() (4)CH2—CH2—CH2—COOH CH2=CH—CH2—COOH+ H2O (2分)
(4)CH2—CH2—CH2—COOH CH2=CH—CH2—COOH+ H2O (2分)
OH
![]()
![]()
![]() 消去反应:(1分)
[ CH—CH ] (2分)
消去反应:(1分)
[ CH—CH ] (2分)
|
![]()
![]()
![]()
![]()
![]() (5)CH3—CH—CH—CHO+2Ag(NH3)2OH CH3—CH—CH—COONH4+3NH3+2Ag↓+ H2O(3分)
(5)CH3—CH—CH—CHO+2Ag(NH3)2OH CH3—CH—CH—COONH4+3NH3+2Ag↓+ H2O(3分)
OH OH OH OH