专题一 基本概念(请参考修改)
【考点分析】
1.物质的组成、性质、分类和变化,此类试题考查的主要内容有:
(1)知道物质的分子、原子、离子、元素等概念的含义及原子团的定义。
(2)能对物理变化和化学变化的区别和联系。
(3)能判断混合物和纯净物、单质和化合物、金属和非金属。
(4)能判断同素异形体。
(5)认识酸、碱、盐、氧化物的概念及其相互联系。
(6)能正确区分化学反应的四种基本类型:化合、分解、置换、复分解。
2.化学用语,此类试题考查的主要内容有:
(1)熟记并正确书写常见元素的名称、符号、离子符号。
(2)记住常见元素的化合价。能根据化合价正确书写化学式(分子式)
(3)能正确书写电子式、原子结构示意图、分子式、结构式和结构简式。
(4)知道质量守恒定律的含义。能正确书写化学方程式、热化学方程式、离子方程式、电离方程式、电极反应式。
3.溶液,此类试题考查的主要内容有:
(1)知道溶液的含义、溶液的组成,知道溶质质量分数的表示并进行计算。
(2)认识饱和溶液、不饱和溶液、溶解度以及温度对溶解度的影响及溶解度曲线。
(3)初步了解结晶、结晶水、结晶水合物、风化、潮解的概念。
(4)能判断胶体,知道它的重要性质和应用。
4.化学基本概念可以说滲透到每一道化学试题当中。一般来说,直接考查基本概念的试题意在考查考生对大纲要求的有关化学基本概念是否真正清晰,历年高考中此类题一般难度都不太大。此类试题一般以选择题或填空题为主。每年高考中必考。
【典型例析】
| 光 O3 光 ClO + O |
【例1】1995年诺贝尔化学奖授予致力研究臭氧层被破坏问题的三位化学家。大气中的臭氧层可滤除大量的紫外光,保护地球上的生物。氟里昂(如CCl2F2)可在光的作用下分解,产生Cl原子,Cl原子会对臭氧层产生长久的破坏作用(臭氧的分子式为O3)。有关反应为
(1)在上述臭氧变成氧气的过程中,Cl是 ;
A.反应物 B.生成物 C.中间产物 D.催化剂
(2) 臭氧和氧气是 。
A.同分异构体 B.同系物
C.氧的同素异形体 D.氧的同位素
【解析】此题是以环保知识为题材的信息题。信息内容起点高,但只是考查了中学化学中催化剂、同素异形体两个基本概念。只要这两个概念的实质弄清楚,便能很快选出答案。
【答案】(1)D;(2)C。
【点评】 化学基本概念是每年高考必考的内容,在化学复习中务必引起足够的重视。对一些重要的概念要逐字逐句的加以记忆。对一些容易混淆的概念,如本题所涉及的几个概念最好采取分析对比的记忆的方法,这样才能更好的记准、记实。
【例2】下列叙述中正确的是
A.酸酐一定是酸性氧化物 B.碱性氧化物一定是金属氧化物
C.金属氧化物一定是碱性氧化物 D.非金属氧化物一定是酸性氧化物
【解析】本题是在物质分类本质理解透彻基础上再加实例验证的分析、对比、判断试题。酸酐是含氧酸失水后的产物。如:乙酸的酸酐为(CH3CO)2O,可见酸酐不一是氧化物;碱性氧化物和金属氧化物,非金属氧化物和酸性氧化物是不同分类原则指导下的不同分类,它们可能相容、相交、相对。如:在金属氧化物中,Al2O3是两性氧化物,Mn2O7(HMnO4的酸酐) 为酸性氧化物,可见金属氧化物不一定是碱性氧化物,非金属氧化物中,CO、NO等属不成盐氧化物。
【答案】 B。
【点评】本题主要考查德考生对物质分类方面的一些基本概念是否真正理解,如果对概念的内涵和外延理解不透彻,四个选项都很容易被错选。同学们在复习基本概念时不能只是死记硬背,要注意理解,要注意对概念的内涵和外延要把握准确,一般说来,学习中概念的内涵易把握,但概念的外延不易被大家重视。
【方法归纳】
1. 方法与技巧
(1)一般采用“概念比对法”或“反例否定法”等。化学基本概念的有关知识比较零碎,容易混淆,我们在记忆时一定要记牢,特别是一些概念、定义中的关键字更是要记忆准确,这是解这类化学题的关键。
(2)此类题有不少是选择题,我们再充分利用选择题的特点,采用筛选法、排除法、估算法等各种方法会使解题的速度和准确性大大提高。
2. 解题注意点
认真阅读试题,弄清题目中问的是什么?给出的条件是什么?列出解题的关键字词,是解答此类试题的关键。不少考生由于不深入地观察思考,对题设条件以点盖面、以偏盖全,忽视了题中的隐含条件,匆忙地依靠熟题效应,简单地给出答案,结果造成错误。
3.命题趋向
多年来高考对基本概念的考查,无论是内容还是难度方面都较为稳定,估计近几年也不会有很大的变化。但在题型方面的多样化还是有可能的,如出现基本概念的简答题等,基本概念与其他部分化学知识和能力的相互渗透和结合将会有所加强。
【专题训练】(分课堂训练和课后训练,前者以高考试题为主,题量在5-8题之间,后者题量在15-20题之间。)
1. 下列变化中不属于化学变化的是
A.油脂的硬化 B.S8受热后变为S2
C.萘的升华
D.![]() Ra →
Ra → ![]() Rn +
Rn + ![]() He
He
2.下列各组物质中都属于纯净物是:
A.福尔马林、水、醋酸 B.盐酸、二氧化碳、胆矾
C.明矾、四氧化三铁、碱式碳酸铜 D.苯、汽油、酒精
3.主要成分为复盐的是
A.光卤石 B.重晶石 C.冰晶石 D.石灰石
4.下列各组物质的化学式均能表示其分子组成的是
A.CO2 SO2 P(红磷) B.HCl H2S Cl2
C.P NaCl(S) NaOH(S) D.NH3 Ar C2H4
5.下列各分子所有原子都满足最外层为8电子结构的是
A.BaCl2 B.BCl3 C.Li2O D.PCl5
6.据权威刊物报道,1966年科学家在宇宙中发现H3分子。H3和H2是
A.的同位素 B.氢的同素异形体
C.同系物 D.同分异构体
7.某金属的最高价氧物分子量为M,最高价氯化物分子量为N。若其最高正价为X,则X与M、N的关系为
A.![]() B.
B.![]()
C.![]() D.
D.![]()
8.碘是原子半径较大的卤族元素,可能呈现金属性,下述事实能说明这个性质的是
A.已经制得IBr,ICl等卤素之化物
B.I2能与NaOH溶液反应
C.已经制得约I2O5等碘的氧化物
D.已经制得I(NO3)3等含I3+的离子化合物
9.纳米材料研究已成为“材料科学”的新热点。这是用特殊方法把固体物质加工到纳米级(1nm—100nm,1nm=10-9m)的超细粉末粒子后制得的。下列分散系中的分散质微粒直径和这种粒子具有相同数量级的是
A.溶液 B.悬浊液 C.乳浊液 D.胶体
10.某物质溶于水,所得溶液既能使蓝色石蕊试纸变红,也能与碳酸盐反应生成气体,此物质有可能是:①氧化物 ②盐 ③碱 ④单质 ⑤酸
A.①②④ B.①②④⑤ C.② D.①②③④⑤
11.下列物质的摩尔质量有一定范围而没有固定值的是
A.冰水混合 B.干冰 C.洁净的汽油 D.聚氯乙烯
12.下列叙述正确的是
A、发生化学反应时失去电子越多的金属原子,还原能力越强
B、金属阳离子被还原后,一定得到该元素的单质
C、核外电子总数相同的原子,一定是同种元素的原子
D、能与酸反应的氧化物,一定是碱性氧化物
13. 下列过程中,不涉及化学变化的是
A.用明矾净化水
B.甘油加水作护肤剂
C.烹调鱼时加少量料酒和食醋,可减少腥味,增加香味
D.烧菜使用过的铁锅,经放置常出现红棕色斑迹
14.下列关于物质的分类正确的组合是
|
组 合 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
| A | 纯碱 | 盐酸 | 烧碱 | 氧化铝 | 二氧化氮 |
| B | 烧碱 | 硫酸 | 食盐 | 氧化镁 | 一氧化碳 |
| C | 苛性钠 | 醋酸 | 硝酸 | 过氧化钠 | 二氧化硫 |
| D | 苛性钾 | 油酸 | 苏打 | 氧化钠 | 硫酐 |
15.我国拥有世界上最大的稀土矿,品味甚高,以RE表示稀土元素,可以向RE的硫酸盐溶液中加入粉末状的Na2SO4,使稀土元素转入沉淀,反应为RE2(SO4)3 + Na2SO4 + x H2O→RE2(SO4)3·Na2SO4·x H2O↓(x == 1.2)下列有关叙述正确的是
A.该反应为复分解反应 B.该反应一定在强碱溶液中进行
C.产生的沉淀物属于复盐 D.产生的沉淀物一定是难溶物质
16.锗酸铋(简称BGO)是我国研制成功的一种优良的闪烁晶体材料,其中锗元素处于它的最高价态,铋元素的价态与它跟氯形成某些共价化合物所呈的价态相同,且此氯化物中铋具有8电子稳定结构。BGO的化学式是
A.Bi3Ge3O13 B.Bi4Ge3O12 C.Bi4Ge3O16 D.Bi3Ge3O12
|
│ OH |
17.固体物质A的化学式为NH5,它的所有原子的最外电子层都符合相应的稀有气体原子的电外电子层结构。适当加热该物质,它可分解成两种气体。A物质中的氢元素的化合价为 和 。A是 型化合物,它的电子式是 。将A溶入含紫色石蕊试液的水中,产生的现象是 。
18.硼酸晶体呈片状,有滑腻感,可作润滑剂。硼酸分子结构可表示为 硼酸对人体的受伤组织有和缓的防腐作用,故可用于医药和食品防腐等方面。可见硼酸当属于 。
A.强酸 B.中强酸 C.弱酸
科研表明:在多数情况下,元素的原子在形成分子或离子时,其最外电子层具有达到8个电子稳定结构的趋向。在硼酸分子中,原子最外层电子达到8个电子稳定结构的原子有 个。
已知0.01mol硼酸可被20mL 0.5mol•L-1NaOH溶液恰好完全中和,据此推测:硼酸在水中显酸性的原因是(写方程式) ;
硼酸和甲醇在浓H2SO4存在的条件下,可生成挥发性硼酸酯,试写出硼酸与甲醇完全酯化的化学方程式: 。
19. 从下列括号中选择合适的用语,填写在的横线上,使它跟各种变化的情况相符(分解、潮解、溶解、蒸发、干馏、蒸馏、结晶、化合、挥发、升华、风化):
① 食盐放在水中逐渐消失__________;
② 萘在空气中逐渐消失________;
③ 不盖灯帽的酒精灯,灯内酒精会减少,以致消失________;
④ 无水氯化钙吸收空气中的水分______;
⑤ 生石灰吸收空气中的水分___________;
⑥ 胆矾受热后变成白色粉末___________;
⑦ 石碱晶体在空气中变成白色粉末___________;
⑧ 氢氧化铜加热后变成黑色固体____________;
⑨ 木块隔绝空气加热后变成黑色固体__________;
⑩ 饱和KNO3溶液降温,出现晶体______。
20.A、B、C是在中学化学中常见的三种化合物,它们各由两种元素组成。甲乙是两种单质。这些化合物、单质之间的关系如下图所示
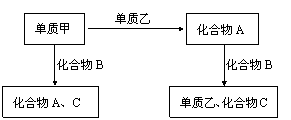
据此判断
⑴在A、B、C这三种化合物中,必含乙元素的是
⑵单质乙必为 (填“金属”或“非金属”),其理由为
⑶单质乙的化学式可能是 ,则化合物B的化学式是 。
21.已知A+B→C+水。t℃,A、B、C三种物质的溶解度分别为S1、S2、S3g。现取t℃时A的饱和溶液Mg,B的饱和溶液Ng,混合后恰好完全反应生成C物质Pg。
(1)求反应中生成水多少g?
(2)通过计算推断:在此反应中,C物质沉淀的条件是什么?
22.著名的“侯氏制碱法”:第一步反应是先向氨化的饱和食盐水中通入CO2而使小苏打析出,该反应可以表示为:NaCl + NH3 +CO2 + H2O == NaHCO3↓ + NH4Cl。在40℃时,向434g饱和食盐水中通入44.8L(标准状况)氨气,在向其中通入稍过量CO2。通过计算求:
(1) 可析出小苏打多少g?
(2) 是否有NH4Cl析出?
(3) 若降温至10℃,可析出NH4Cl多少g?
(溶解度:40℃时,NaCl 37g;NaHCO3 13g;NH4Cl 46g;10℃时,NH4Cl 33g)
23.在化工试剂生产中,要除去某种杂质离子,往往采用一定条件下使之生成MXAy(DE4)Z(OH)12浅黄色复盐晶体析出。化学式中OH为氢氧根,而M、A、D、E代表四种未知元素。已知⑴X+Y+Z=12(x、Y、Z为正整数)。⑵取9.7g该化合物溶于含有稀硝酸的水中,滴加硝酸钡溶液,使D、E元素完全转变为白色沉淀,过滤干燥后称量为9.32g。⑶滤液中A、M以阳离子形式存在,用胶头滴管滴滤液2—3滴在白色点滴板(或玻璃片)上,再滴加1—2滴硫氰化钾溶液,溶液呈血红色。⑷往滤液中通入足量的硫化氢气体,使A离子全部被还原后,产生黄色沉淀物,过滤干燥后,称量为0.96g。⑸化合物中A元素的百分含量为34.64%。
试通过计算推理判断:
⑴ 确定D和E:
D是 ,E是 (写元素符号)。
⑵ 确定x、y、z和A:
x== y== z== A是 。
⑶ M代表的元素是 ;化合物的化学式为 。
【专题一 基本概念】(答案)
![]()
![]()
1.CD 2.C 3.A 4.BD5.A6.B7.AB8.C9.D 10.B 11.CD1 2.B 13.C 14.D 15.C 16.B 17.+1 -1
离子 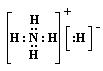 石蕊变蓝,有刺激性气味的气体逸出 18.C 3 B(OH)3 +H2O==[B(OH)4]-+H+ B(OH)3+3CH3OH
B(OCH3)3 + 3H2O 19.①溶解
②升华 ③挥发 ④潮解 ⑤化合 ⑥分解 ⑦风化 ⑧分解 ⑨干馏 ⑩结晶
石蕊变蓝,有刺激性气味的气体逸出 18.C 3 B(OH)3 +H2O==[B(OH)4]-+H+ B(OH)3+3CH3OH
B(OCH3)3 + 3H2O 19.①溶解
②升华 ③挥发 ④潮解 ⑤化合 ⑥分解 ⑦风化 ⑧分解 ⑨干馏 ⑩结晶
20.(1)A、B (2)非金属 因为A+B→乙+C,且乙为单质,可见乙元素在A、B中分别呈正、负价,所以乙为非金属 ⑶ S H2S(或N2 NH3)
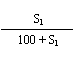 | 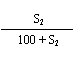 | 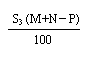 |
21. (1) M + N - P; (2) > P
22.(1) 131.5g (2) 不析出 (3) 14..3g 23.(1) S O (2) 2 6 4 Fe (3) Na Na2Fe6(SO4)4(OH)12
 分 类
分 类