高三化学实验基础题型训练
《实验题型——实验基础》(可能为第21题题型)
1.下列有关化学实验的操作或说法中,正确的是
A.用加热法测定胆矾晶体中结晶水含量时,若在空气中冷却会使结果偏低.
B.配制氯化铁溶液时,先将氯化铁溶于浓盐酸,再用蒸馏水稀释
C.将甲烷和乙烯的混合气体通过盛有浓溴水的洗气瓶,即可提纯甲烷
D.将蔗糖和稀硫酸混合加热后,再加入银氨溶液并水浴加热,以检验还原性单糖
E.中和滴定的原理是酸碱中和后pH=7
F.因为反应过程中用酒精灯加热,所以点燃实验室制取的乙烯气体无须验纯
G.进行中和热测定实验时,需要测出反应前盐酸和NaOH溶液的温度及反应后溶液的最高温度
H. 在某试样中加入盐酸酸化氯化钡溶液有白色沉淀,能推论试样中肯定有S042—。
2.下面所列的是中学化学实验室中几种常见的玻璃仪器:
①温度计 ②容量瓶 ③滴定管 ④烧杯 ⑤圆底烧瓶 ⑥量筒 ⑦玻璃棒
(1)可作反应容器并可加热的是 (填写编号)
(2)需要用到温度计的实验是 (填写编号)
①用乙醇制取乙烯 ②石油分馏 ③浓硫酸稀释 ④测定硝酸钾的溶解度(3)(3)下列有关实验的叙述,正确的是(填序号)
(A)制取硝基苯时,使用的温度计的水银球应浸没于反应混合液中
(B)容量瓶用蒸馏水洗净后,可不经干燥直接用于配溶液;
(C)无法用分液漏斗将甘油和水的混合液体分离
(D)配置1L0.1mol/L的NaCl溶液时可用天平称量5.85gNaCl固体
(E)用滴管滴加液体时,为防止液滴飞溅,滴管紧贴试管内壁
(F)用浓硫酸可干燥SO2气体,但不能用浓硫酸除去SO2气体中混有的SO3气体
(G)少量的白磷贮存在水中,切割时在水下进行
(H)浓硫酸不小心沾到皮肤上,立刻用稀NaOH溶液洗涤
(J)在氢氧化铁胶体中加入少量硫酸会产生沉淀
(K)用结晶法可以除去硝酸钾中混有的少量氯化钠
3.下列有关实验的基本操作及安全知识的叙述,正确的是 (填序号)。
A.附着于试管内壁的苯酚,可用碱液洗涤
B.用结晶法可以除去硝酸钾中混有的少量氯化钠
C.切割白磷时,必须用镊子夹取,置于桌面上的玻璃片上,小心用刀切割
D.实验时,不慎打翻燃着的酒精灯,可立即用湿抹布盖灭火焰
E.浓硫酸不小心沾到皮肤上,立刻用稀烧碱溶液洗涤
F.在氢氧化铁胶体中滴加少量稀硫酸会产生沉淀
 4.下列实验或叙述符合绿色理念的是:
4.下列实验或叙述符合绿色理念的是:
A.实验室用H2O2代替KClO3制取O2
B.用盐酸溶液吸收NH3尾气
C.用NaOH吸收CO2尾气
D.用KClO3代替MnO2在盖有表面皿的点滴板上制取Cl2并做Cl2
与KBr、KI、FeSO4、NaOH等溶液的实验
E.用如图装置利用倒吸原理清洗制取NO2后的实验装置
F.制CuSO4时先将Cu氧化成CuO后再与H2SO4(稀)反应
G.用稀HNO3代替浓HNO3与Cu反应制取Cu(NO3)2
H.实验后的废酸液、废碱液等定点回收
I.除去酸性工业废水中含有的Fe3+、Cd2+、Cr3+、Mn2+等离子时用废碱液或石灰石
J.除去含有Cu2+、Al3+、Fe3+的溶液中的Al3+、Fe3+时,加入CuO而不加入NaOH溶液
K.自来水公司为了降低暂时硬水的硬度[含Mg(HCO3)2、Ca(HCO3)2]时采用加热的方法
L.电镀工业使用无氰技术电镀锌等
M.将炼铁的炉渣用于制水泥
N.用纸质饭盒代替聚氯乙烯饭盒
O.用合成洗涤剂代替肥皂来洗涤衣物
P.用乙醇代替汽油作汽车燃料
Q.工业上用H2O2代替NaClO3作氧化剂氧化Fe2+
5.下列实验操作或对实验事实的描述不正确的是 (填序号)
① 已烷中混有已烯,加入足量的溴水,充分振荡,静置分层后分离
② 配置硫酸铜溶液时应向溶液中加入少量的铜粉
③ 实验室可以用双氧水和二氧化锰制取少量的氧气
④ 向氨水中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加氨水现象相同
⑤ 向某溶液中先通入Cl2再滴加KSCN溶液时溶液变红,证明该溶液一定含有Fe2+
⑥ 将Fe(NO3)2溶液加热蒸发至干并灼烧,最后得到红棕色粉末
⑦ 分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积一样多
⑧在试管中放入几片碎滤纸,滴几滴90%的浓硫酸,再将滤纸捣成糊状,微热并冷却后先滴入几滴CuSO4溶液再加入过量的NaOH溶液加热至沸腾,可观察到红色沉淀生成
6.在实验室进行的下列实验中,有关仪器的下端必须插入液面以下的是
(填编号)。
①分馏石油时用的温度计 ②制备乙烯时用的温度计
③用水吸收溴化氢的导管口 ④用碱液吸收多余氯气的导管口
⑤制备H2的简易装置中加入稀硫酸用的长颈漏斗
⑥制备Fe(OH)2时,向FeSO4溶液中滴入NaOH溶液用的胶头滴管
 ⑵中学化学中许多实验都要用到玻璃棒,但其作用可能不完全相同,玻璃棒通常有下列三种用途:①搅拌;②引流;③蘸取溶液。在“用NaOH溶液、Na2CO3溶液、盐酸、水等试剂除去粗盐中的Mg2+、Ca2+、SO42-等杂质离子以获得较纯净的食盐”的实验中玻璃棒的作用可能有
______ (填写编号)。
⑵中学化学中许多实验都要用到玻璃棒,但其作用可能不完全相同,玻璃棒通常有下列三种用途:①搅拌;②引流;③蘸取溶液。在“用NaOH溶液、Na2CO3溶液、盐酸、水等试剂除去粗盐中的Mg2+、Ca2+、SO42-等杂质离子以获得较纯净的食盐”的实验中玻璃棒的作用可能有
______ (填写编号)。
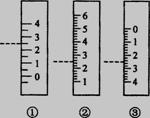
⑶右图是温度计、量筒、滴定管的一部分,下述读数(虚线刻度)及说法正确的是__________。
A.①是量筒,读数为2.5mL
B.②是量筒,读数为2.5mL
C.③是滴定管,读数为2.5mL
D.②是温度计,读数是2.5℃
7.指出下列实验仪器和用品(已洗涤干净)使用时的第一步操作:
①淀粉碘化钾试纸(检验Cl2的性质) ;
②分液漏斗(分液) ;
(2)下列有关实验的叙述中,合理的是 ( 多选倒扣分)
A. 用碱式滴定管量取25.00mL溴水
B. 不宜用瓷坩埚灼烧氢氧化钠或碳酸钠
C. 测定溶液的pH值时,用干燥、洁净的玻璃棒蘸取溶液,滴在用蒸馏水湿润过的pH试纸上,再与标准比色卡比较
D. 圆底烧瓶、锥形瓶、蒸发皿加热时都应垫在石棉网上
E. 使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏大
F. 测定胆矾结晶水含量时,若加热后无水硫酸铜粉末表面发黑,会使测定结果偏高。
8.下列有关化学实验的操作或说法中,正确的是(填字母序号) 。
A.过滤、蒸发操作过程中都需要用玻璃棒不断搅拌液体。
B.检验红砖中的氧化铁成分时,向红砖粉末中加入盐酸,放置至充分沉淀后,取上层清液于试管中,滴加KSCN溶液2滴~3滴即可
C.中和滴定实验中,锥形瓶内有少量蒸馏水会造成测定结果偏低。
D.在进行硫酸铜晶体里结晶水含量的测定实验中,称量操作至少要进行4次。
E.制备硫酸亚铁晶体时,向稀硫酸中加入废铁屑至有少量气泡发生时,过滤,然后加热蒸干滤液即可得硫酸亚铁晶体。
F.向2mLl0%NaOH溶液中滴入2%CuSO4溶液的4—6滴,振荡后加入乙醛溶液0.5
mL,加热至沸腾,则有红色沉淀出现。
9.下列实验操作能达到的预期效果的是______________。
A.用pH试纸测定某液体是否为酸。
B.实验室制取乙烯时必须将温度计的水银球插入反应液中,以控制反应液的温度。
C.分离苯和苯酚的混合液,先加入适量浓溴水,再过滤、分液,即可实现。
D.向2 mL 2%硝酸银溶液中滴加稀氨水至产生的沉淀恰好溶解即得银氨溶液。
E.向20 mL沸水中滴加数滴饱和FeCl3的溶液,加热片刻,可制得Fe(OH)3胶体。
F.将10滴溴乙烷加入1 mL10%的烧碱溶液中加热片刻后,再滴加2滴2%的硝酸银溶液,以检验水解生成的溴离子。
10.下列实验操作正确的是___________。
A.为了加快过滤速率,可用玻璃棒搅拌过滤器中液体
B.苯酚沾在手上,马上用酒精洗涤
C.皮肤上沾有浓H2SO4,立刻用大量水冲洗
D.从试剂瓶中取出的任何药品,若有剩余不能再放回原试剂瓶
E.在中和滴定的实验过程中,目光应注视滴定管中的液面
F.用25 mL碱式滴定管量出14.80 mL的Na2CO3溶液
G.用托盘天平称量出25.20 g NaCl晶体
H.酒精灯在桌上失火,立即用湿布盖上熄灭
I.用加热蒸发FeCl3溶液的方法制取无水FeCl3
J.用蒸馏的方法分离苯和溴苯的混合物
11.下列实验操作能达到实验目的的是__________________(填代号)。
A.向沸水中滴入少量浓FeCl3溶液,煮沸至呈红褐色,制取Fe(OH)3胶体
B.向盛有稀HNO3的试管中加入铜片,稍稍加热,观察生成的NO气体
C.将pH试纸湿润后用于鉴别NH3和HCl两种刺激性气体
D.用滴管吸取NaOH溶液滴入久置的FeSO4溶液中,制取Fe(OH)2
E.将充有NO2气体的密闭玻璃球放入热水中,验证温度对化学平衡的影响
12.下列实验操作或对实验事实的叙述中存在错误的是________(填序号)
A、用50 mL酸式滴定管准确量取25.00 mL 酸性KMnO4溶液,放入锥形瓶中待用
B、在测定硫酸铜晶体的结晶水时,将灼烧硫酸铜晶体的坩埚放在空气中冷却,然后称量
C、中和热的测定所需的玻璃仪器有烧杯、温度计、量筒
D、实验室中进行的下列实验需水浴加热:①苯的硝化反应 ②葡萄糖的银镜反应 ③乙酸乙酯的制备
E、配制1 mol•L-1的NaOH溶液时,下列操作会造成所配浓度偏低:①溶解后烧杯未多次洗涤 ②定容时仰视刻度线 ③容量瓶中原有少许蒸馏水
F、实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉
13.下列实验操作或对实验事实的叙述正确的是 (填序号)。
①向试管中滴加液体时,为不使液体滴到试管外应将胶头滴管伸入试管中;
 ②一小块金属钠加入水中后迅速熔成小球,不停地在水面游动并发出“吱吱”的响声;
②一小块金属钠加入水中后迅速熔成小球,不停地在水面游动并发出“吱吱”的响声;
③配置100mL1.00mol/L的NaCl溶液时,可用托盘天平称取5.85g NaCl固体;
④向可能含有SO42-、SO32-的溶液中加入过量的盐酸,再加入Ba(NO3)2溶液,可检验SO42-的存在;
⑤蒸发NaCl溶液以得到NaCl固体时,不必将溶液蒸干;
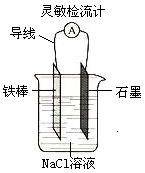
⑥向100℃时的NaOH稀溶液中滴加饱和的FeCl3溶液,以制备
Fe(OH)3胶体;
⑦如右图,可观察到灵敏检流计的指针偏转;
⑧向AlCl3溶液中滴加NaOH溶液和向NaOH溶液中滴加AlCl3溶液的现象相同。
14.下列实验设计或操作合理的是___________________。
A.在容量瓶中注入适量的水,塞上玻璃塞,左手的五指托住瓶底,右手的食指摁住瓶塞,将瓶倒立过来,若观察到瓶塞周围无水漏出,即表明容量瓶不漏水。
B.中和滴定时,左手控制滴定管活塞,右手旋摇锥形瓶,眼睛注视滴定管中液面。
C.在圆底烧瓶中注入20mL酒精与浓硫酸(体积比约为1:3)的混合液,放入几片碎瓷片。加热混合液,使液体的温度迅速升高到170℃以制取乙烯。
D.做蒸馏或分馏实验结束时,应先关闭冷凝水,后停止加热。
E.Fe(OH)3胶体与FeCl3溶液可用过滤的方法分离。
F.向Na2CO3与NaOH的混合溶液中只需加入酚酞试液,即可确认NaOH的存在。
G.在一支洁净的试管里加入1~2mL2%的AgNO3溶液,然后一边摇动试管,一边逐滴加入2%的稀氨水,至最初产生的沉淀恰好溶解。再滴入几滴乙醛,振荡后把试管放在热水浴中加热,片刻后在试管内壁即可形成光亮的银镜。
15.下面a~e是中学化学实验中常见的几种定量仪器:
a.量筒 b.容量瓶 c.滴定管 d.托盘天平 e.温度计
(1)其中标示出仪器使用温度的是 (填写编号,下同)
(2)能够用以精确量取液体体积的是
(3)由于错误操作, 使得到的数据比正确数据偏小的是
A.使用容量瓶配制溶液时, 俯视液面定容后所得溶液的浓度
B.没有用蒸馏水洗烧杯2—3次,并将洗液移入容量瓶中
C.容量瓶刚用蒸馏水洗净,没有烘干
D.定容时,滴加蒸馏水,液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切
16.下列操作会导致实验值较实际值(或要求值)偏低(或偏小)的是__________ (填代号)。
A.测定硫酸铜晶体中结晶水含量时,将加热后的坩埚(内盛药品)置于干燥器中冷却后再称量
B.中和热测定实验中以环形铁丝搅拌棒代替环形玻璃搅拌棒
C.酸碱中和滴定实验中,将待测NaOH溶液装于碱式滴定管,标准HCl溶液盛于锥形瓶(以酚酞作指示剂),进行滴定
D.配制100 mL2 mol/L的NaCl溶液,以胶头滴管加水定容时,液面稍超出容量瓶刻度线,反复摇匀后,凹液面最低点恰好与刻度线平齐
17.(1)对以下课本中的各实验:
A.浓硫酸跟乙醇反应制乙烯 B.葡萄糖的银镜反应
C.乙酸乙酯的制取 D.石油的分馏
E.乙醛还原新制的氢氧化铜 F.中和热的测定
①需水浴加热的是_________________;②需要用温度计的是_________________。
⑵下列对实验操作或实验事实的叙述正确的是_____________________
①用稀HNO3清洗做过银镜反应实验的试管
②配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌
③用碱式滴定管量取20.00mL0.1000mol·L-1的KMnO4溶液
④用托盘天平称取10.50g干燥的NaCl固体
⑤不慎将苯酚浓溶液沾到皮肤上,立即用酒精清洗
⑥向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体
18.⑴下列实验操作或对实验事实的描述不正确的是 (填序号)
① 用热的浓HCl洗涤附着有MnO2的试管;
② 浓硫酸不小心沾在皮肤上,先用抹布擦干净,再用大量的水冲洗;
③ 测定硫酸铜晶体中结晶水含量的实验中,至少需经过4次称量;
④ 将乙烯、乙炔分别通入溴水中,乙烯使溴水的褪色速度快;
⑤ 蒸馏石油时,冷凝管中的冷水应上进下出;
⑥ 向蛋白质溶液中加入浓的无机盐(如Na2SO4、CuSO4)溶液,可使蛋白质盐析而分离提纯;
⑦ 在试管中放入几片碎滤纸,滴几滴90%的浓硫酸,再将滤纸捣成糊状,微热并冷却后先滴入几滴CuSO4溶液再加入过量的NaOH溶液加热至沸腾,可观察到红色沉淀生成;
⑧ 配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用滴管吸去多余的部分。
19.(1)对下列仪器回答下列问题:
A、容量瓶 B、蒸馏烧瓶 C、滴定管 D、量筒 E、烧杯 F、蒸发皿G、分液漏斗 ①标有“0”刻度的有 (填序号);
②使用时必须检查是否漏水的有 (填序号);
③对允许加热的仪器,加热时必须垫上石棉网的有 (填序号);
(2)下列有关实验操作说法中,正确的有 。(选错倒扣)
①容量瓶检漏的操作是:在容量瓶中注入适量的水,塞上玻璃瓶塞,左手五指托住瓶底,右手食指顶住瓶塞,反复倒置,观察是否漏水
②除去KCl溶液中的少量MgCl2,加入适量NaOH溶液,过滤
③仅用蒸馏水和pH试纸,可以鉴别pH相等的H2SO4和CH3COOH溶液
④分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
⑤用碱式滴定管量取25.00mL溴水
⑥用瓷坩埚灼烧各种钠的化合物
⑦在进行过滤操作时,为了加快过滤速率,可用玻璃棒不断搅拌过滤器中液体
⑧实验中多取的试剂都不得放回原试剂瓶
.(1) (1)① C ,② A C G ,③ B E (2) ③④
21.(1)以下各种尾气吸收装置中,适合于吸收HCl气体,而且能防止倒吸的有__________

(2)对下列仪器回答下列问题:
A、容量瓶 B、蒸馏烧瓶 C、滴定管 D、量筒 E、烧杯
F、蒸发皿 G、分液漏斗
①标有“0”刻度的有 (填序号);
②使用时必须检查是否漏水的有 (填序号);
③对允许加热的仪器,加热时必须垫上石棉网的有 (填序号);
(3)现用物质的量的浓度为a mol / L的标准盐酸去测定V mL NaOH溶液的物质的量浓度,请填写下列空白:
①酸式滴定管用蒸馏水洗净后,还应该进行的操作是 ;
②下图是酸式滴定管中液面在滴定前后的读数:
 |  |
c(NaOH)= ;
③若在滴定前滴定管尖嘴部分有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的NaOH物质的量浓度会偏 。
BDE
22.下列实验操作或叙述正确的是 (填序号)
①在鸡蛋白溶液中加入浓HNO3,微热后会生成黄色物质;
②配制银氨溶液时,将稀氨水慢慢滴入硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止;
③先将pH试纸用蒸馏水润湿后,再测定溶液的pH;
④在氢氧化铁胶体中加入少量硫酸时,会观察到先产生沉淀并很快又溶解;
⑤用醋和澄清石灰水验证蛋壳中含有碳酸盐;
⑥油脂皂化反应后,反应混合物中加入食盐可将肥皂的主要成分分离出来;
⑦金属钠不慎燃烧,可以用二氧化碳气体灭火;
⑧用米汤检验食用加碘盐不含碘元素。
23.检查装置气密性是化学实验中的重要操作之一。试按要求回答下列问题:
(1)下列仪器或装置在使用前一定要检查气密性的是____(填序号,下同)。
A、容量瓶 B、洗气瓶 C、分液漏斗 D、酸(碱)式滴定管
(2)下列关于不进行气密性检查可能导致后果的叙述中,正确的是____。
A、收集不到气体 B、造成环境污染
 C、观察到的实验现象有误 D、引发爆炸事故
·
C、观察到的实验现象有误 D、引发爆炸事故
·
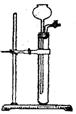
(3)为检查右图所示简易气体发生装置的气密性,甲、乙两位同学进行了以
下操作和方案设计。
①甲同学认为,只要往漏斗中加水,便可检验其气密性是否良好。经检验他
的方案可行。则甲同学的操作方法、现象和结论是 。
②乙同学设计的方案是:往漏斗中注人一定量的水至浸没长颈漏头下端。
关闭活塞,用手捂住试管中上部,待漏斗中液面上升一定高度,打开活塞让液面回落后,迅速关闭活塞,松开手,见漏斗中液面低于试管中液面且不再升降,说明气密性良好。乙同学设计方案的原理是 。

24.下列有关化学实验操作中“先”与“后”的说法正确的是___________(填字母编号)。
A、高锰酸钾加热制备氧气,排水法收集满氧气后,先移出导管,后撤酒精灯
B、给试管加热时,先给试来回均匀加热,后固定局部加热
C、酸碱中和滴定时,先用待测液润洗锥形瓶,后加入一定体积的待测液
D、点燃可燃性气体(如H2、CO、CH4等)时,先检验气体纯度,后点燃
E、在测定溶液的pH时,先用蒸馏水湿润pH试纸,后用玻璃棒蘸取溶液点在试纸中部,再与标准比色卡比较
ABD
25.下列实验操作或对实验事实的叙述正确的是 (填序号)
①用稀HNO3清洗做过银镜反应实验的试管;
②配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌;
③用碱式滴定管量取20.00mL 0.1000mol/L的KMnO4溶液;
④用托盘天平称取10.5g干燥的NaCl固体;
⑤不慎将苯酚溶液沾到皮肤上,立即用酒精清洗;
⑥用瓷坩埚高温熔融![]() 和
和![]() 固体混合物;
固体混合物;
⑦向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备![]() 胶体;
胶体;
⑧配制![]() 饱和溶液时,加入少量的稀硫酸.
饱和溶液时,加入少量的稀硫酸.
①②⑤⑧
26.下列实验操作或对实验事实的叙述正确的是 (填序号)
① 为了提高纯锌与稀硫酸反应的速率,可向稀硫酸中滴入几滴CuSO4溶液
② 向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体;
③使用胶头滴管的任何实验都不允许将滴管插入液面以下
④ 为了获得胆矾晶体,可将CuSO4溶液蒸干、灼烧到质量不再发生变化时为止
⑤ 不慎将苯酚溶液沾到皮肤上,立即用酒精清洗;
⑥ 用石英坩埚高温熔融NaOH和Na2CO3的固体混合物
⑦配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌;
⑧用洁净的玻璃棒蘸取浓HNO3,点在pH试纸中部以测定此浓HNO3的Ph
①⑤⑦
27.⑴下列实验设计或操作合理的是_____________(填字母)。
a.中和热测定实验时,如果没有环形玻璃棒,可用环形铜质搅拌棒代替。
b.实验室制肥皂时,将适量植物油、乙醇和NaOH溶液混合,并不断搅拌、加热,直到混合物变稠,即可得到肥皂。
c.实验室制取乙烯时必须将温度计的水银球插入反应液中,测定反应液的温度。
d.向Na2CO3与NaOH的混合溶液中加入足量的CaCl2溶液,再滴加几滴酚酞试液,可检验NaOH的存在。
e.将10滴溴乙烷加入1mL10%的烧碱溶液中加热片刻后,再滴加2滴2%的硝酸银溶液,以检验水解生成的溴离子。
(2) 根据现有中学化学知识,判断下列有关实验描述正确的是 (填字母)。
A. 红砖中氧化铁成分检验用到的试剂是盐酸和硫氰化钾溶液
B. 用冰醋酸,蒸馏水和容量瓶等仪器配制pH为1的醋酸稀溶液
C. 中和滴定时,酸式滴定管用蒸馏水清洗3次后,即加入标准盐酸溶液进行滴定
D. 实验室用洁净的试管做银镜反应时不能将试管直接放在酒精灯火焰上加热
E.实验窜制备乙酸乙酯时吸收液为饱和碳酸钠溶液而不用饱和碳酸氢钠溶液
⑴c d(3分) (2)ADE
28. 下列有关实验的叙述,不正确的是(填序号)
A、为检验酸性溶液中的Cl-和SO42-,先加硝酸银溶液,滤去沉淀后加硝酸钡溶液
B、用渗析法分离淀粉中混有的NaCl杂质
C、点燃可燃性气体时,都要先检验气体纯度,后点燃。
D、用酸式滴定管量取20.00mL高锰酸钾溶液
E、为了测定某溶液的pH,将未经湿润的pH试纸浸入到待测溶液,过一会取出,与标准比色卡进行对比
F、皮肤上沾有少量浓硫酸,可立即用大量水冲洗
G、足量Cl2通入FeCl2溶液后,将溶液蒸干并灼烧,可得到Fe2O3
H、用瓷坩埚高温熔融Fe(CrO2)2和Na2CO3的固体混合物
J、用结晶法可以除去硝酸钾中混有的少量氯化钠
(2)(6分)指出在使用下列仪器(已经洗涤干净)或用品时的第一步操作:
①石蕊试纸(检验气体): ;
②容量瓶: ;
③滴定管: ;
29. 下列有关实验的叙述中,合理的是
①用pH试纸测得氯水的pH为2
②不宜用瓷坩埚灼烧氢氧化钠或碳酸钠固体
③用托盘天平称量5.85 g NaCl固体配制100 mL 1 mol/LNaCl溶液
④用稀硝酸洗涤做“银镜反应”实验后附着在试管壁上的银
⑤向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,可以制得Fe(OH)3胶体
⑥实验室配制氯化亚锡溶液时,可先将氯化亚锡溶解在盐酸中,再加入蒸馏水稀释,
最后加入少量锡粒
A.①②④ B.②⑧⑥ C.②④⑥ D.②③④⑤⑥
30. (1)下列有关化学实验的操作或说法中,正确的是(填写字母代号)
A、实验室制取肥皂时,将适量植物油、乙醇和NaOH溶液混合,并不断搅拌、加热,直到混合物变稠,即可得到肥皂
B、进行中和热测定实验时,需要测出反应前盐酸与NaOH溶液的各自温度及反应后溶液的最高温度
C、检验红砖中的氧化铁成分时,向红砖粉末中加入盐酸,放置到充分沉淀后,取上层清液于试管中,滴加KSCN溶液2~3滴即可
D、制备硫酸亚铁晶体时,向稀硫酸中加入废铁屑至有少量气泡发生时,过滤,然后加热蒸发滤液即可得到硫酸亚铁晶体
E、进行纤维素水解实验时,把一小团脱脂棉放入试管中,滴入少量90%的浓硫酸搅拌,使脱脂棉变成糊状,再加入一定量的水,加热至溶液呈亮棕色,然后加入新制的Cu (OH)2加热至沸腾即可
(2)下面a~e是中学化学实验中常见的几种定量仪器:
a、量筒 b、容量瓶 c、滴定管 d、托盘天平 e、温度计
①使用容量瓶的第一步操作是___________________________________。
②若用上述仪器配制500mL 2mol·L-1的NaCl溶液,还缺少的玻璃仪器是烧杯_________。
③若用上述仪器测定中和热,则缺少的玻璃仪器为烧杯、__________。
④若用上述仪器进行中和滴定,则缺少的仪器是__________。
(1)(4分)BC(漏选得2分,错选得0分)
(2)①检查容量瓶是否漏水 ②玻棒、胶头滴管
③环形玻璃搅拌棒 ④锥形瓶、滴定管夹
高三题型训练
《实验题型——实验基础》参考答案
1. ABG
2.(1)④⑤ (2)①②④ (3)BCGJK
3. A、B、D、F
4.ADEFHIJLMNPQ
5.1257
6. ⑴ ②④⑤⑥ ⑵①②③ ⑶B
7. (1)①用蒸馏水湿润(2分)②检查是否漏水(2)BEF
8. BDF
9. B、D、E
10. B、F、H、J
11. A、C、E
12. BCDE
13. ②⑤⑦
14.CG
15. (1) a、b、c (2)c (3)BD
16. BD
17. ⑴① B ②ADF ⑵①②⑤
18. ②⑤⑥⑧
19.(1) (1)① C ,② A C G ,③ B E (2) ③④
20. (1)BDE (3分)(2) A C G (2分),(3) CEF
21. ①④⑤⑥
22. 
23. ABD
24. ①②⑤⑧
25. ①⑤⑦
26. ⑴c d(3分) (2)ADE
27.AEFHJ
28. (1)(4分)BC(漏选得2分,错选得0分)
(2)①检查容量瓶是否漏水 ②玻棒、胶头滴管 ③环形玻璃搅拌棒 ④锥形瓶、滴定管夹