高三化学寒假作业【一】
老师寄语:你自满了吗?学习的最大敌人就是自满 !
同学们养成良好学习习惯,每天坚持自觉学习点化学知识!!
可能用到的相对原子质量: H 1,C 12,N 14,O 16,Na 23,Mg:24 AL:27 Cl 35.5,H 39,Fe 56,
一、选择题(本题包括8小题,每小题6分,共48分。每小题只有一个选项符合题意。请将选择题答案填入第2页答题栏)
6.下列描述正确的是( )
①人造刚玉熔点很高,可用作高级耐火材料,主要成分是二氧化硅
②化学家采用玛瑙研钵摩擦固体反应物进行无剂合成,玛瑙的主要成分是硅酸盐
③提前建成的三峡大坝使用了大量水泥,水泥是硅酸盐材料
④夏天到了,游客佩戴添加了溴化银和微量氧化铜的二氧化硅玻璃变色眼镜来保持眼睛
⑤太阳能电池可采用硅材料制作,其应用有利于环保、节能
A.①②③ B.②④ C.③④⑤ D.③⑤
7.一定能在下列溶液中大量共存的离子组是 ( )
A.含有大量Al3+的溶液:Na+、NH4+、SO42-、Cl-
B.c(H+)=1×10-13mol·L-1的溶液:Na+、Ca2+、SO42-、CO32-
C.含有大量Fe3+的溶液: Na+、Mg2+、NO3-、SCN-
D.含有大量NO3-的溶液:H+、Fe2+、SO42-、Cl-
8.R、W、X、Y、Z为原子序数依次递增的同一短周期元素,下列说法一定正确的是(m、n均为正整数)( )
A.若R(OH)n为强碱,则W(OH)n+1也为强碱 B.若HnXOm为强酸,则Y是活泼非金属元素
 C.若Y的最低化合价为-2,则Z的最高正化合价为+6
C.若Y的最低化合价为-2,则Z的最高正化合价为+6
D.若X的最高正化合价为+5,则五种元素都是非金属元素
9.下列条件下,两瓶气体所含原子数一定相等的是 ( )
A.同质量、不同密度的N2和NO B.同温度、同体积的H2和N2
C.同体积、同密度的C2H4和C3H6 D.同压强、同体积的N2O和CO2
10.下列关于晶体的说法一定正确的是( )
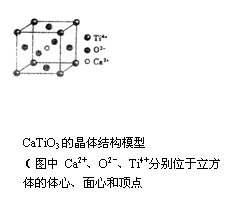
A.分子晶体中都存在共价键 B.CaTiO3晶体中每个Ti4+与12个 O2-相紧邻
C.SiO2晶体中每个硅原子与两个氧原子以其价键相结合
|
11.下列各组溶液中,用括号内的试剂及物质间相互反应不能鉴别的一组是 ( )
A.Ba(OH)2 KSCN NaCl Mg(NO3)2 (FeCl3溶液)
B.NaNO3 NaHCO3 (NH4)2SO3 Na2SiO3 (H2SO4溶液)
C.NH4Br K2CO3 NaI CaCl2 (AgNO3溶液)
D.(NH4)4PO4 NaBr CuSO4 AlCl3(KOH溶液)
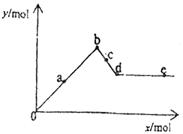
12.已知Ba(AlO2)2可溶于水。右图表示的是向Al2(SO4)3溶液中逐滴加入
Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系。
下列有关叙述正确的是( )
A.a~b时沉淀的物质的量:Al(OH)3比BaSO4多 B.c~d时溶液中离子的物质的量:AlO2-比Ba2+多
C.a~d时沉淀的物质的量:BaSO4可能小于Al(OH)3 D.d~e时溶液中离子的物质的量:Ba2+不可能等于OH-13.常温时,向20L真空容器内通入amol硫化氢和bmol二氧化硫(a和b都是正整数,且a≤5,b≤5)反应完全后,容器内气体可能达到的最大密度约是( )
A.24.5g·L-1 B.14.4g·L-1 C.8g·L-1 D.5.1g·L-1
*×*14. 有M、R两种主族元素,已知M2-离子与R+离子核外电子数之和为20,下列说法不正确的是
A、M与R的质子数之和一定等于19 B、M、R可能分别处于第二周期和第三周期
C、M、R所形成化合物的化学式一定为R2M D、M与R的质子数之差可能为13
老师寄语:态度决定一切,细节决定成败。
二、非选择题(本题包括4小题,共60分)
26.(17分)如下归纳整理是科学学习的重要方法之一。在学习了氧族元素的各种性质后,可归纳整理出表所示的表格(部分)。
| 性质/元素 | 8O | 16S | 34Se | 52Te |
| 单质熔点(℃) | -218.4 | 113 | 450 | |
| 单质沸点(℃) | -183 | 444.6 | 685 | 1390 |
| 主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
| 原子半径 | 逐渐增大 | |||
| 单质与H2反应情况 | 点燃时易化合 | 热化化合 | 加热难化合 | 不能直接化合 |
请根据表回答下列问题:
|
(2)碲的化合价可能有
(3)硫、硒、碲的氢化物水溶液的酸性由强至弱的顺序是 (填化学式)。
(4)氢硒酸有较强的 (填“氧化性”或“还原性”),
因此放在空气中长期保存易变质,其可能发生的化学方程式为 。
(5)H2Te不能直接由H2和Te化合制得,工业上常用Al2 Te3来制
备H2Te,完成下列化学方程式:Al2Te3+( )——Al(OH)3↓+H2Te↑
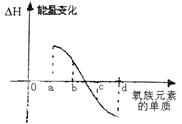
(6)右图所示为氧族元素单质与H2反应过程中的能量变化示意图,
其中a、b、c、d 分别表示氧族中某一元素的单质,△H为相同物质的量的单质与H2反应过程中的能量变化(反应的热效应)。则:b代表 ,d代表 (均写单质化学式)
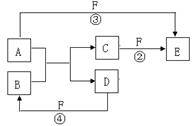
27.(13分)A、B、C、D、E、F六种物质的转化关系如图(未标反应条件),其中①是置换反应:
|
(2)若A是常见金属,D、F是常见的气体单质,反应①②均
在水溶液中进行,则A的化学式为: ; 反
应②的离子方程式: 。
已知1gD与过量F反应生成气体B时放出92.3kJ热量,
该反应的热化学方程式: 。
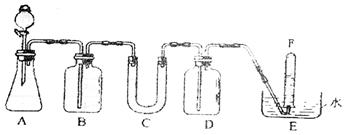
28.(13分)在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。
请选用适当的化学试剂和实验用品,用下图中的实验装置进行实验,证明过氧化钠可作供氧剂。
(1)A是制取CO2的装置。写出A中发生反应的离子方程式: 。
(2)填写表中空格:(请在答题卡上填写)
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | |
| C | ||
| D |
(3)写出过氧化钠与二氧化碳反应的化学方程式: 。
(4)试管F中的收集满气体后,下一步实验操作是(填选项): 。
①关闭分液漏斗活塞 ②把E中的导管移出水面 ③用拇指堵住试管口,取出试管
|
A.①②③④ B.②①④③
C.③④①② D.②①③④
29.(17分)
(1)周期表中前20号元素中有A、B、
C、D、E五种元素。已知它们都不是稀有气
体元素,且原子半径依次减小,其中A和E
同族,A与C、B与E原子的电子层数都相
差2。A、B原子最外层电子数之比为1:4。A和C能以原子个数比1:1形成化合物。
①写出元素符号B D
②B与D形成的化合物是 分子(填极性、非极性)。
③用电子式表示A和D形成化合物的过程 。
|
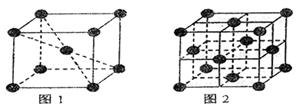
的基本结构单元,在两种晶体中最邻近的铁
原子间距离相同。
① 在1183K以下的纯铁晶体图1中,
与铁原子等距离且最近的铁原子数为 个;
在1183K以上的纯铁晶体图2中,与铁原子
等距离且最近的铁原子数为 个;
图1图2分别含有 、 个铁原子。
②纯铁晶体在晶型转变前后,二者基本结构单元的边长之比为(1183K以下与1183K以上之比)
【考后练习】二、(本题包括2小题,共14分)
1. (4分)下列实验操作能达到预期目的是 (用序号填空)
A、只将无水乙醇与冰醋酸混合制取乙酸乙酯 B、用蒸馏水鉴别甲醇、乙醛、溴苯三种液体
C、用碱式滴定管量取0.2mol/L12.50ml 的KMnO4溶液 D、用分液漏斗分离硝基苯和水
E、苯酚不慎沾在手上,马上用NaOH溶液冲洗 F、用铁粉、浓溴水和苯放入烧瓶中反应制取溴苯
G、制备氢氧化铁胶体时,应往沸水中滴加FeCl3饱和溶液,并继续加热到溶液呈红褐色为止
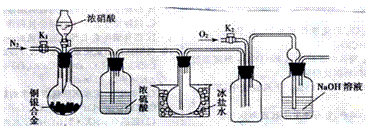 2. (10分)某研究性学习小组验证浓硝酸与铜银合金反应中除生成NO2气体外还会有少量的NO生成。查阅资料得知:常温下NO2与N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在。为此,他们设计了如图所示的验证实验装置(图中略去了不必要的装置)。请回答下列问题:
2. (10分)某研究性学习小组验证浓硝酸与铜银合金反应中除生成NO2气体外还会有少量的NO生成。查阅资料得知:常温下NO2与N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在。为此,他们设计了如图所示的验证实验装置(图中略去了不必要的装置)。请回答下列问题:
A B C D E
(1)写出A瓶中铜与硝酸可能发生反应的化学方程式: ,;
.
(2)实验开始前要先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,这样做的目的是 ;装置中B瓶的作用是 。
(3)A中的反应停止后,打开D中的活塞K2,并通入氧气,若反应确有NO产生,则D中应出现的现象是 ;实验发现,通入氧气温度的高低对实验现象有较大影响,为便于观察应通入 (填“冷”或“热”)的氧气。
(4)已知合金的质量为a,且合金完全溶解。若还想测定铜的质量分数,只需利用A装置中反应后的溶液进行简单的实验操作就可以达到目的。请简述实验过程:
。
三、(本题包括3小题共30分)
3 、(13分)+2价的Fe(Ⅱ)的化合物通常具有较强的还原性,易被氧化:
(1)实验室用亚铁盐溶液与烧碱反应很难制得白色纯净的![]() 沉淀。若用下图电解的方法可制得纯净的
沉淀。若用下图电解的方法可制得纯净的![]() 沉淀,两极材料分别为石墨和铁。
沉淀,两极材料分别为石墨和铁。
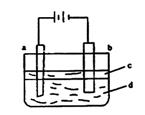
①a电极上发生的电极反应式为 。
②电解液d最好选
(填编号)。A.纯水 B.CaSO4溶液 C.![]() 溶液
D.H2SO4溶液
溶液
D.H2SO4溶液
③液体c为 (填编号)。
A.四氯化碳 B.硝基苯 C.苯 D.乙醇
(2)实验室可用 KMnO4滴定亚铁盐溶液的方法测定其含量:
①滴定前先准确称取W g绿矾样品(杂质不参加反应)配成250mL溶液,将称取的样品配成溶液时,必须选用的玻璃仪器有:烧杯、玻棒、滴管和 。
②滴定时KMnO4应装在 滴定管中(填“酸式”或“碱式”),滴定终点时溶液的颜色变化是 。
③取上述溶液25.00mL放入锥形瓶,用a mol/L 的酸性KMnO4溶液进行滴定,若滴定完全时共消耗KMnO4溶液b mL(MnO4- 被被还原成Mn2+),则FeSO4的纯度表达式为 。
4. (10分)下图所示转化关系中涉及到的物质均由主族元素组成(部分产物已略去)其中C、D为单质,A、B、E、F、G为化合物,除C与D的反应外其它反应均在溶液中进行,请填写下列空白。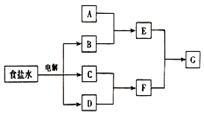
(1)若A是常见金属氧化物,当F过量时,G为可溶性盐,则A的化学式为 ,E与F(过量)反应的离子方程式为: 。
(2)若A是一种常见氧化物,不管F过量与否,G为同一种难溶性物质,则A的名称是 ,E 与F反应的化学方程式为: 。
(3)若A为有机化合物,如果A与G为同一物质,请写出符合题意A的两种(不同类别物质)的结构简式 、 。
四、(本小题8分)
5.向Cu与CuO的混合物中加入混酸(硝酸和硫酸)后加热,使之恰好完全反应,反应中不产生SO2和Cu(NO3)2,硝酸的还原产物只有NO,且得到NO 8.96L(标准状况)。将溶液冷却后刚好全部结晶(无其它任何残留物)得到CuSO4·5H2O 250g。
求①混酸中硝酸和硫酸的物质的量之比 (2分)
②原混合物中Cu和CuO的物质的量之比 (3分)
③混酸中硫酸的质量分数(3分)
高三化学寒假作业【一】
参考答案
化学部分答案
6—13CABCBCBB
26.(17分)(1)113℃~450℃(2分) (2)-2,+4,+6(2分) (3)H2Te >H2Se>H2S(2分)
(4)还原性(2分),2H2Se+O2=2Se↓+2H2O(3分) (5)Al2Te3+6H2O=2Al(OH)3↓+3H2Te↑(2分)
(6)Se,O2(4分,各2分)
|
(1) (2分) 2NH3+3Cl2=N2+6HCl(3分)
(2)Fe(2分),2Fe2++Cl2=2Fe3++2Cl(3分) H2(g)+Cl2(g)=2HCl(g);△H=-184.6KJ/mol(3分)
28.(13分)
(1)CaCO3+2H+=Ca2++CO2↑+H2O(3分) (2)(5分,各1分)
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | 除去CO2中的HCl杂质 |
| C | Na2O2 | CO2与Na2O2反应产生气体 |
| D | NaOH溶液 | 吸收未反应的CO2气体 |
(3)2CO2+2Na2O2=2Na2CO3+O2(3分) (4)D(2分)
29.(17分)(1)①si F (2分,各1分) ②非极性(2分)
![]()
![]() ③K:+:F:→[:F:] (2分) (2)①8,12,2、4(8分,各2分)②
③K:+:F:→[:F:] (2分) (2)①8,12,2、4(8分,各2分)②![]() (3分)
(3分)
【考后练习】二、1、D、G 2、(1) Cu+4HNO3(浓) Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3 3Cu(NO3)2+2NO↑+4H2O
(2) 排尽系统内空气,防止NO氧化成NO2;吸收水蒸气,防止水蒸气在C中冷凝后与NO2反应,产生NO(3)出现红棕色气体; 热
(4)在A中加入过量的含Cl-的溶液,过滤,洗涤,干燥,并称量沉淀质量(得分阶关键词①过量 ②Cl- ③过滤洗涤 ④干燥并称重)
3、 (13分)(1)①Fe-2e=Fe2+ (2分) ②C (2分) ③C (2分)
(2)250mL的容量瓶(1分); 酸式(1分)
溶液变为紫色且半分钟内不再褪色(2分) 7.6ab/W ×100% (3分)
(1)NH4Cl; ①;(2)NH4Cl、 NH3·H2O ; NH4Cl、 HCl;(3)<、 >。
4、(1)Al2O3 AlO2-+4H+ Al3++2H2O (2)二氧化硅; Na2SiO3+2HCl 2NaCl+H2SiO3↓
(或Na2SiO3+2HCl+H2O 2NaCl+H4SiO4↓
![]() (3) , CH3COOH, CH3CH2Cl (任意两种)
(3) , CH3COOH, CH3CH2Cl (任意两种)
5、(1)n(HNO3):n(H2SO4) (8.96/22.4):(250/250)=0.4:1=2:5
(2)n(Cu):n(CuO) 3:2 (3)W(H2SO4) 98/[(98+0.4×63+5×18)-(1.2×18)]×100%=51.1