高三化学二卷典型题训练四
1、乙醛是一种常用的有机试剂,也象葡萄糖一样在碱性和加热条件下,能与银氨溶液反应析出银。如果条件控制适当,析出的银会均匀地分布在试管壁上,形成光亮的银镜,因此这个反应又叫银镜反应。银镜的光亮程度与反应条件有关。同学们在课外活动中对乙醛的银镜反应进行了探究。
 Ⅰ、探究银镜反应的最佳实验条件
Ⅰ、探究银镜反应的最佳实验条件
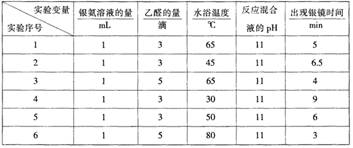
部分实验数据如下表:
请回答下列问题:
(1)读表 若只进行实验1和实验3,其探究目的是 。
(2)推理 当银氨溶液的量为1mL,乙醛的量为3滴,水浴温度为40℃,反应混合液pH为11时,出现银镜的时间是 ;要探索不同水浴温度下乙醛进行银镜反应的最佳条件,除了测量银镜出现的时间外,还需要比较不同条件下形成的银镜的 。
(3)进一步实验 若还要探索银氨溶液的用量对出现银镜快慢的影响,如何进行实验?
。
Ⅱ、探究对废液的回收处理
银氨溶液放久后会变成氮化银而引起爆炸,直接排放会污染环境,且造成银资源的浪费。通过查找资料,已知从银氨溶液中提取银的一种实验流程为:
![]()
操作④的方法是:把Ag2S和铁粉放到烧杯中加浓盐酸搅拌煮沸,使Ag2S变成银粉。反应的化学方程式为:Ag2S+Fe+2HCl2 Ag+ FeCl2+H2S↑
(4)若获得的银粉中含有少量没有反应完的铁粉,除去铁的反应的离子方程式为 ,需要用到的玻璃仪器有 (填编号)。
 (5)操作④应在(填实验室设备名称)
中进行。
(5)操作④应在(填实验室设备名称)
中进行。
(6)要洗去试管壁上的银镜,采用的试剂是
(填名称)。
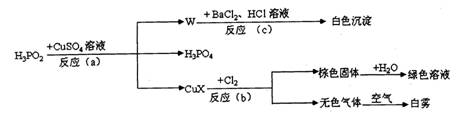 2、次磷酸(H3PO2)是一种强还原性的弱酸,它能发生下列反应:
2、次磷酸(H3PO2)是一种强还原性的弱酸,它能发生下列反应:
CuX的主要性质如下:CuX是一种红棕色、难溶于水的物质;CuX不稳定,温度超过60℃时分解成金属铜和一种气体;在氯气中能燃烧;Cu+在酸性条件下可发生反应2Cu+ = Cu2+ + Cu。根据以上信息,结合所学知识,回答下列问题:
(1)CuX中X是表示一种元素,这种元素是_____________。
(2)反应(a)的化学方程式为_________________________________________。
(3)反应(c)的离子方程式为___________________________________________。
(4)反应(b)中,当有1molCuX被氧化时,转移的电子数目为__________个。
(5)如果把CuX溶解在足量的稀硝酸中产生的气体只有NO,则有关反应的离子方程式为_________________。
![]()
![]() 3、已知:C2H5OH+HO—NO2(硝酸)
C2H5O—NO2(硝酸乙酯)+H2O
3、已知:C2H5OH+HO—NO2(硝酸)
C2H5O—NO2(硝酸乙酯)+H2O
RCH(OH)2 RCHO+H2O
现有只含C、H、O的化合物A~E,其中A为饱和多元醇,其它有关信息已注明在下图的方框内。
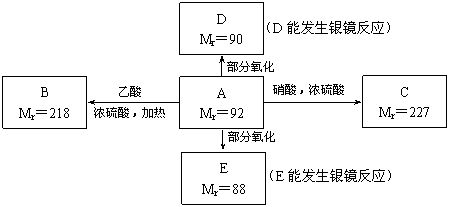 |
回答下列问题:
(1) A的分子式为 。
(2) 写出下列物质的结构简式:B ;D 。
(3) 写出下列反应的化学方程式和反应类型(括号内):
A→C: ,( );
A→E: ,( )。
(4) 工业上可通过油脂的皂化反应得到A,分离皂化反应产物的基本操作是 。
4、钨是我国丰产元素 , 是熔点最高的金属 , 广泛用于拉制灯泡的灯丝 , 有“光明使者”的美誉。钨在自然界主要以钨 (+6价) 酸盐的形式存在。有开采价值的钨矿石是白钨矿和黑钨矿。 白钨矿的主要成分是钨酸钙 (CaW04); 黑钨矿的主要成分是铁和锰的钨酸盐 , 化学式常写成(Fe,Mn)W04。黑钨矿传统冶炼工艺的第一阶段是碱熔法 :
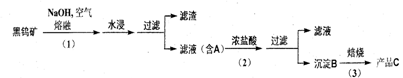 其中 A 、 B 、 C 都是钨的化合物。
其中 A 、 B 、 C 都是钨的化合物。
(1) 写出上述流程中 A 、 B 、 c 的化学式。A________________
B__________ C____________
(2) 钨冶炼工艺的第二二阶段则是用碳、氢等还原剂把氧化钨还原为金属钨。对钨的纯度要求不高时 , 可用碳作还原剂。写出用碳还原氧化钨制取金属钨的化学方程________________________________________为了获得可以拉制灯丝的高纯度金制灯丝的高纯度金属钨,不宜用碳而必须用氢气作还原剂 ,为什么 ?____________________________________________________
(3)仲钨酸的阱盐在热分解时会发生内在氧化还原反应 ,我国钨化学研究的奠基人顾冀东先生采用这一反应制得了监色的、非整比的钨氧化物 WO3-x。 这种监色氧化钨具有比表面大、易还原的优点 , 在制钨粉时温度容易控制 ,目前冶炼拉制钨丝的金属钨都用蓝色氧化钨为原料。经分析 , 得知蓝色氧化钨中钨的质量分数为 0.7985。
①计算 W03-x中的x值。X=__________________
②一般认为,蓝色氧化钨的颜色和非整比暗示了在化合物中存在五价和六价两种价态的钨。则蓝色氧化钨中这两种价态的钨原子数比。___________:___________ ( 相对原子质量 : W: 183.84 0: 16.00)
5、把密度为1.68g / cm3的液态S2Cl2 10 mL 溶于石油醚(一种溶剂),得到100mL溶液,把它慢慢加入50 mL3.2mol/L的SO2 水溶液中,振荡使之充分反应,当加入的S2Cl2 溶液为64.3mL时,恰好反应完全。生成物用含0.32mol KOH的KOH溶液中和后,恰好完全转化为KCl 和一种二元含氧酸的钾盐晶体。试通过计算确定S2Cl2 与SO2 在溶液中反应的化学方程式。
高三化学二卷典型题训练四
答案
1、(1)比较乙醛用量不同时生成银镜的时间(速度或质量均可)
(2)在6.5~9min之间;光亮程度(或亮度、外观、效果等,合理均可给分)
(3)保持其他的实验条件不变,改变银氨溶液的用量,测量生成银镜的时间。(合理的表述均可给分)
(4)Fe+2H+==Fe2++H2↑(其他合理答案也可给分,如Fe+2 Fe3+==3Fe2+);bef
(5)通风橱
(6)硝酸
2、(1)氮 (2)6H2O+3H3PO2+4CuSO4=3H3PO4+CuH+4H2SO4
(3)SO42-+Ba2+= BaSO4↓ (4)1.806*1024 (5)CuH+3H++NO3-=Cu2++NO↑+2H2O
3、(1)Mg(HCO3)2 MgCO3↓+H2O+CO2↑,MgCO3+H2O Mg(OH)2+ CO2
(2)C(1分)碳酸钙的溶解度远远小于硫酸钙的溶解度
(3)CaCO3、MgCO3等 (4)6mol (5)0.01mol/L
3、![]() (1)C3H8O3;
(1)C3H8O3;
![]()
![]()
![]() (2)CH2O—C—CH3 ; CHO
(2)CH2O—C—CH3 ; CHO
![]()
![]()
![]() CHO—C—CH3 CHOH
CHO—C—CH3 CHOH
CH2O—C—CH3 CH2OH
![]()
![]() CH2OH
CH2ONO2
CH2OH
CH2ONO2
![]()
|
CH2OH CH2ONO2
![]()
![]() CH2OH
CHO
CH2OH
CHO
|
|
CH2OH CHO
4、 (1)A: Na2W04; B: H2W04 C: W03 (2)2 W03 (s) +3C (s,石墨 ) ==2W (s) +3C02 (g) 因为钨的熔点很高 , 不容易转变为液态,如果用碳做还原剂 , 混杂在金属中的碳不易除去 , 而且碳会在高温下和金属钨反应形成碳化钨, 不容易获得纯的金属钨。用氢气作还原剂就不存在这些问题。(3) ①X=O. 10 ②n (W) (V): n (W) (VI) 1: 4
5、解:参加反应的S2Cl2 的物质的量n(S2Cl2 )= 1.68g/cm3×10mL×64.3mL/100mL×135g/mol=0.08mol (1分)
参加反应的SO2 的物质的量n(SO2 )=50mL×10-3L/mL×3.2mol/=0.16 mol (1分)
生成HCl 的物质的量n(HCl)= 2 n(S2Cl2 )= 2×0.08mol=0.16mol (2分)
生成二元酸的物质的量n(二元酸)==( 0.32 mol– 0.16mol)/2 = 0.08mol (2分)
故反应中n(S2Cl2 ):n(SO2 ):n(HCl):n(二元酸)= 0.08:0.16:0.16:0.08
= 1:2:2:1 (2分)
所以反应式为:S2Cl2 +2 SO2 +2H2O=2HCl + H2S4O6 (2分)