高三化学二卷题型专项训练五(无机及框图)
1、A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物。回答下列问题:
(1)常温下,X、Y的水溶液的pH均为5。则两种水溶液中由水电离出的H+浓度之比是 。
(2)A、B、D、E四种元素组成的某无机化合物,受热易分解。写出少量该化合物溶液与足量的Ba(OH)2溶液反应的离子方程式 。
(3)将BA4,D2分别通入插在碱溶液中的两个电极形成燃料电池,则通BA4的一极为 极,电极反应式为 。
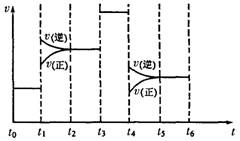 (4)化学反应3A2(g)+C2(g)
(4)化学反应3A2(g)+C2(g)![]() 2CA3(g)。
2CA3(g)。
当反应达到平衡时不断改变条件(不改变A2、C2
和CA3的量),右图表示反应速率与反应过程的关
系,其中表示平衡混合物中CA3的含量最高的一
段时间是 。温度为T℃时,将4a
molA2和2a molC2放人1L密闭容器中,充分反应后测得C2的转化率为50%,则平衡混合气中C2的体积分数为 ,平衡时压强为起始压强的 倍。
(5)化合物A8B2C2D2与烧碱溶液共热,产生使红石蕊试纸变蓝的气体,写出该反应的化学方程式: 。
2、在如图所示的三个容积相同的三个容器①、②、③进行如下的反应![]()
(1)若起始温度相同,分别向三个容器中充入3摩A和1摩B,则达到平衡时各容器中C物质的百分含量由大到小的顺序为(填容器编号)
(2)若维持温度不变,起始时②中投入3摩A、1摩B; ③中投入3摩A、1摩B和2摩C,则达到平衡时,两容器中B的转化率② ③(填<、>或=)
(3)若维持②③容器内温度和压强相等,起始时在②中投入3摩A和1摩B,在③中投入a摩A和b摩B及c摩C,欲使达平衡时两容器内C的百分含量相等,则两容器中起始投料量必须满足(用含a、b、c的关系式表达):
3、通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
| 化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
| 键能/ KJ·mol—1 | 460 | 360 | 436 | 431 | 176 | 347 |
请回答下列问题:
(1)比较下列两组物质的熔点高低Y(填>或<=SiC______ Si; SiCl4 ______ SiO2
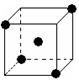
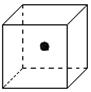 (2)右图立方体中心的“●”表示硅晶体中的一个原子,
(2)右图立方体中心的“●”表示硅晶体中的一个原子,
请在立方体的顶点用“●”表示出与之紧邻的硅原子。
![]() (3)工业上高纯硅可通过下列反应制取:
(3)工业上高纯硅可通过下列反应制取:
SiCl4 (g) + 2H2(g) Si(s) + 4HCl(g)
该反应的反应热△H = ___________ KJ/mol
4、A、B、C、D是中学化学常见的单质,甲、乙、丙为化合物,乙在常温常压下为无色无味的液体,它们之间存在如下图的所示的转化关系。由此推断:
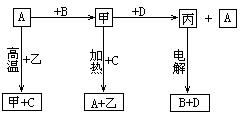
(1)元素A有可变化合价,则A单质的名称______,甲的化学式为_____,乙的电子式为_____。
(2)试判断A和C的还原性强弱(在通常条件下):A_______C(填“大于”、“小于”)。
(3)写出甲和D反应的化学方程式_____________________________。
(4)已知D能与烧碱溶液反应,写出D与烧碱溶液反应的离子方程式
。
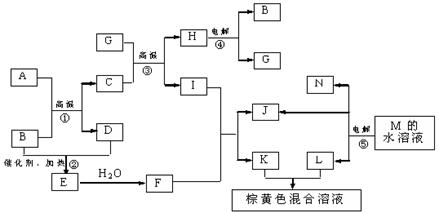
5、材料科学是近年来与化学有关的科学研究热点。某新型无机非金属材料K由两种非金属元素组成。它是一种超硬物质,具有耐磨、耐腐蚀、抗冷热冲击、抗氧化的特征。它是以中学化学中常见物质为原料来生产的。下图虚线框内的其它转化是为探究C的组成而设。G、F、H均为难溶于水的白色固体;图中C、M、K均为含A元素。其余物质均为中学化学中常见物质。(提示:NH3和H2O、NH2—、OH—的化学性质在某些方面相似。)
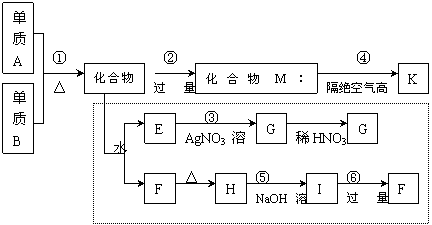
请回答下列问题:
(1)指出K可能所属的晶体类型 。
(2)写出化学式:化合物C ;化合物F 。
(3)写出图中下列序号的离子方程式:
反应③ 。
反应⑤ 。
(4)写出反应④的化学方程式: 。
6、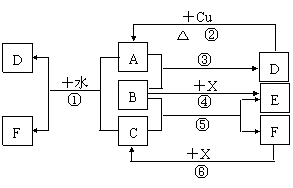 已知A-F是中学化学中常见物质,其中A、C、E、F为气体,B、D为液体,D的消费量常作为一个国家工业发达水平的一种标志,F的浓溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末,B分子中有18个电子。反应中部分生成物已略去。
已知A-F是中学化学中常见物质,其中A、C、E、F为气体,B、D为液体,D的消费量常作为一个国家工业发达水平的一种标志,F的浓溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末,B分子中有18个电子。反应中部分生成物已略去。
试回答下列:
(1)根据图中信息,B、C、D、X氧化性从强到弱的顺序是 ;
(2)B的电子式为 ;
(3)写出反应②的化学方程式 ;
(4)写出反应①、⑥的离子方程式
① ;
⑥ 。
7、下图中,B、D、E、F、G是氧化物,F、K是氢化物,C、H是日常生活中最常见的金属单质,J是气态非金属单质,O是白色沉淀且B、H、L、M、N、O中含有同种元素,I是基础化学工业的重要产品,其消费量是常被视为一个国家工业发达水平的一种标志(图中部分反应物和生成物没有列出)。
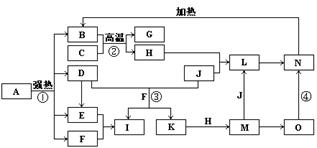
请按要求回答:(1)写出L的化学式 ;
(2)写出:反应③的离子方程式 ;
反应④的化学方程式 ;
(3)反应②在工业生产上的用途是 ;
(4)反应①是分解反应,反应中生成的B、D、E、F的物质的量之比为1∶1∶1∶14,则反应①的化学方程式为 。
|
(1)写出A、B的化学式A________ B_________
(2)写出下列化学反应方程式或离子方程式:
反应③的化学方程式_________________________________________________
反应⑤的离子方程式_________________________________________________
(3)写出反应①所使用设备的名称__________
9、(12分)A~J是中学化学中常见的几种物质,它们之间的转化关系如下图所示。已知常温下A为固体单质,B为淡黄色粉末,C、F、I为气态单质,E在常温下为液体,且E可由C、F化合生成,J可作杀菌消毒剂。
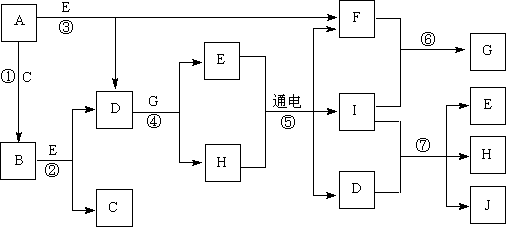
(1)写出反应⑤的化学方程式:_________________________________。
(2)写出反应⑦的离子方程式:_________________________________。
(3)向AlCl3溶液中加入少量固体B,写出反应的化学方程式:____________。
(4)以Pt为电极电解滴加有少量酚酞的H饱和溶液,则阳极的电极反应式为:__________________。________极(填“阴”或“阳”)附近溶液由无色变为红色。
题型专项训练七参考答案
1 、(1)10-4:(1分) (2)Ba2++HCO3-+ OH-==BaCO3↓+H2O(2分)
(3)负(1分),CH4+10OH-—8e-==CO32-+7H2O (2分),
(4)t0~t1(2分) 25%(1分) 2/3(1分)
 2、③②① <
2、③②① <
![]() =3
=3
3、(1)SiC>Si; SiCl4<SiO2 (填>或<=)
(2)立方体中心的“●”表示硅晶体中的一个原子,
请在立方体的顶点用“●”表示出与之紧邻的硅原子。
(3) 该反应的反应热△H = +236KJ/mol。
4、(1)铁(1分)
Fe3O4(1分) ![]() (2分) (2)大于(2分)
(2分) (2)大于(2分)
(3)3Fe3O4+8Al![]() 9Fe+4Al2O3 (3分)
9Fe+4Al2O3 (3分)
(4)2Al+2OH—+2H2O=2AlO2—+2H2O (3分)
5、(1)原子晶体 (2)SiCl4 H4SiO4(或H2SiO3)
(3)Ag++Cl-=== AgCl↓ Si02+2OH-==SiO32-+H2O
(4)3Si(NH2)4=== Si3N4+8NH3
6、(1)X、C、B、D (2) 略
(3)Cu+2H2SO4(浓) =CuSO4+SO2↑+2H2O
(4)①SO2+Cl2+2H2O =4H++2Cl-+SO42-
⑥MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O
7、⑴ FeCl3 ⑵ SO2+Cl2+2H2O=4H++SO42-+2Cl-
4Fe(OH)2+O2+2H2O=4Fe(OH)3
⑶ 焊接钢轨(或冶炼钒、铬、锰等金属)
⑷ 2FeSO4·7H2O![]() Fe2O3+SO2↑+SO3↑+14H2O
Fe2O3+SO2↑+SO3↑+14H2O
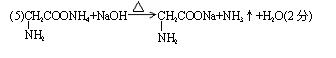
8、(1)A FeS2 B O2
(2)反应③的化学方程式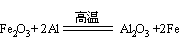
反应⑤的离子方程式2Cl- + 2H2O = 2OH- + Cl2↑ + H2↑ ;
(3)写出反应①所使用设备的名称 沸腾炉 。
|
(2)Cl2+2OH-![]() Cl-+C1O-+H2O
Cl-+C1O-+H2O
(3)4AlCl3+6Na2O2+6H2O![]() 4Al(OH)3↓+12NaCl+3O2↑
4Al(OH)3↓+12NaCl+3O2↑
(4)2C1--2e-![]() Cl2↑ 阴
Cl2↑ 阴