高三化学二卷题型专项训练四(无机流程及框图2)
1.GaAs是一种新型化合物半导体材料,其性能比硅更优越。Ga位于周期表的第IIIA族,As位于周期表的第VA族。
(1)Ga和As的最外层电子数分别是 。
(2)GaAs中Ga和As的化合价分别是 。
(3)第IVA族的C和Si也可以形成类似的化合物半导体材料,该化合物半导体材料的化学式可表示为 。
2.三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有: HF、 NO 和 HNO3 ,请根据要求回答下列问题:
(1)反应过程中,被氧化与被还原的元素的物质的量之比为_______________。
(2)写出该反应的化学方程式,并标出电子转移的方向和数目:
_____________________________________________________________________。
若反应中生成0.2 mol HNO3,转移的电子数目为______________________个。
(3)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现。你判断该气体泄漏时的现象是___________________________________________________。
(4)一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO2、NaF、H2O外。还肯定有______________(填化学式)。
3.(某地有软锰矿(主要成份为MnO2,含少量Al2O3、SiO2)和闪锌矿(主要成份ZnS,含少量FeS、CuS、CdS、SiO2),科研人员采用新工艺生产二氧化锰和锌,同时还得副产品镉和X、Y、Z等。工业流程图如下图(框图中水省略):
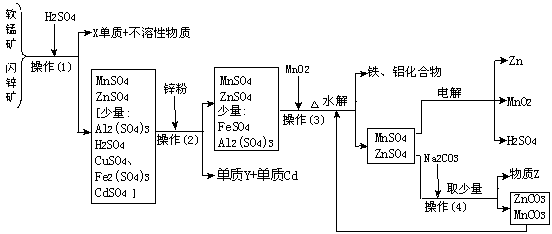
请回答:
(1)副产品X的名称是 ,Y的名称是 、Z的化学式为 。
(2)他们的主要产品中的元素在周期表中,锌属 族,X在 周期。
(3)图中“操作(1)~(4)”都包含的共同一种操作,在实验室中该操作的名称为 。
(4)操作(1)中,在稀H2SO4存在下MnO2把硫化物氧化成硫单质和+2价硫酸盐。如果硫化物用MS表示,请写出MnO2与硫化物反应的化学方程式: 。
(5)操作(3)生成的铁、铝化合物的化学式为 。
(6)请写出电解制得锌和二氧化锰的化学方程式 。
(7)旧工艺生产二氧化锰,是将软锰矿与煤混合粉碎后高温焙烧,再用硫酸浸取焙烧料净化后电解。对比旧工艺,新工艺有好多个优点,请你至少说出新工艺的一个优点:
。
4. 2004年美国火星探测车在火星大气层中检测到了A气体。资料显示,A气体分子是一种三原子分子,其相对分子质量为60.0,在地球环境下A不太稳定,易分解得到一种单质和一种化合物。粉末状的KSCN与浓硫酸在一定条件下可得到气体A和两种硫酸氢盐,生成物的物质的量之比为1∶1∶1
(1)试推测火星大气层的温度,简述你的理由。
(2)试确定A的化学式 。
(3)写出KSCN与浓硫酸反应的化学反应方程式 。
(4)A分解得到一种单质和一种氧化物,写出A分解的化学反应方程式 。
(5)B与SO3反应得到A与一种淡黄色的固体单质。已知B由两种元素组成,A和B分子中原子的最外层电子总数相等,B中两元素的质量比为3∶16。试写出B与SO3反应制备A的化学反应方程式: 。
5.在元素周期表中,锌(30Zn)、镉(48Cd)、汞(80Hg)同属于锌族,锌和汞在自然界中
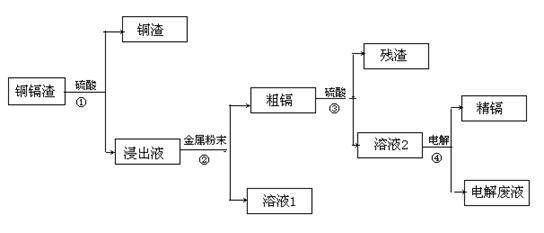 常共生,镉的金属活动性介于锌和汞之间。湿法炼锌过程中产生的铜镉渣中含有Cu、Cd、Zn等多种金属,可用于生产金属镉。镉的主要用途可以用作镍—镉电池,以及用于颜料生产,镉化合物还在PVC稳定剂、发光材料、半导体材料、杀菌剂等方面有广泛的应用。镉的生产流程如图示意如下:
常共生,镉的金属活动性介于锌和汞之间。湿法炼锌过程中产生的铜镉渣中含有Cu、Cd、Zn等多种金属,可用于生产金属镉。镉的主要用途可以用作镍—镉电池,以及用于颜料生产,镉化合物还在PVC稳定剂、发光材料、半导体材料、杀菌剂等方面有广泛的应用。镉的生产流程如图示意如下:
请回答下列问题:
(1)镉元素在周期表中第 周期,第 族。
(2)写出步骤①反应的离子方程 。
(3)步骤②所加入的金属的名称是 。
(4)步骤④用“溶液2”作电解液,镉在 极析出,该电极材料是
(5)“电解废液”中含有镉,不能直接作为污水排放。目前含镉的废水处理的方式有两种,一种是在含镉污水中加入硫化钠,沉淀镉离子,另一种是加入聚合硫酸铁和聚合氯化铝,沉淀镉离子。写出硫化钠沉淀镉离子的离子方程 。
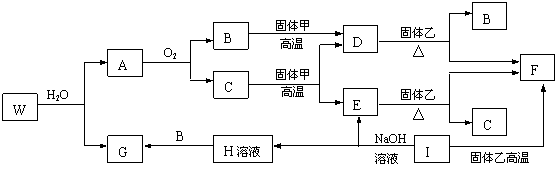 6.已知固体甲、E、I、F均为常见的单质,其中E在常温下为气态。G为白色胶状沉淀,既能溶解于盐酸,又能溶解于氢氧化钠溶液。A在常温下为气态,与氧气完全反应时的体积比是1:2。W是由三种处在不同短周期的元素组成的化合物,与水反应生成A和G时的化学计量数之比为1:3:3:1。各物质有如下图所示的转化关系(部分反应的产物未全部表示)。试回答下列问题:
6.已知固体甲、E、I、F均为常见的单质,其中E在常温下为气态。G为白色胶状沉淀,既能溶解于盐酸,又能溶解于氢氧化钠溶液。A在常温下为气态,与氧气完全反应时的体积比是1:2。W是由三种处在不同短周期的元素组成的化合物,与水反应生成A和G时的化学计量数之比为1:3:3:1。各物质有如下图所示的转化关系(部分反应的产物未全部表示)。试回答下列问题:
(1)B的电子式为 ,固体乙的化学式可能是 ;
(2)上述转化中,①C→E ②D→F ③E→F ④I→F ⑤I→E ⑥A→B 其中属于置换反应的是(填序号) ;
(3)写出W和水反应的化学方程式_____________________________________________,
I和NaOH溶液反应的离子方程式__________________________________________。
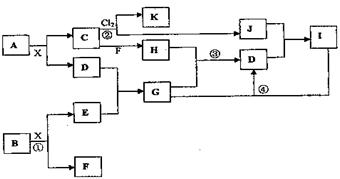 7.已知A、B均是由两种元素组成的化合物,A中某种元素的质量分数为75%,B是一种淡黄色固体,C是一种重要的能源,C和K都是由极性键构成的非极性分子,J和E是工业上用途很广的重要化工原料,X为无色液体。(图中部分反应物或生成物没有列出)
7.已知A、B均是由两种元素组成的化合物,A中某种元素的质量分数为75%,B是一种淡黄色固体,C是一种重要的能源,C和K都是由极性键构成的非极性分子,J和E是工业上用途很广的重要化工原料,X为无色液体。(图中部分反应物或生成物没有列出)
请按要求回答:
(1)写出A的化学式 H的电子式
(2)反应①中每生成l mol F,转移电子的物质的量为
(3)反应②进行的条件为
(4)反应③的化学方程式为
(5)反应④的离子方程式为
8. A通常存在于钢铁中,它是由甲、乙两种化合物组成的混合物,甲和乙的含量、形状、分布对钢性能影响很大,使钢硬而脆,不宜进行机械加工。
已知:(1)甲和乙的组成元素相同,均是由两种常见元素的原子以最简整数比构成的化合物,其相对分子质量分别为124、180。(2)C、D、H、I、J常温下为气体,H、I、J为单质,D是一种红棕色气体。(3)反应②为制备理想的绿色水处理剂Na2FeO4(高铁酸钠)的一种方法。(图中部分生成物没有列出。)
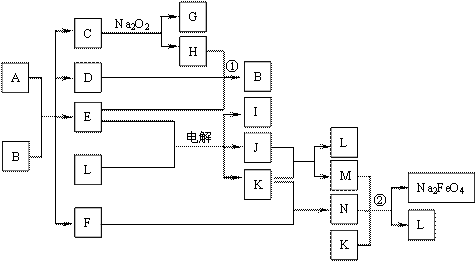
请填写以下空白:
⑴写出C的电子式 。
⑵写出反应①的化学方程式 。反应②的离子方程式 。
⑶甲和乙的化学式分别为 、 ,若A中组成元素的物质的量之比为4∶9,则乙在A中的物质的量分数为 。
9.已知A是一种由短周期元素组成的盐,H是引起温室效应的主要气体之一,Y是一种常见液体,E的相对分子质量比D大16,L、K均为白色沉淀,且K光照后无变化。它们存在如下转化关系(反应条件及部分产物已略去):
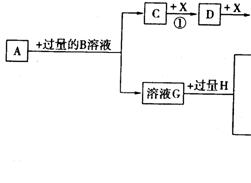
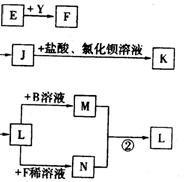
请回答下列问题:
⑴A的化学式是___________,Y的电子式是__________;
⑵反应①的化学方程式是_____________________ _______;
⑶反应②的离子方程式是______________________ ______;
⑷将L加热后得到的固体在熔融条件下电解的化学方程式是___________________。
1.(1)3、5 (各1分);(2)+3,-3(各1分);(3)SiC(2分)。
2.(1)1:2 (1分)
 |
(2)3 NF3 + 5 H2O → 2 NO + HNO3 + 9 HF (3分) ,0.4NA或2.408×1023 (1分)
(3)产生红棕色气体、产生刺激性气味气体、产生白雾(写出1个即得分,3分)
(4)NaNO3 (1分)
3.(1)(3分)硫 铜 Na2SO4 (2)(2分)ⅡB 三
(3)过滤(1分)(4)(2分)MnO2+MS+2H2SO4==MnSO4+ MSO4+S↓+2H2O
(5)(2分)Fe(OH)3、Al(OH)3
|
(7)(1分)新工艺不需要高温焙烧,大大节约了能源(燃料)(或旧工艺高温焙烧产生大气污染物SO2,新工艺不产生有害气体;或新工艺许多物质都可以循环利用)
4.(1)火星表面温度低(1分)。理由:若较高,COS会分解。 (1分)
(2)COS 或SOC 或CSO等(只要元素及原子个数正确即可 ,2分)
(3)KSCN+2H2SO4(浓)+H2O=KHSO4+NH4HSO4+COS↑ (2分)
(4)COS =S +CO (2分)
(5)3CS2+SO3=3COS+4S (2分)
5.(1)5,ⅡB (2)Cd+2H+=Cd2++H2↑,Zn+2H+=Zn2++H2↑
(3)锌 (4)阴、镉板 (5)Cd2++S2-=CdS↓
6.(1)![]() Fe2O3
(2) ①③④
Fe2O3
(2) ①③④
(3) Al(CH3)3 + 3H2O = 3CH4↑+ Al(OH)3↓ 2Al + 2OH- + 2H2O = 2AlO2- + 3H2↑
7. Al4C3(2分)![]() (2分)(2)2mol(2分)
(2分)(2)2mol(2分)
(3)光照,过量的Cl2
(4)NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
或NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3(2分)
(5)Al3+3AlO2-+6H2O=4Al(OH)3↓(1分)
8.⑴![]() (2分) ⑵4NO2+O2+2H2O=4HNO3
(2分)
(2分) ⑵4NO2+O2+2H2O=4HNO3
(2分)
2Fe(OH)3 +3ClO- + 4OH- = 2FeO42- +2Cl-+5H2O(2分)
⑶Fe2C Fe3C (各1分,共2分) 25%(2分)
9.⑴NH4Al(SO4)2,(2分)![]() ;(2分)⑵4NH3+5O2
;(2分)⑵4NH3+5O2![]() 4NO+6H2O;(2分)
4NO+6H2O;(2分)
⑶Al3++3AlO2-+6H2O=4Al(OH)3↓;(2分)
⑷2Al2O3![]() 4Al+3O2↑(2分)
4Al+3O2↑(2分)