高三化学二模模拟试卷
一、选择题
1.由解放军总装备部军事医学研究所研制的小分子团水,解决了医务人员工作时的如厕难题。新型小分子团水,具有饮用量少、渗透力强、生物利用度高、在人体内储留时间长、排放量少的特点。一次饮用125 mL小分子团水,可维持人体6小时正常需水量。下列关于小分子团水的说法正确的是 ( )
A.水分子的化学性质改变 B.水分子间结构、物理性质改变
C.水分子间作用力减小 D.水分子中氧氢键长缩短
2.充分灼烧a g某含C、H、O元素的有机物时,测得生成了b g CO2和c g H2O,则以下判断正确的是( )
A.肯定能确定该物质的最简式 B.肯定不能确定该物质的最简式
C.肯定不能确定该物质的分子式 D.肯定不能确定该物质的结构
3.常温下,测得某氨水溶液的pH 约为12,将其与0.01 mol/L的盐酸等体积混合后,所得溶液中物质的量浓度最大的离子是 ( )
 A.Cl- B.NH4+
C.H+
D.OH-
A.Cl- B.NH4+
C.H+
D.OH-
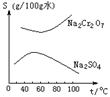
4.根据右图所示的溶解度表,要从混有Na2SO4的Na2Cr2O7晶体中得到Na2Cr2O7,需要进行三个操作。这三个操作不包括 ( )
A.升温结晶 B.趁热过滤
C.降温结晶 D.蒸发结晶
5.不具有放射性的同位素称之为稳定同位素,稳定同位素分析法在近20年来植物生理学、生态学和环境科学研究中获得广泛应用。如在陆地生态系统研究中,2H、13C、15N、18O、34S等常用作环境分析指示物。下列说法正确的是 ( )
A.34S原子核内中子数为16 B.1H216O在相同条件下比1H218O更易蒸发
C.13C和15N原子核内的质子数相差2 D.2H+的酸性比1H+的酸性更强
6.下列叙述中正确的是 ( )
A.同温同压下,相同体积的物质,其物质的量必相等
B.1L CO的质量一定比1 L CO2的质量小
C.等体积、等物质的量浓度的强酸中所含H+的数目属相等
D.任何条件下,等物质的量的NH3和SO3所含原子数必相等
7.铝和镓的性质相似,如M(OH)3都是难溶的两性氢氧化物。在自然界镓常以极少量分散于铝矿,如Al2O3中。用NaOH溶液处理铝矿(Al2O3)时,生成NaAlO2、NaGaO2而后通入适量CO2,得Al(OH)3沉淀,而NaGaO2留在溶液中(循环多次后成为提取镓的原料)。发生后一步反应是因为 ( )
A.镓酸酸性强于铝酸 B.铝酸酸性强于镓酸
C.镓浓度小,所以不沉淀 D.Al(OH)3是难溶物。
8.亚氯酸钠(NaClO2)是一种性能优良的漂白剂,但遇酸性溶液发生分解:5HClO2 → 4ClO2↑ + H+ + Cl-+ 2H2O。向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为硫酸,开始时反应缓慢,稍后一段时间产生气体速度较快,速度变化的原因是 ( )
A.逸出ClO2使生成物浓度降低 B.酸使亚氯酸的氧化性增强
C.溶液中的H+起催化作用 D.溶液中的Cl-起催化作用
二、选择题
9.下列离子方程式正确的是 ( )
A.氢氧化钡溶液中滴加稀硫酸:Ba2++OH-+ H++SO42-→BaSO4↓+H2O
B.饱和碳酸钠溶液通入二氧化碳后溶液浑浊:2Na++CO32-+CO2+H2O → 2NaHCO3↓
C.少量SO2用氨水吸收:2NH3·H2O+SO2 → 2NH4++SO32-+H2O
D.往明矾溶液中加入氢氧化钡溶液至Al3+完全沉淀:Al3++2SO42-+2Ba2++3OH-→Al(OH)3↓+2BaSO4↓
10.某种只含铁和氧两元素的样品A.在高温时与足量的CO充分反应,生成的气体被足量澄清石灰水吸收,得沉淀的质量是原样品A质量的50/29倍,由此得出的结论,其中正确的是 ( )
①A可能不含Fe3O4; ②A一定不含FeO
③A一定是由一种或二种物质组成 ④A可能由一种、二种或三种物质混合物
A.①③ B.①④ C.①② D.②③
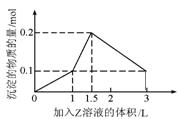 11.某混合溶液中,溶质X、Y的浓度都为0.1mol·L-1,向混合溶液中滴加某溶液Z(0.1mol·L-1氢氧化钠或硫酸溶液)至溶液呈中性,所得沉淀的物质的量如图所示,则X、Y、Z分别是 ( )
11.某混合溶液中,溶质X、Y的浓度都为0.1mol·L-1,向混合溶液中滴加某溶液Z(0.1mol·L-1氢氧化钠或硫酸溶液)至溶液呈中性,所得沉淀的物质的量如图所示,则X、Y、Z分别是 ( )
A.氯化铝、氯化铁、氢氧化钠
B.氯化铝、氯化镁、氢氧化钠
C.偏铝酸钠、氢氧化钡、硫酸
D.偏铝酸钠、氯化钡、硫酸
12.一定条件下,对于可逆反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断不合理的是
( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断不合理的是
( )
A.c1∶c2=1∶3 B.平衡时,Y和Z的生成速率之比为2∶3
C.X、Y的转化率相等 D.c1的取值范围为0.04<c1<0.14 mol·L-1
13.20℃时,饱和KCl溶液的密度为1.174g·cm-3,物质的量浓度为4.0 mol·L-1,则下列说法中不正确的是
( )
A.25℃时,饱和KCl溶液的浓度大于4.0 mol·L-1
B.此溶溶中KCl的质量分数为![]() %
%
C.20℃时,密度小于1.174g·cm-3的KCl溶液是不饱和溶液
D.将此溶液蒸发部分水,再恢复到20℃时,溶液密度大于1.174g·cm-3
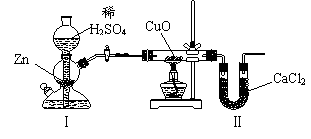 14.用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U型管的质量差,实验测得m(H)∶m(O)>1∶8。下列对导致这一结果的原因的分析中,一定错误的是
( )
14.用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U型管的质量差,实验测得m(H)∶m(O)>1∶8。下列对导致这一结果的原因的分析中,一定错误的是
( )
A.Ⅰ、Ⅱ装置之间缺少干燥装置
B.Ⅲ装置后缺少干燥装置
C.Ⅱ装置中玻璃管内有水冷凝 D.CuO没有全部被还原
15.可逆反应A(g)+ B(s) ![]() 2C(g)+Q(Q>0)进行至t时刻,发现C的百分含量仍在增大,此时要增大正反应的速率,可采取的措施是
( )
2C(g)+Q(Q>0)进行至t时刻,发现C的百分含量仍在增大,此时要增大正反应的速率,可采取的措施是
( )
A.增大B物质的量 B.升温 C.减压 D.使用适宜催化剂
16.以下决定物质性质的因素全面、正确的是 ( )
A.元素的化学性质:元素原子的最外层电子数 B.KNO3的溶解度:温度
C.分子间作用力:相对分子质量 D.气体摩尔体积:温度、压强
三、填空题
17.某一反应体系中存在以下五种物质:Na3AsO3、H2O、I2、Na3AsO4、HI。
(1)用这五种物质组成一个合理的未配平的方程式:________________________________________。
(2)若水是产物,请配平该反应的方程式,并标出电子转移方向与数目:____________________________。
(3)pH为5—9时,体系中的氧化反应为HI→I2;当pH < 4时,反应方向改变,此时体系中的氧化反应为:____________ → ____________。
(4)该反应表明溶液的酸碱性影响物质的______________________(填物质的性质)。
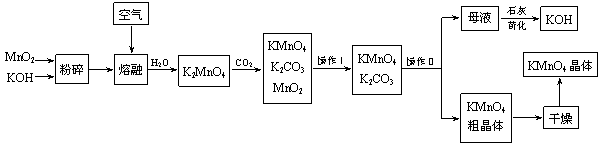 18.高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。
18.高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。
(1)KMnO4稀溶液是一种常用的消毒剂。其消毒机理与下列物质相同的是________(填代号)。
a.84消毒液(NaClO溶液) b.双氧水 c.苯酚 d.75%酒精
(2)高锰酸钾保存在棕色试剂瓶,下列试剂保存不需要棕色试剂瓶的是_______(填代号)。
a.浓硝酸 b.硝酸银 c.氯水 d.烧碱
(3)上述流程中可以循环使用的物质有______________、______________(写化学式)。
(4)若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得__________mol KMnO4。
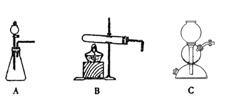 (5)该生产中需要纯净的CO2气体。若实验室要制备纯净的CO2所需试剂最好选择______(选填代号)。
(5)该生产中需要纯净的CO2气体。若实验室要制备纯净的CO2所需试剂最好选择______(选填代号)。
a.石灰石 b.稀HCl
c.稀H2SO4 d.纯碱
所需气体发生装置是___________(选填代号)。
(6)操作Ⅰ的名称是_____________;操作Ⅱ是根据KMnO4和K2CO3两物质在__________(填性质)上差异,采用____________(填操作步骤),趁热过滤得到KMnO4粗晶体的。
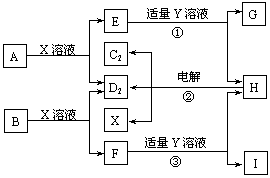 19.位于短周期的原子序数依次增大的D、A、B、C四种元素(其中一种是金属),它们的单质在通常情况下,A、B是固体,C2、D2是常见的双原子气体单质,另有X溶液和Y溶液。这些物质相互转化的关系如下图所示,图中G、I均为白色胶状沉淀,F是含B元素的盐。电解H的水溶液生成C2、D2和X溶液,这是一种重要的化工生产原理。
19.位于短周期的原子序数依次增大的D、A、B、C四种元素(其中一种是金属),它们的单质在通常情况下,A、B是固体,C2、D2是常见的双原子气体单质,另有X溶液和Y溶液。这些物质相互转化的关系如下图所示,图中G、I均为白色胶状沉淀,F是含B元素的盐。电解H的水溶液生成C2、D2和X溶液,这是一种重要的化工生产原理。
(1)X、Y的化学式分别为 、 。
(2)I在固态时属 晶体。
(3)写出反应②的化学方程式: 。
(4)写出反应①、③的离子方程式:反应①: ,
反应③: 。
![]() 20.尼泊金酸的结构简式为:HO— —COOH
20.尼泊金酸的结构简式为:HO— —COOH
(1)尼泊金酸的分子式为____________。
(2)尼泊金酸不具有的性质是_________(选填序号)。
a.可溶于水 b.通常状况下呈固态 c.发生消去反应 d.遇FeCl3溶液显紫色
(3)1 mol尼泊金酸与下列物质反应时,最多可消耗__________(选填序号)。
a.4 mol H2 b.2 mol NaHCO3 c.2 mol Br2 d.2 mol Na2CO3
(4)将尼泊金酸与足量NaOH固体混合后灼烧,生成的有机物结构简式为_________________。
(5)尼泊金酸有多种同分异构体,写出以下含有苯环的同分异构体的结构简式:
|
![]()
![]() 21.烯烃通过臭氧氧化并经锌和水处理得到醛或酮,例如:CH3CH2CH=CCH3
21.烯烃通过臭氧氧化并经锌和水处理得到醛或酮,例如:CH3CH2CH=CCH3![]() CH3CH2CHO + CH3CCH3
CH3CH2CHO + CH3CCH3
CH3 O
一种链状单烯烃A通过臭氧氧化并经锌和水处理得到B和C。化合物B含碳69.8%,含氢11.6%,B无银镜反应。D在浓硫酸存在下加热,可得到能使溴水褪色且只有一种结构的物质E。G的分子式为C7H14O2。有关转化关系如下;
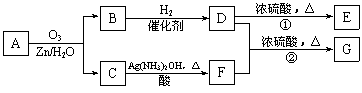 |
(1)B的相对分子质量是__________________。
(2)写出结构简式:A__________________、E_______________________。
(3)写出反应①、②的反应类型:①________________、②_______________。
(4)写出反应②的化学方程式:__________________________________________。
(5)F的一种同分异构体能发生酯化反应和银镜反应,其结构简式为___________________。
四、计算题
22.金属钠和铅以物质的量2∶5组成的合金可以部分溶于液态氨,得深绿色的溶液A,残留的固体是铅,溶液的成分和残留的成分的质量比为9.44∶1。溶液A可以导电,摩尔电导率的测定实验证实,溶液A中除液氨原有的少量离子(NH4+离子和NH2-离子)外,只存在一种阳离子和一种阴离子(不考虑溶剂合离子),而且它们的个数比是4∶1,阳离子只带一个电荷。通电电解时,在阳极上析出铅,在阴极上析出钠。用可溶于液氨并在液氨中电离的盐PbI2配制的PbI2液氨溶液来滴定溶液A,达到滴定终点时,溶液A的绿色褪尽,同时溶液里的铅全部以金属铅的形式析出。回答下列问题:
(1)溶液A中的电解质的化学式为 。
(2)写出上述滴定反应的离子方程式并配平。 。
(3)已知用于滴定的碘化铅的浓度为0.009854mol·L-1,达到终点时消耗碘化铅溶液20.03mL,问共析出金属铅多少克?
高三化学二模冲刺练习八参考答案
一、二、选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| B | A | B | D | B | D | A | D |
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| BC | B | C | BD | D | D | BD | BD |
三、填空题
|
(2)Na3AsO4 + 2HI → Na3AsO3 + H2O + I2
(3)Na3AsO3→Na3AsO4
(4)氧化还原性
18.(1)ab
(2)d
(3)MnO2;KOH
(4)![]()
(5)cd A
(6)过滤 溶解度 浓缩结晶(只填“结晶”不给分)
19.(1)NaOH HCl
(2)分子
(3)2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
![]() (4)AlO2—+H++H2O==Al(OH)3↓ SiO32—+2H+==H2SiO3↓
(4)AlO2—+H++H2O==Al(OH)3↓ SiO32—+2H+==H2SiO3↓
![]() 20.(1)C7H6O3 (2)c (3)c、d (4) —ONa
20.(1)C7H6O3 (2)c (3)c、d (4) —ONa
(5)ⅰ: —C—O— 等 ⅱ:
21.(1)86
![]() (2)A:CH3CH=C—CH2CH3 E:CH3CH=CHCH2CH3
(2)A:CH3CH=C—CH2CH3 E:CH3CH=CHCH2CH3
C2H5
(3)消去反应 酯化反应
(4)![]()
(5)HOCH2CHO
四、计算题
22.(1)Na4Pb9
(2)2Pb2++Pb94-==11Pb
(3)m(Pb)=0.00985mol·L-1×0.02003×10-3L·ml-1×11/2×207.2g·mol-1×10-3mg·g-1=0.2247g