高三化学二模模拟试题
可能用到的相对原子质量: H 1 C 12 N 14 O 16 S 32 Cl 35.5
Fe 56 Cu 64 Co 59
第Ⅰ卷(选择题,共64分)
一、单项选择题(本题包括8小题,每题4分,共32分。每题只是一个选项符合题意)
1.我国科学家为一个比头发丝还细的小分子恢复了磁性,由此创造了一项“世界第一”。实验时将一种名为“钴酞菁”的小分子搬上了“手术台”。这个“个头”仅为1.3纳米的小分子,其结构和性质与人体内的血红素及植物体内的叶绿素非常相似,在光电子器件、生物技术等方面具有广泛而重要的应用与研究价值。下列说法正确的是 ( )
A.“钴酞菁”的小分子具有胶体的性质
B.纳米材料可以应用于所有化工领域
C.现在纳米器件都是无所不能的胶体
D.此工作实现了利用局域的化学反应来改变和控制分子的物理性质
2.右图中a、b、c、d、e、f为元素周期表中前4周期的相邻的一部分元素,下列有关叙述正确的是
A.b、c、e三种元素的单核离子半径大小关系: e>b>c
B.六种元素中,d元素的性质最稳定
C.c的氢化物沸点比f氢化物的沸点低
D.b元素除0价外,只有一种化合价
3.某些盐在溶液中结晶时,析出的晶体是结晶水合物。下表记录了t℃的4份相同的硫酸铜溶液中加入的无水硫酸铜的质量以及析出的硫酸铜晶体(CuSO4·5H2O)的质量(温度维持不变)的实验数据:
| 硫酸铜溶液 | ① | ② | ③ | ④ |
| 加入的无水硫酸铜(g) | 2.50 | 5.00 | 8.00 | 11.0 |
| 析出的硫酸铜晶体(g) | 0.10 | 4.60 | 10.0 | 15.4 |
当加入5.60 g 无水硫酸铜时,析出硫酸铜晶体的质量为
A. 3.88 g B.5.32 C.5.68 g D.6.82 g
4.设NA代表阿佛加德罗常数的数值,下列说法中正确的是
①常温常压下,17g甲基(—14CH3)所含的中子数为9NA
②常温常压22.4L NO气体的分子数小于NA
③64g的铜发生氧化还原反应,一定失去2NA个电子
④常温常压下,100mL 0.5mol/L 的乙酸溶液中,乙酸的分子数目小于0.05NA
⑤标况时,22.4L二氯甲烷所含有的分子数为NA
⑥常温常压下,1mol氦气含有的核外电子数为4NA
A.①② B.③④ C.②④ D.⑤⑥
5.测定相对分子质量的常用方法之一是凝回点下降法。例如水是常用的溶剂 , 当水中溶解了某种不挥发的溶质时 ,水的凝固点 (即冰点) 即会下降 , 海水在 0℃时不会结冰就是这个原因。凝固点下降的程度与溶质的分子数有关 ,而与溶质是何种物质无关 , 这就是溶液的依数性。当溶剂的量确定时 , 凝固点的降低值与溶质分子数成正比。己知 10.0 g 樟脑中溶解 0.412 g萘 , 凝固点下降了13 °C, 即么 , 组成为 C7H602 的有机物 0.23g 溶于 15.6 g 樟脑中 , 凝固点下降约多少 ( 己知萘相对分子质量为 : 128)
A.5 ℃ B.8℃ C.7℃ D.12℃
6. 目前人类已发现的非金属元素除稀有气体外 , 共有 16 种 ,下列对这16种非金属元素的相关判断:
①都是主族元素 , 最外层电子数都大于4 ②单质在反应中都只能作氧化剂
③氧化物常温下都是气态 , 所以又叫都气态氢化物 ④氧化物常温下都可以与水反应生成酸
A 有①②正确 B. 只有①③正确 C. 只有③④正确 D. ①②③④均不正确
7.己知 CuS04 溶液分别与 Na2C03 溶液、 Na2S 溶液的反应情况如下 :
(1) CuS04 十 Na2C03 主要 : Cu2+ + C032- H20 ==CU(OH)2 ↓十 CO2 ↑
次要 : Cu2+ + C032- == CuC03 ↓
(2) CUS04 +Na2S 主要 : Cu2+ +S2- == CuS ↓
次要 : Cu2+ + S2- +2H20==Cu(OH)2↓+ H2S ↑
下列几种物质的溶解度大小的比较中 , 正确的是
A. CuS <Cu(OH)2<CuC03 B. CuS >Cu(OH)2>CuC03
C. Cu(OH)2>CuC03>CuS D. Cu(OH)2<CuC03<CuS
8.相同条件下,下列装置中指定电极的电极反应式相同的是( )
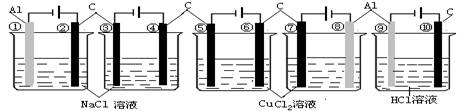
A.②④⑥⑦⑩ B.①③⑤⑧⑨ C.②③④⑤⑥⑦⑩ D.①③⑤⑦⑨
二、不定项选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个该小题就为0分)
9.绿色化学己成为当前化学研究的热点和前沿,旨在从源头上消除污染,实现经济和社会可持续发展。而常温离子液体(ionic liquid)(也有称常温熔融盐)以其优异的理化特性最有可能使上述理想变为现实。1914年报道的第一种离子液体硝酸乙基铵〔(C2H5NH3)NO3〕离子液体其熔点为12℃。已知C2H5NH2结合质子的能力比NH3略强,下列有关硝酸乙基铵的说法正确的是
A.离子液体可以作为电池的电解质
B.硝酸乙基铵水溶液呈碱性
C.硝酸乙基铵水解的离子方程式或表示为:C2H5NH3++H2O=C2H5NH2+H3O+
D.相同温度下,相同物质的量浓度的硝酸乙基铵溶液和硝酸铵溶液前者的pH值小
10.下列各溶液中,微粒的物质的量浓度关系正确的是 ( )
A.10mL 0.5mol/L CH3COONa溶液与6mL 1mol/L盐酸混合:
c(Cl-)>c(Na+)>c(H+)>c(OH-)
B.0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
D.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:
c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl)
11.某密闭密闭容器中进行如下反应:X(g)+2Y(g) ![]() 2Z(g),若要使平衡时反应物总物质的量与生成物的物质的量相等,且用X、Y作反应物,则X、Y的初始物质的量之比的范围应满足
( )
2Z(g),若要使平衡时反应物总物质的量与生成物的物质的量相等,且用X、Y作反应物,则X、Y的初始物质的量之比的范围应满足
( )
A.1<![]() <3
B.
<3
B.![]() <
<![]() <
<![]() C.3<
C.3<![]() <4 D.
<4 D.![]() <
<![]() <
<![]()
12.时钟反应或振荡反应提供了迷人课堂演示实验,也是一个活跃的研究领域。测定含 I浓度很小的碘化物溶液时,利用振荡反应进行化学放大,以求出原溶液中碘离子的浓度. 主要步骤如是 :
①在中性溶液中,用溴将试样中l-氧化成lO3- ,将过量的溴除去。
②再加入过量的Kl,在酸性条件下,使lO3-完全转化成l2。
③将②中生成的古典完全萃取后,用肼将其还原成l- ,方程式为:N2H4+2l2= 4l-+N2+ 4H+ ④将生成的l-萃取到水层后用①法处理。
⑤将④得到的溶液加入适量的 KI溶液 ,并用硫酸酸化。
⑥将⑤反应后的溶液以淀粉作指示剂 ,用Na2S203 标准溶液滴定 , 方程式为 :
2Na2S203+l2=Na2S406+2NaI
经过上述放大后,则溶液中I-浓度放大为原溶液中l-浓度的(设放大前后溶液体积相等)
 A.2 倍 B.4 倍 C.6
倍 D.36 倍
A.2 倍 B.4 倍 C.6
倍 D.36 倍
13.下图是一种形状酷似一条小狗的有机物,化学家Tim Rickard将其取名为
“doggycene”,有关doggycene的说法正确的是
A.该分子中所有碳原子可能处于同一平面
B.doggycene的分子式为:C26H30
C.1mol该物质在氧气中完全燃烧生成CO2和水的
物质的量之比为2:1
D.该物质常温为气态.
14.下列反应的离子方程式错误的是
A.等物质的量的Ba(OH)2与NH4HSO4在稀溶液中反应:
Ba2++2OH—+2H++SO42—=BaSO4↓+2H2O
B.氢氧化铁与足量的氢溴酸溶液反应:Fe(OH)3+3H+=Fe3++3H2O
C.足量的CO2通入饱和碳酸钠溶液中:CO2+2Na++CO32—+H2O=2NaHCO3↓
D.向碳酸氢钠溶液中滴入过量澄清石灰水:
Ca2++2OH—+2HCO3—=CaCO3↓+CO32—+2H2O
15.氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为
a HClO3 = bO2↑+ c Cl2↑+ d HClO4 + e H2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色。下列说法正确的是
A.由反应可确定:氧化性HClO4>HClO3
B.变蓝的淀粉碘化钾试纸褪色是因为可能发生了:
5C12 + I2 + 6H2O = 12H+ + 10Cl- + 2IO3-
C.若氯酸分解所得混合气体,lmol混合气体质量为52.5g,则反应方程式可表示
26HClO3 = 15O2↑+ 8C12↑+ 10HClO4 + 8H2O
D.若化学计量数a=8,b=3,则该反应转移电子数为20e—
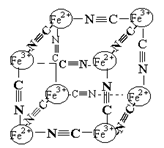 16.分析化学中常用X射线研究晶体结构.有一种蓝色晶体{可表示为:MxFey(CN)Z
},研究表明它的结构特性是:Fe2+和Fe3+分别占据立方体的点, 自身互不相邻,而CN-位于立方体的棱上.其晶体中的部分离子的空间结构关系如图示,下列说法正确的是
16.分析化学中常用X射线研究晶体结构.有一种蓝色晶体{可表示为:MxFey(CN)Z
},研究表明它的结构特性是:Fe2+和Fe3+分别占据立方体的点, 自身互不相邻,而CN-位于立方体的棱上.其晶体中的部分离子的空间结构关系如图示,下列说法正确的是
A.该晶体属于原子晶体
B.该晶体化学式MFe2(CN)6
C.M的离子位于上述立方体的体心,呈+1价
D.该晶体属于离子晶体,M呈+2价
第Ⅱ卷(非选择题,共86分)
三、(本题包括2小题,共20分)
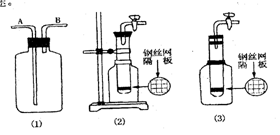 17.(I)使用常用仪器,运用化学原理进行巧妙的设计,就可以用同一个简单的装置实现多种用途。
17.(I)使用常用仪器,运用化学原理进行巧妙的设计,就可以用同一个简单的装置实现多种用途。


(1)利用上图中(1)装置,用两种不同类的方法分别收集NO,试简述操作方法 :
,
(2) 甲同学把试管底部钻出一小洞 ,并和广口瓶组成上图中(2)装置,通过开、关导管上的阀门可以控制试管内的反应随时发生或随时停止。如果该装置中的隔板是用铜丝制成,则该装置可以制取的常见气体有 。( 至少有两种 )
(3) 乙同学认为,可把(2)装置做如上图(3)的改动,用橡皮塞替代铁架台来固定试管。请判断乙同学的做法是否可行 ?
理由是
(II)KMnO4溶液常用做氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液易被空气中或水中某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此精确配制KMnO4标准溶液的操作是:
(1)称取稍多于所需量的KMnO4固体溶于水,将溶液加热并保持微沸l h;
(2)用微孔玻璃漏斗过滤除去难溶的MnO(OH)2;
(3)过滤得到的KMnO4溶液贮存于棕色试剂瓶放在暗处:
(4)利用氧化还原滴定方法,在70℃-80℃条件下用基准试剂(纯度高、稳定性好的物质)溶液测定其浓度。
回答下列问题:
(1)为什么要称取稍多于所需的KMnO4固体?___________________________________
(2)为什么不用普通滤纸过滤器过滤?__________________________________________
(3)如何保证在70℃~80℃条件下进行滴定操作:_______________________________
(4)下列物质中,可以用于测定KMnO4溶液浓度的基准试剂是_____________________
A.H2C2O4·2H2O B.FeSO4·7H2O C.浓盐酸 D.Na2SO3
(5)若准确称取W g草酸晶体(H2C2O4·2H2O)溶于水配成500 mL水溶液,取25.00 mL置于锥形瓶中,用高锰酸钾溶液滴定至终点,消耗高锰酸钾溶液V mL。
6H++2MnO4-+5H2C2O4·2H2O====2Mn2++10CO2↑+18H2O
问:
①滴定时,高锰酸钾溶液应装在________________;
②滴定终点标志是__________________;
③KMnO4溶液的物质的量浓度为__________________:
④若滴定前平视,滴定后俯视,则测得的浓度值将________(填“偏高”或偏低)
18.(12分)饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一。 2005年的《化学教育》
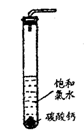 报道了如下实验研究 :
报道了如下实验研究 :
实验一、定性研究 :
①在试管中加入过量的块状碳酸钙 , 再加入约 20mL 饱和氯水 , 充分反应 , 有少量气
泡产生 , 溶液浅黄绿色褪去 :
②过滤 , 将滤液滴在有色布条上 , 发现其比氯水的漂白性更强 :
③为了确定反应产物 , 将滤液分为三份 , 分别进行以下实验 :
第一份与石灰水混合 , 立即产生大量白色沉淀 :
 第二份与稀盐酸混合,立即产生大量无色气体;将第三份加热,看到溶液变浑浊且有大量无色气体产生。经检测,上述实验中产生的无色气体均为C02
请问答 :
第二份与稀盐酸混合,立即产生大量无色气体;将第三份加热,看到溶液变浑浊且有大量无色气体产生。经检测,上述实验中产生的无色气体均为C02
请问答 :
(1) 反应后所得的溶液漂白性增强的原因是
(2) 依据上述实验可推知 , ②的滤液中的溶质除CaCl2、HCIO外,还含有)
实验二、定量研究 :
在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙150mL饱和氯水 ,按如图
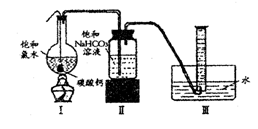 所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到重筒中的气体不再增加。
所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到重筒中的气体不再增加。
请回答 :
(3)为减少用装置III收集气体过程中CO2因溶解而造成的损失 ,且水槽中仍然为水,请你对装置 III 进行改进 ,最简单的方法是
(4) 用改进后的装置进行仁述实验,测得塑料网内的碳酸钙质量减少Ag,总共收集到标准状况下的CO2气体BL,发现![]() 明显小于
明显小于![]() 。若不考虑实验操作和 CO2 的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是
。若不考虑实验操作和 CO2 的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是
(5) 实验后发现 ,装置II中的液体增多了,其原因是
四、(本题包括2小题,共18分)
19. 已知①A,B,C,D四种物质均含元素X,B和D还含有元素Y和Z,C还含有元素Z和W,A还含有元素Y,元素W,Z,Y,X的原子序数依次递增,W和Y在同一个主族。X和Z同在另一个主族。
②X在c中呈现它的最高化学价,在a中呈现它的最低化合价。
③A,B,C三种物质在溶液中以物质的两之比2:1:3反应可得到物质的量之比为1:1:1的甲乙丙三种物质,甲就是X的单质。
④C和D两中物质在溶液中的反应,离子反应所得到的生成物中只有一种是组成仅为Z和W的化合物。
请回答下列问题
(1) 元素X是--------- 元素Z 是————
(2) 写出③中反应的化学方程式————————
(3) 写出④中的反应的离子方程式—————————————
20.下图中A~J分别代表有关反应中的一种物质,它们均为中学化学中的常见物质。已知A~E和F~J中分别含有同一种元素。反应E→A+O2的条件未标出。
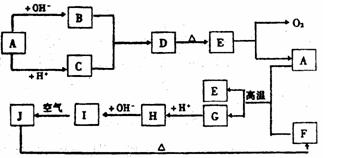
请填写下列空白:
(1)化合物H中的阳离子是 ;D的化学式为 。
(2)A生成B反应的离子方程式是 。
(3)A和F的混合物叫做 ,发生反应的化学方程式是 。
(4)写出B与C生成D的离子方程式 。
(5)I→J反应的化学方程式是 ;该反应过程中发生的现象是 。
五、(本题包括1小题,共10分)
21.(13分) 往有机聚合物中添加阻燃剂,可增加聚合物的使用安全性,扩大其应用范围。例如,在
某聚乙烯树脂中加入等质量由特殊工艺制备的阻燃型Mg(OH)2,树脂可燃性大大降低。该
Mg(OH)2的生产工艺如下:
![]()
.... (1)精制卤水中的MgCl2与适量石灰乳反应合成碱式氯化镁[Mg(OH)2-xClx•mH2O],
反应的化学方程式为 。
.... (2)合成反应后,继续在393K~523K下水热处理8h,发生反应:
[Mg(OH)2-xClx•mH2O]== (1-![]() ) Mg(OH)2 +
) Mg(OH)2 +![]() MgCl2 + mH2O
MgCl2 + mH2O
水热处理后,过滤、水洗。水洗的目的是 。
(3)阻燃型Mg(OH)2具有晶粒大,易分散、与高分子材料相容性好等特点。上述工艺流
程中与此有关的步骤是 。
(4)已知热化学方程式:
Mg(OH)2(s) == MgO(s) + H2O(g) △H1 = +81.5 kJ·mol-1
Al(OH)3(s) ==
![]() Al2O3(s) +
Al2O3(s) + ![]() H2O(g) △H 2 = +87.7 kJ·mol-1
H2O(g) △H 2 = +87.7 kJ·mol-1
①Mg(OH)2和Al(OH)3起阻燃作用的主要原因是 。
②等质量Mg(OH)2和Al(OH)3相比,阻燃效果较好的是 ,
原因是 。
(5)常用阻燃剂主要有三类:A.卤系,如四溴乙烷;B.磷系,如磷酸三苯酯;C.无机类,
主要是Mg(OH)2和Al(OH)3。从环保的角度考虑,应用时较理想的阻燃剂是
(填代号),理由是 。
六、(本题包括2小题,共22分)
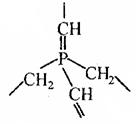 22. (I) 某共价化合物含 C 、 H 、 N三 元素 , 分子内有 4 个 N 原子 , 且 4 个 N 原子排列成内空的四面体 ( 如白磷分子结构 ), 每两个 N 原子间都有一个 C 原子 , 分子内无C-C单 键和 C=C 双键。
22. (I) 某共价化合物含 C 、 H 、 N三 元素 , 分子内有 4 个 N 原子 , 且 4 个 N 原子排列成内空的四面体 ( 如白磷分子结构 ), 每两个 N 原子间都有一个 C 原子 , 分子内无C-C单 键和 C=C 双键。
(1) 试确定该化合物的分子式_______________________
(2) 假若某大分子 , 分子内只含 C 、 H 、 P 二种元素 , 其最小的重复的结构单元如右图当该化合物分子中含n个磷原子时,则该化合物的组成可表示为___________________________。
(II)甘油松香酯是应用最广泛的一种松香酯,俗称酯胶,是由甘油与松香反应而得的。松香的结构简式如图1所示:
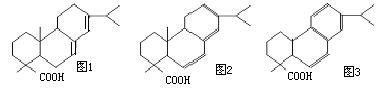
试回答下列问题:
(1)试写出松香的化学式:
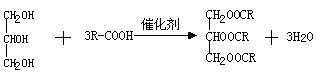
(2)若用R-COOH来表示松香的结构简式,试写出生成甘油三松香酯的反应方程式:
;
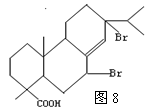
(3)若1mol松香分子与1mol Br2反应,再在NaOH的醇溶液中发生反应后,再酸化可得如图2所示的物质。试写出松香分子与Br2反应生成的产物的结构简式: ;
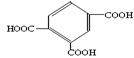
(4)若已知苯环侧链上的第一个碳原子上有氢原子的话,不论侧链有多长,都会被酸性高锰酸钾氧化成羧基,则如图3所示的物质在酸性高锰酸钾溶液中充分反应后的产物中含有苯环结构的物质的结构简式为: 。
23.目前用于抗幽门螺旋杆菌的常见高效抗生素是氨苄青霉素,它可由青霉素来合成。
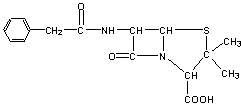
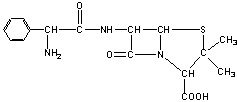
青霉素(C16H18N2O4S) 氨苄青霉素(C16H19N3O4S)
![]()
已知:…-C-NH-…+H2O
![]() …-C-OH+H2N-…
…-C-OH+H2N-…
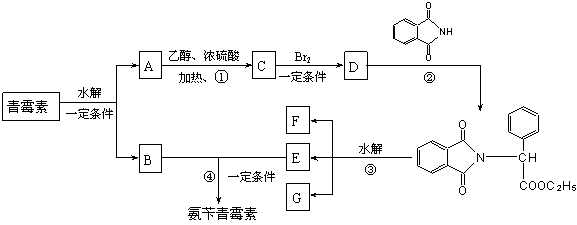 下图是青霉素制取氨苄青霉素的合成路线:
下图是青霉素制取氨苄青霉素的合成路线:
请回答下列问题:
⑴写出反应①②③④的反应类型
① , ② , ③ , ④ 。
⑵写出D的结构简式 。
⑶写出反应①③的化学方程式:
① ,
③ 。
七、(本题包括2小题,共16分)
24.某资料说铁锈的成分为Fe2O3·H2O和FeCO3的混合物。根据此记载,某实验兴趣小组设计下列实验来验证其中是否含有碳酸亚铁。
①取一高度腐蚀的干燥铁钉,称其质量为10.04g,在氮气保护下,充分加热,冷却后称得质量为8.92g。
②将①得到的残渣投入到5.00mol/L的硫酸中,不断添加硫酸直至残渣完全溶解时,恰好用去硫酸31.00mL。整个过程无气体放出。试回答下列问题:
⑴铁锈中是否含有碳酸亚铁?理由是?
⑵锈蚀的铁钉中含Fe2O3·H2O多少克?
⑶锈蚀前铁钉的质量至少多少克?
25.钴(Co)化合物对化学键的研究起着重要的作用。为测定某钴化合物[Co(NH3)x Cly]Clz的组成,进行如下实验:
① 称取样品0.5010g ,加入过量的NaOH溶液,煮沸,蒸出所有的氨,冷却,得到A。产生的氨用50.00mL 0.5000mol·L—1 的盐酸完全吸收并用蒸馏水定容到100mL,得溶液B,取B溶液20.00mL , 用0.1000mol·L—1 NaOH滴定,消耗NaOH溶液30.00mL。
② 向A中加入过量的KI固体,振荡,盐酸酸化后置于暗处,发生反应:
Com+ + I— → Co2+ + I2(未配平)
反应完成后,蒸馏水稀释,用Na2S2O3溶液滴定析出的I2,消耗0.1000mol·L—1Na2S2O3溶液20.00mL 。反应方程式为:I2 + 2Na2S2O3 = 2NaI + Na2S4O6
③ 另称取该物质样品0.2505g,溶于水,以0.1000mol·L—1AgNO3溶液滴定至恰好反应完全,消耗AgNO3溶液20.00mL。相应反应式为:
[Co(NH3)x Cly]Clz + zAgNO3=[Co(NH3)x Cly](NO3)z + zAgCl↓
通过计算求:
⑴[Co(NH3)x Cly]Clz中氮元素的质量分数。
⑵该钴化合物的化学式。
高三化学二模模拟试题答案
17. (I)(1)①广口瓶中盛满水 , NO 从 B 管通入 : ②广口瓶中盛满 CO2 气体 , NO 从 B 管通入
(2)H2 CO2 H2S
(3) 否由于广口瓶被橡皮塞密封后 , 瓶内的气压会随液体的排入而增大 , 使试管中的液
体不能在关闭阀门时排入广口瓶中 , 因而不能使反应随时停止 , 甚至会由于容器中气压过 高而发生危险。
(II)(1)有部分KMO4被还原成MnO(OH)2 (1分)
(2)KMnO4的强氧化性能氧化摅纸 (1分)
(3)可在水浴中加热 (1分) (4)A (1分)
(5)酸式滴定管(2分),当最后滴下1滴KMnO4溶液后半分钟不褪色时(1分) 10w/63V (2分)偏高 (1分)
18. (1) CaC03 消耗了氯水中的 HC1, 使 Cl2+H20===HCI+HCIO 平衡向右移动 , HCIO 浓
度增大
(2) Ca(HC03)2( 写名称正确同样得分 )
(3) 在导管末端再连接长导管 , 使导管的出口接近量筒底部
(4) 碳酸钙与氯水反应生成的 Ca(HC03)2 再受热时 , 除生成 CO2 外 , 还生成了 CaC03
(5) 从圆底烧瓶蒸出的水蒸气在广口瓶中冷凝、聚集
19.X:S ; W:H ;Y:Na.;Z:O
A:Na2S;B:Na2SO3;C:H2SO4;D:Na2S2O3
20.(1)Fe2+ Al(OH)3
(2)2Al+2OH—+2H2O=2AlO—2+3H2 ↑ (2′)
(3)铝热剂 2Al+Fe2O3![]() 2Fe+Al2O3 (3′)
2Fe+Al2O3 (3′)
(4)Ai3++3AlO2—+6H2O=4Al(OH)3↓ (2′)
(5)4FeOH2+O2+2H20=4Fe(OH)3 (2′)
白色沉淀迅速变成灰绿色,最终变成红竭色(2′)
21.(1) 2MgCl2 + (2-x)Ca(OH)2 + 2mH2O == 2[ Mg(OH)2-xClx •mH2O ] + (2-x)CaCl2 (2分)
(2)除去附着在Mg(OH)2表面的可溶性物质MgCl2 、CaCl2 Ca(OH)2 等。 (2分)
(3)水热处理、表面处理。 (1分)
(4)①Mg(OH)2和Al(OH)3受热分解时吸收大量的热,使环境温度下降;同时生成的耐高温、稳定性好的MgO、Al2O3覆盖在可燃物表面,阻燃效果更佳。 (2分)
②Mg(OH)2 (1分) Mg(OH)2的吸热效率为:81.5kJ·mol-1/58g·mol-1 = 1.41 kJ·g-1 ,Al(OH)3的吸热效率为:87.7kJ·mol-1/78g·mol-1 = 1.12 kJ·g-1 等质量的Mg(OH)2比Al(OH)3吸热多。 (2分)
(5) C (1分) 四溴乙烷、磷酸三苯酯沸点低,高温时有烟生成,且高温时分解产生有毒、有害的污染物。无机类阻燃剂Mg(OH)2、Al(OH)3高温时无烟、无毒、腐蚀性小。 (2分)
22、(I)(l) C6H12N4 ;(2) C2nH3nPn 。
(II)根据结构简式图可得出物质的化学式为C20H30O2,酯化反应的方程式为:
 根据图5和图6结构以及1:1与Br2反应可知,松香分子与Br2 发生共轭二烯烃的1,4加成。其结构如图8所示:
根据图5和图6结构以及1:1与Br2反应可知,松香分子与Br2 发生共轭二烯烃的1,4加成。其结构如图8所示:
图7的物质被酸性高锰酸钾氧化后的产物为:
23.⑴①酯化(取代) ②取代 ③水解(取代) ④取代(每格1分)
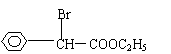 |
⑵ (2分)
⑶① (2分)
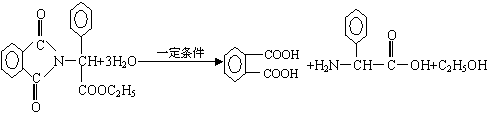 ③(2分)
③(2分)
24.

25、解:⑴NaOH+HCl=NaCl+H2O NH3+HCl=NH4Cl
20.00mLB溶液消耗0.1000mol·L-1NaOH 30.00mL。
20.00mLB溶液中过量的HCl:n(HCl)=0.003000mol ,
100mLB溶液中过量的HCl:n(HCl)=0.01500mol那么与NH3反应的n(HCl)=0.01000mol
故0.5010g样品中 n(NH3)=0.01000mol n(N)=0.01000mol
[Co(NH3)xCly]Clz中氮元素的质量分数
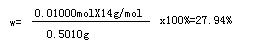
⑵ I2+2Na2S2O3==2NaI+Na2S4O6
因反应用去0.1000mol·L-1Na2S2O3溶液20.00mL,推算出:n(I2)=0.001000mol
Co与Fe同一族,Com+具有强氧化性,故设m=3
则有:2Co3++2I-==2Co2++I2 n(Co3+)=0.002000mol
0.5010g样品中Cl的总质量为:
m(Cl)=0.5010g-0.002000molx59g·mol -1-0.01000molx17g ·mol -1=0.2130g
n(Cl)=0.006000mol
又有:[Co(NH3)xCly]Clz+zAgNO3==[Co(NH3)xCly](NO3)z+zAgCl↓
0.2505g样品扩大一倍来算(即用0.5010g)推算出:
反应消耗AgNO3:n(AgNO3)=0.1000mol·L-1x40.00mL=0.004000mol
即发生上述反应的Cl-为:n(Cl-) =0.004000mol
则有 y:z=(0.006000mol-0.004000 mol): 0.004000mol=1:2
同时还有:1:x:(y+z)= 0.002000: 0.01000: 0.006000=1:5:3
解得:x=5 y=1 z=2
带入[Co(NH3)xCly]Clz中,求得Co化合价为:+3 假设成立
该钴化合物的化学式为:[Co(NH3)5Cl]Cl2
答:⑴[Co(NH3)xCly]Clz中氮元素的质量分数为27.94%
⑵该钴化合物的化学式为:[Co(NH3)5Cl]Cl2
高三化学二模模拟试题答卷
17. (I)(1)①
②
(2)
(3)
(II)(1)
(2)
(3) (4)
(5) ,
18. (1)
(2)
(3)
(4)
(5)
19.(1)X: ; Z:
(2)
(3)
20.(1) ,
(2)
(3)
(4)
(5)
21.(1)
(2)
(3)
(4)①
②
(5)
22、(I)(l) ;(2) 。
(II)(1)
(2)
(3) (4)
23.⑴① ② ③ ④
⑵
⑶①
③
24.
25.