高三化学二模综合练习(四)
一、选择题
1、最新报道,绿色农药——信息素已推广使用,这对环境保护有重要意义。有一种信息素的结构简式为CH3(CH2)5CH=CH(CH2)9CHO。下列关于检验该信息素中官能团的试剂和顺序正确的是
A.先加入酸性高锰酸钾溶液;后加银氨溶液,微热
B.先加入溴水;后加酸性高锰酸钾溶液
C.先加入银氨溶液;再另取该物质加入溴水
D.先加入新制氢氧化铜悬浊液,微热;再加入溴水
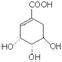
2、下列各溶液中,微粒的物质的量浓度关系正确的是 ( )
A.10mL 0.5mol/L CH3COONa溶液与6mL 1mol/L盐酸混合:
c(Cl-)>c(Na+)>c(H+)>c(OH-)
B.0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
D.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:
c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl)
3、有关于化学实验的操作或者说法中,正确的是
A.用加热法测定胆矾晶体中结晶水含量时,若在空气中冷却会使结果偏低
B.配制氯化铁溶液时,先将氯化铁溶于较浓盐酸,再用蒸馏水稀释并加入少量铁粉
C.将甲烷和乙烯的混合气体通过盛有浓溴水的洗气瓶,即可提纯甲烷
D.将蔗糖和稀硫酸混合加热后,再加入银氨溶液并水浴加热,以检验还原性糖
4、关于下列各装置图的叙述中,不正确的是
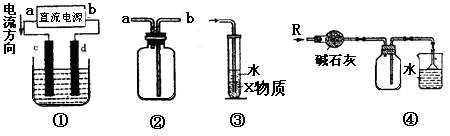
A.装置①中,c为阳极,d为阴极
B.装置②可用于收集H2、NH3、Cl2、HCl、NO2等
C.装置③中X为苯,可用于吸收氨气或氯化氢
 D.装置④可用于干燥、收集氨气,并吸收多余的氨气
D.装置④可用于干燥、收集氨气,并吸收多余的氨气
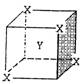
5、某离子晶体晶胞结构如右图所示,X位于立方体的顶点,
Y位于立方体的中心,晶体中距离最近的两个X与一个
Y形成的夹角∠XYX的角度为.
A.90° tx B.60° C.120° D.109°28′
6、将4.9克Mg和Fe的混合物,溶解在过量的稀HNO3溶液中,完全反应得到标况下气体2.24L,则向反应后的溶液中加入足量的烧碱,则生成沉淀的质量是 ( )
A. 6g B. 8g C. 10g D. 12g
7、分别向pH=1的某酸溶液和pH=13的NaOH溶液加入足量的铝片,放出氢气的物质的量之比为3:1,其原因可能是
①两溶液的体积相同,酸是多元弱酸
②两溶液体积相同,酸是弱酸
③酸溶液的体积是NaOH 溶液体积的9倍
④酸是强酸,且酸溶液的浓度比NaOH溶液浓度大
A、只有①和④ B、只有②和④ C、只有①和③ D、只有②和③
8、在一定的条件下,当64g SO2气体被氧化成SO3气体时,共放出热量98.3KJ。已知SO2在此条件下转化率为80%,据此,下列热化学方程式正确的是
A、SO2(g)+1/2O2(g)![]() SO3(g);△H = - 98.3KJ·mol-1
SO3(g);△H = - 98.3KJ·mol-1
B、2SO2(g)+O2(g)![]() SO3(l);△H = - 196.6KJ·mol-1
SO3(l);△H = - 196.6KJ·mol-1
C、SO2(g)+1/2O2(g)![]() SO3(g);△H = - 78.64KJ·mol-1
SO3(g);△H = - 78.64KJ·mol-1
D、2SO2(g)+ O2(g)![]() SO3(g);△H = + 196.6KJ·mol-1
SO3(g);△H = + 196.6KJ·mol-1
9、今有两种正盐的稀溶液,分别是a mol/LNaX溶液和b mol/LNaY溶液,下列说法不正确的是
A.若a=b,pH(NaX) >pH(NaY),则相同浓度时,酸性HX>HY
B.若a=b,并测得c(X-)=c(Y-)+c(HY) ,则相同浓度时,酸性HX>HY
C.若a>b,测得c(X-)=c(Y-),则可推出溶液中c(HX)>c(HY),且相同浓度时,酸性HX<HY
D.若两溶液等体积混合,测得c(X-)+c(Y-)+c(HX)+c(HY)=0.1mol/L,则可推出a=b=0.1 mol/L
10、已知在某温度下,将1 mol SO3(g)充入一定容积的密闭容器中,反应:2SO 3 ![]() 2SO2(g)+O2(g)达到平衡时,混合气体的压强比起始时增大了20%。若起始充入1 mol SO2和1 mol O2,在相同条件下建立平衡,则该情况下SO2转化率为
2SO2(g)+O2(g)达到平衡时,混合气体的压强比起始时增大了20%。若起始充入1 mol SO2和1 mol O2,在相同条件下建立平衡,则该情况下SO2转化率为
A.20% B.20%--60% C.60% D.大于60%
11、据最新报道,清华才女朱令11年前离奇的铊中毒案,再次引起人们关注。铊盐与氰化钾被列为A级危险品。铊(Tl)的原子序数为81,Tl3+与Ag在酸性条件介质中发生反应:Tl3++2Ag=Tl++2Ag+,Ag++Fe2+=Ag+Fe3+.下列推断不正确的是
A.Tl+最外层有2个电子 B.氧化性:Tl3+>Fe3+>Ag+>Fe2+>Al3+
C.还原性:Tl>Fe>Ag D.铊位于第六周期,第IIIA族
12、某密闭密闭容器中进行如下反应:X(g)+2Y(g) ![]() 2Z(g),若要使平衡时反应物总物质的量与生成物的物质的量相等,且用X、Y作反应物,则X、Y的初始物质的量之比的范围应满足
( )
2Z(g),若要使平衡时反应物总物质的量与生成物的物质的量相等,且用X、Y作反应物,则X、Y的初始物质的量之比的范围应满足
( )
A.1<![]() <3
B.
<3
B.![]() <
<![]() <
<![]() C.3<
C.3<![]() <4 D.
<4 D.![]() <
<![]() <
<![]()
13、甲醇是重要的基础化工原料又是一种新型的燃料,制取甲醇传统法是采用CuO~ZnO/γ- Al2O3催化剂,合成反应为:CO+2H2 CH3OH,工艺中一些参数如右
![]()
图;目前正在开发的新法是:2CH4+ O2 2CH3OH 。
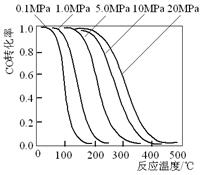 下列关于新法和旧法的说法正确的是
下列关于新法和旧法的说法正确的是
A.旧法生产中,由图知CO与H2合成甲醇的反应属
于放热反应
B.旧法生产中,选择合适催化剂时,可推测高压法
合成比低压法合成更有发展优势。
C.新法与旧法相比,原料丰富并可直接从天然气中
获得
D.新法生产中,需控制V(CH4)/V(O2)=9∶1,目的是
提高空气中氧气的转化率
14、下列叙述正确的是
A.碘在碘化钾溶液中溶解度显著增大,原因是发生氧化还原反应生成I3-
B.氯化铁溶液遇KSCN溶液显红色,原因是生成Fe(SCN)3沉淀
C.氢氟酸需保存在塑料瓶中,原因是氢氟酸具有强酸性而腐蚀玻璃
D.氯化银难溶于水而溶于氨水,原因是生成Ag(NH3)2Cl
15、2005年中国防治禽流感药物研究取得重大突破,从中药材提取的金丝桃素对人工感染的H5N1亚型禽流感家禽活体具有良好的治愈率。已知金丝桃素的结构简式为如下:
![]()
下列有关说法正确的是
A.金丝桃素的分子式为C17H22O3N
B.金丝桃素能在NaOH溶液中加热反应得到两种芳香族化合物
C.金丝桃素能浓硫酸和浓硝酸的混合液反应
D.1mol金丝桃素最多能与4molH2发生加成反应
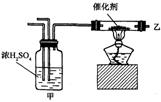 16、实验室合成三氧化硫装置如图所示,则以下说法中错误的是
16、实验室合成三氧化硫装置如图所示,则以下说法中错误的是
A.装置甲的作用是混合气体、干燥等
B.所需的催化剂为铁触媒
C.乙处导出的气体是SO3、SO2、O2
D.虽SO3极易溶于水,但生成的三氧化硫不宜直接通入水中吸收
17、当向蓝色的CuSO4溶液中逐滴加入氨水时,观察到首先生成蓝色沉淀,而后沉淀又逐渐溶解成为深蓝色的溶液,向深蓝色溶液中通入SO2气体,又生成了白色沉淀:将白色沉淀加入稀硫酸中,又生成了红色粉末状固体和SO2气体,同时溶液呈蓝色,根据上述实验现象分析推测,下列描述正确的有 ( )
A.Cu2+和Ag+相似,能与NH3结合生成铜氨络离子
B.白色沉淀为+2价铜的某种亚硫酸盐,溶于H2SO4发生复分解反应
C.白色沉淀为+1价铜的某种亚硫酸盐,在酸性条件下发生了自身氧化还原反应
D.反应过程中消耗的SO2与生成的SO2的物质的量相等
18、用NA表示阿伏加德罗常数,下列说法正确的是(C)
A.32g氧气与足量钠完全燃烧转移的电子数为2NA
B.1 mol甲基(-CH3)所含电子数10 NA
C.在标准状况下,2.24L一氧化氮与氮气混合气所含分子数为0.1NA
D.2L 1mol/L 的盐酸溶液中,所含氯化氢分子个数是2NA
二、非选择题
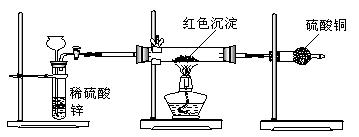
1.氢氧化铜是一种常用试剂。例如,利用新制氢氧化铜验证葡萄糖的还原性。
I.新制氢氧化铜悬浊液的配制 实验室制取新制氢氧化铜悬浊液的操作方法:在试管里加入10%的氢氧化钠溶液2 mL,滴入2%的硫酸铜溶液4滴∽6滴,振荡即成。这样操作的目的是 。
下面是三个研究性学习组分别从不同层面开展研究性学习活动:
II.研究性学习小组甲:对教材实验结论"乙醛与新制氢氧化铜反应生成的红色沉淀是Cu2O"提出质疑,他们认为红色沉淀不一定是氧化亚铜。为了确定红色沉淀的成分,开展了如下研究:
提出猜想: 。
查阅资料:①氧化亚铜属于碱性氧化物;②+1价的铜离子在酸性条件易发生自身氧化还原反应;③在空气中灼烧氧化亚铜生成氧化铜。
设计方案:
方案1:取该红色沉淀溶于足量的稀硝酸中,观察溶液颜色变化
方案2:取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣
方案3:称取红色沉淀ag,在空气中充分灼烧至完全变黑,并在干燥器里冷却,再称重,反复多次至到固体恒重,称得质量为bg,比较a,b关系
方案4:取红色固体沉淀装入试管里,加入酸化的硝酸银溶液,观察是否有银白色银析出
你认为合理的方案是 。
 |
III.研究性学习小组乙针对小组甲的质疑,设计新的探究方案,装置如图所示。你认为要测定上述红色沉淀成分必须测定下列哪些物理量: 。
①通入氢气体积;②反应前,红色沉淀+硬质试管的总质量;③完全反应后红色固体+硬质试管的总质量;④实验前,干燥管质量;⑤硬质试管质量;⑥锌粒质量;⑦稀硫酸中含溶质的量;⑧实验后,干燥管质量
IV.研究性学习小组丙上网查阅新闻得知,"2005年诺贝尔化学奖授予了三位研究绿色化学的科学家"。绿色化学强调对环境友好,实现零排放。"变废为宝"符合绿色化学要求。他们收集上述红色沉淀制备化学试剂--蓝矾。请你帮助他们设计一个简单且符合绿色化学要求的实验方案: 。
[答案] I.确保氢氧化钠过量,氢氧化铜呈悬浊状(2)C
II.红色沉淀可能是铜或铜与氧化亚铜混合物(或红色固体中可能含有铜);方案3
III.②③⑤
IV.在空气中充分灼烧该红色固体至全部转化成氧化铜,加入足量稀硫酸溶解,蒸发、结晶、过滤、洗涤,用滤纸吸干或通入惰气带走水分。
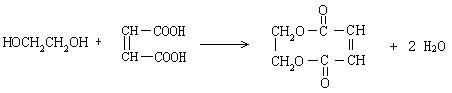
2、全日制普通高级中学教科书(必修加选修)《化学》第三册第六单元第二节性质实验方案设计,“如图1所示,给试管中的乙二酸晶体(H2C2O4·2H2O)加热,将分解产物先通入干燥的、冷的小烧杯中,然后再通入澄清的石灰水中,观察现象”。
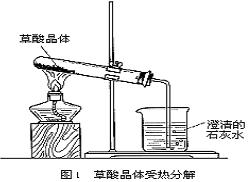
但在方案设施过程中,存在如下弊端:①试管口向下倾斜,乙二酸晶体熔化成液体,顺试管壁流向试管口,导致实验不能成功;②将分解产物通入干燥的、冷的小烧杯中,检验出来的水可能是乙二酸晶体分解出来的结晶水,不能证明乙二酸分解了;③乙二酸受热挥发出蒸气通入澄清的石灰水中,生成的CaC2O4是白色沉淀,对验证CO2有干扰,无法确证已乙二酸分解;④乙二酸加热分解的产物可能为CO2、CO、H2O,其中CO是有毒气体,必须处理掉等。
针对以上情况,某研究性学习小组进行探究,设计出如下实验骓乙二酸的分解并测定其分解率,操作步骤如下:
①把乙二酸晶体放在烘箱中进行烘烤,去掉结晶水,备用。
②按图2连接好装置。
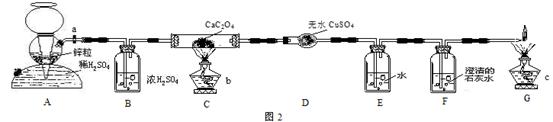
③检查装置的气密性。
④打开活塞a,通入H2一会儿,再关闭a;点然酒精灯b、c。
⑤当C装置中固体消失后,停止加热
⑥打开活塞a,继续通入H2,直至冷却。
试回答下列问题:
⑴装置B的作用___________________;装置E的作用___________________。
⑵检验该套装置的气密性的方法是__________________。
⑶若移取装置A、B,会使所测的乙二酸的分解率_________(填“增大”、“减小”或“不变”)。
⑷可以代替装置G的方法是_____________________________________________。
⑸若称取H2C2O4(烘干)的质量为4.5g,实验结束后,称得D、E、F分别增重0.95g、0.40g、1.98g,则乙二酸的分解率为_______________。
答案:⑴干燥H2(或除去氢气中混有的水蒸气);溶解挥发出的乙二酸蒸气,避免干扰实验。⑵打开启普发生器的活塞a,观察B、E、F瓶中是否有气泡产生,若有气泡产生,说明不漏气,气密性良好。⑶减小。⑷能气囊(或球)收集起来。⑸90%。
3、铍是金属中最好的良导体。因它有极好的吸热、散热性能,故有许多超音速飞机的制动装置是用铍来制造的。当人造地球卫星和宇宙飞船穿上铍的“防热外套”时,能够及时吸收因穿越大气层摩擦而产生的热量并很快的散发出去,从而保障飞船的飞行安全。
铍还是高效率的火箭燃料,铍在燃烧时能释放出巨大的能量:每kg的铍完全燃烧放出的热量为62700kJ。
另外,几乎各种各样的原子反应堆都要用铍做中子反射体。要建设一个大型的原子反应堆,往往需要动用2吨金属铍。
(2)有些物质如B(OH)3(硼酸)、Al(OH)3中心原子是缺电子的,他们的最外层电子数都不满8个电子。在水中也有一定的酸性,但不是本身电离出H+,而是靠夺取水中的OH-使水电离出H+从而使溶液呈现酸性。如:
B(OH)3+H2O= B(OH)4-+H+ ;Al(OH)3+H2O= Al(OH)4-+H+
根据上述信息,请回答下列问题:
①铍的燃烧热是 。
②氧化铍、氢氧化铍性质类似于氧化铝、氢氧化铝,则氧化铍为 氧化物(填“酸性”或“碱性”或“两性”)。
③如果氢氧化铍与碱反应生成的阴离子中铍原子最外层电子数满足8电子结构,试写出氢氧化铍与氢氧化钠溶液反应的化学反应方程式: 。
④写出氧化铍与盐酸反应的离子反应方程式: 。
⑤能有效除去水中铍离子的试剂是: 。
A、氨水 B、碳酸钠溶液 C、稀硫酸 D、氢氧化钠溶液
答案:(1)564.3KJ·mol-1 (2)两性
(3)Be(OH)2+2OH-=Be(OH)42- (4)BeO+2H+=Be2++H2O
(5)B
4、2005年的诺贝尔化学奖颁给了3位在烯烃复分解反应研究方面做出突出贡献的化学家。烯烃复分解反应实际上是在金属烯烃络合物的催化下实现C=C双键两边基团换位的反应。如下图表示了两个丙烯分子进行烯烃换位,生成两个新的烯烃分子——丁烯和乙烯。

现以石油裂解得到的丙烯为原料,经过下列反应可以分别合成重要的化工原料I和G。I和G在不同条件下反应可生成多种化工产品,如环酯J。
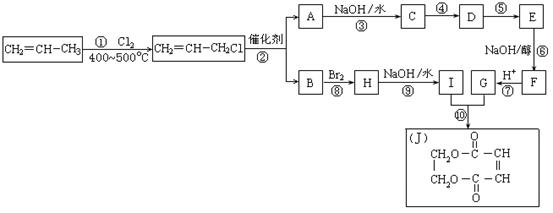
请按要求填空:
(1)写出下列反应的反应类型:
①:______________,⑥:______________,⑧:______________。
(2)反应②的化学方程式是___________________________________________。
(3)反应④、⑤中有一反应是与HCl加成,该反应是________(填反应编号),设计这一
步反应的目的是______________________________________________,物质E的结构
简式是_______________________。
(4)反应⑩的化学方程式是___________________________________________。
答案:
⑴ 取代反应 消去反应 加成反应
⑵![]()
⑶ ④ 保护A分子中C=C不被氧化 
(4)
5、现有含CaO杂质的CaC2试样。某研究性学习小组的同学拟用以下三种方案测定CaC2试样的纯度。请填写下列空白:
(1)第一种方案:请从下图中选用适当的装置,设计一个实验,测定CaC2试样的纯度。
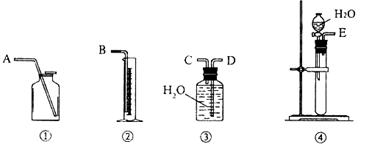
①所选用装置的连接顺序应是(填各接口的字母):_______________________________。
②若实验时称取的试样为1.40g,产生的乙炔在标准状况下的体积为448mL,此试样中CaC2的质量分数为______________。
(2)第二种方案:根据试样和水在锥形瓶中反应前后质量的变化,测定CaC2的质量分数。先称取试样1.60g、锥形瓶和水的质量为195.00g,再将试样加入锥形瓶中,反应过程中每隔相同时间测得的数据如下表:
| 读数次数 | 质量/g | |
| 第1次 | 196.30 | |
| 第2次 | 196.15 | |
| 锥形瓶十水十试样 | 第3次 | 196.05 |
| 第4次 | 196.00 | |
| 第5次 | 196.00 |
计算CaC2的质量分数时,必需用的数据是_____________________。不必作第6次读数的原因是____________________________________________。
(3)第三种方案:称取一定质量的试样(1.60g),操作流程如下:
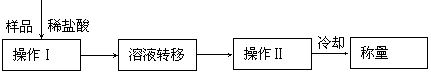 |
①操作Ⅱ的名称是________________________。
②还需直接测定的物理量是_______________________________。
③在转移溶液时,如溶液转移不完全,则CaC2质量分数的测定结果_________(填“偏大”、“偏小”或“不变”)。
答案:(1)①E、C、D、B ②91.4%
(2)试样质量、锥形瓶和水的质量、第4(5)次读数(或用具体数据表示)。 锥形瓶内质量已达恒重
(3)①蒸发 ②CaCl2质量 ③偏小
6、A、B、C、D、E、F六种物质的转化关系如右图所示(反应条件和部分产物未标出)。
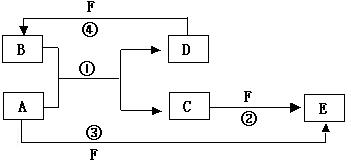
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则A的原子结构示意图为_________,反应④的化学方程式为_____________。
(2)若A是常见的金属单质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是___________________,已知常温下1gD与F反应生成B(气态)时放出92.3 kJ热量,写出该反应的热化学方程式________________。
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为__________________,B固体属于___________________晶体。
答案:(1) C+4HNO
C+4HNO![]() (浓)
(浓)![]() CO
CO![]() ↑+4NO
↑+4NO![]() ↑+2H
↑+2H![]() O
O
(2)2Fe![]() +Cl
+Cl![]() =2Fe
=2Fe![]() +2Cl
+2Cl![]()
H![]() (g)+Cl
(g)+Cl![]() (g)=2HCl(g);ΔH=-184.6kJ·mol
(g)=2HCl(g);ΔH=-184.6kJ·mol![]()
(3)2C+SiO![]()
![]() 2CO↑+Si 原子
2CO↑+Si 原子
7、莽草酸是合成抗禽流感药物“达菲”的重要中间体,其分子式为C7H10O5。莽草酸能使溴的四氯化碳溶液褪色,等质量的莽草酸与足量的金属钠或NaHCO3反应时产生的气体体积不等。以下是以莽草酸为原料的一种合成路线(部分反应条件已省略)。
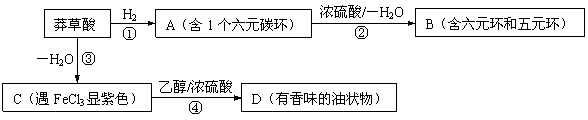
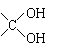 其中A分子中的羧基邻位上没有取代基,C分子中碳环上的氢被取代的一溴代物只有2种。
其中A分子中的羧基邻位上没有取代基,C分子中碳环上的氢被取代的一溴代物只有2种。
![]() 已知有机物分子中含有
或
的结构不能稳定存在。请回答下列问题:
已知有机物分子中含有
或
的结构不能稳定存在。请回答下列问题:
(1) 写出莽草酸分子中含有的官能团名称:羧基、 、 ;
(2) 指出反应类型:① ,③ ;
(3) 写出莽草酸的结构简式: ;
(4) 写出化学反应方程式:
反应② ;
反应④ 。
 |
7.(1)羟基,碳碳双键;(2)①加成,③消去;(3) (4)反应②:略。
 反应④
反应④
8、向100mLBaCl2、AlCl3、 FeCl3 的混合溶液A中逐滴加入Na2SO4和NaOH的混合溶液B,产生沉淀的物质的量n和加入溶液B的体积关系如下图所示:
 |
(1)当加入110mLB溶液时,溶液中的沉淀是 (填化学式)。
(2)溶液B中Na2SO4和NaOH的物质的量浓度之比是 。当B溶液加到90mL~100mL这一段时间中,所发生的离子反应方程式是
。
(3)将A、B溶液中各溶质的物质的量浓度(c)填入下表中。
| 溶质 | Na2SO4 | NaOH | BaCl2 | AlCl3 | FeCl3 |
| c /mol·L—1 |
8、(共10分)⑴BaSO4和Fe(OH)3 (1分)
⑵1∶1(2分) Ba2++SO42-=BaSO4↓(1分) Al(OH)3+OH-=AlO2-+2H2O(1分)
| 1 | 1 | 1 | 0.2 | 0.1 |
⑶
(每空1分,共5分)