高三化学二轮复习之无机推断试题
无机物推断是在化学学科的历次高考改革中始终保留的一种基本题型,因为它以无机物的结构、性质和转化为载体,能够突出考查学生的推理能力和分析综合能力,也能很好地与化学实验、计算、基本化学用语、化学基础理论进行学科内综合考查,对考生有很好的区分度,预计在今年中,它将依然是化学学科的一种重要题型。无机物推断一般以II卷的综合题为主。要很好地解答无机物推断题通常应注意以下几个方面:
解题“五步曲”
⑴审:审清题意,从题干→问题→框图迅速浏览一遍,尽量在框图中把相关信息表示出来,明确求解要求
⑵找:找“题眼”即找到解题的突破口,此步非常关键
⑶析:从题眼出发,联系新信息及所学的旧知识,大胆猜测,顺藤摸瓜,应用正逆向思维、发散收敛思维、横向纵向思维等多种思维方式、进行综合分析、推理,初步得出结论
⑷验:验证确认将结果放入原题检验,完全符合才算正确
⑸答:按题目的要求写出答案
 |
1.根据物质的特殊颜色推断
物质颜色
⑴有色固体:
红色:Cu、Cu2O、Fe2O3
红褐色:Fe(OH)3
黄色:AgI、Ag3PO4
浅黄色:S或Na2O2或AgBr 蓝色:Cu(OH)2 紫黑色:KMnO4、I2
黑色:炭粉、CuO、FeO、FeS、CuS、Ag2S、PbS;
白色:Fe(OH)2、CaCO3、BaSO4、AgCl、BaSO3;
⑵有色溶液:
Fe2+(浅绿色)、Fe3+(黄色)、Cu2+(蓝色)、MnO![]() (紫红色)、Fe(SCN)3(血红色)
(紫红色)、Fe(SCN)3(血红色)
| 水(溶剂) | 苯(溶剂) | CCl4(溶剂) | |
| Br2 | 黄→橙 | 黄→橙红 | |
| I2 | 深黄→褐 | 淡紫→紫红 | 紫→深紫 |
说明:表格中的溶液基本随着溶液浓度的升高而接近单质本身的颜色
⑶有色气体:
Cl2(黄绿色)、Br2(g)(红棕色)、NO2(红棕色)、I2蒸气(紫色)、O3(淡蓝色)
2.根据特征反应现象推断
特征反应现象:
⑴焰色反应:Na+(黄色)、K+(紫色)
⑵使品红溶液褪色的气体:SO2 (加热后又恢复红色)、Cl2(加热后不恢复红色)
⑶白色沉淀Fe(OH)2置于空气中最终转变为红褐色[Fe(OH)3](由白色→灰绿→红褐色)
⑷在空气中变为红棕色:NO
⑸气体燃烧呈苍白色:H2在Cl2中燃烧;在空气中点燃呈蓝色:CO、H2、CH4
⑹使湿润的红色石蕊试纸变蓝:NH3
⑺使湿润的淀粉碘化钾试纸变蓝:Cl2、Br2、FeCl3、碘水等(即只要有能力将I-氧化为I2分子,不一定是碘分子)
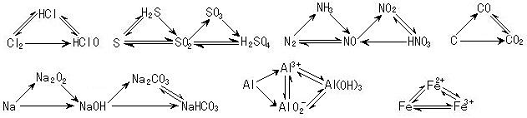
3.根据特征转化关系推断
⑴掌握一些特别的连续变化关系
![]()
①![]()
②![]()
③![]()
④![]()
⑵注意几个典型转化关系
三角转化:
⑶与碱反应产生气体
①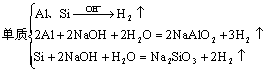
②铵盐:![]()
③既能与酸反应又能与碱反应
单质:Al
化合物:Al2O3、Al(OH)3、弱酸弱碱盐、弱酸的酸式盐、氨基酸
A— 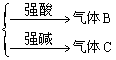
A为弱酸的铵盐如(NH4)2CO3或NH4HCO3;(NH4)2S或NH4HS;(NH4)2SO3、NH4HSO3
④与酸反应产生气体
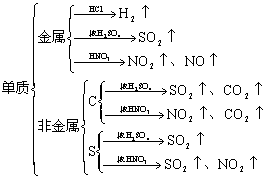
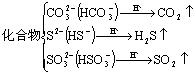
⑤Na2S2O3与酸反应既产生沉淀又产生气体:S2O![]() +2H+=S↓+SO2↑+H2O
+2H+=S↓+SO2↑+H2O
⑥与水反应产生气体
单质![]()
化合物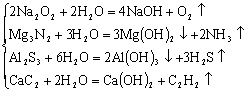
⑦强烈双水解
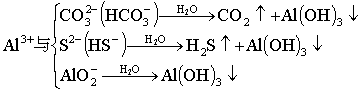
⑧与Na2O2反应
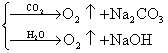
⑨电解
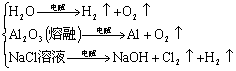
其他反应
铝热反应:Al+金属氧化物![]() 金属+Al2O3
金属+Al2O3
归中反应:2H2S+SO2=3S+2H2O 4NH3+6NO![]() 4N2+6H2O
4N2+6H2O
ClO-和ClO![]() 和Cl-在酸性条件下的归中反应
和Cl-在酸性条件下的归中反应
置换反应:
金属→金属![]()
金属→非金属![]()
非金属→非金属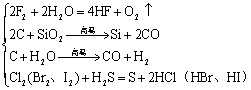
非金属→金属![]()
受热分解产生2种或3种气体的反应:
铵盐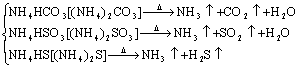
硝酸盐![]()
无机框图中常用到催化剂的反应:
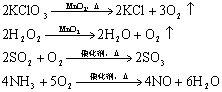
N2+3H2![]() 2NH3
2NH3
4.根据特殊工业生产推断
重要工业生产反应(回忆重要的工业过程)
⑴煅烧石灰石(工业上制取生石灰,副产物为CO2)
⑵煅烧黄铁矿 ⑶二氧化硫的催化氧化(工业上制硫酸,请关注反应的热效应、反应设备、厂址的选择、三废的利用等问题、反应条件的选择)
⑷合成氨
⑸氨的催化氧化(用于硝酸工业,知识个极为典型的连续反应工程应特别予以关注)
⑹电解饱和食盐水
⑺工业制盐酸
⑻工业制取漂粉精
⑼工业制水煤气
⑽硅酸盐工业
5.根据特征数据推断
近两年计算型推断题成为高考热点之一
①解这类题时要善于抓住物质转化时相对分子质量的变化(例CO→CO2,NO → NO2,SO2→SO3转化时分子中都增加1个氧原子,相对分子质量变化均为16);
②放出气体的体积或生成沉淀的量;
③化合物中各元素的含量;
④气体的相对密度、相对分子质量;
⑤离子化合物中离子个数比;
⑥反应物之间的物质的量比;
⑦电子总数、质子总数等重要数据。
专题练习
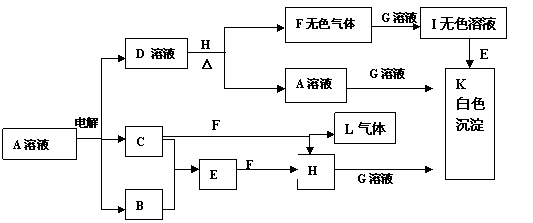
1.有A、B、C、D四种短周期的非金属元素(其单质也可分别用A、B、C、D表示),四种元素的原子序数按B、D、C、A顺序增大,D、C元素在周期表中位置相邻。在一定条件下,B可以分别和A、C、D化合生成甲、乙、丙化合物,C和D化合可得丁。已知乙、丙两个分子中各含有10个电子,并且甲、乙、丙、丁、戊有如下的变化关系:
 |
请填写下列空格:
⑴甲的浓溶液与一种黑色粉末共热可得A,工业上保存A的方法为:
__________________________________________________________。
⑵写出下列化学用语:
用电子式表示乙分子的形成过程__________________________________________,
戊分子的结构式是______________,甲和丙反应产物的电子式 _______________。
⑶写出下列反应的化学方程式:
丙+丁→D + 乙:_____________________________________________
A+丙→D + 甲:_____________________________________________
2.已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图:(注意:其中有些反应的条件及部分生成物被略去)
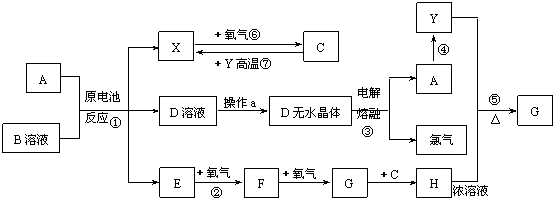 |
请填写下列空白:
⑴反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为:
。
⑵从D溶液制备D的无水晶体的“操作a”为 。
⑶反应②的化学方程式为 。
⑷反应⑤的化学方程式为______________________________________________。
⑸原电池反应①中正极的电极反应式为 。
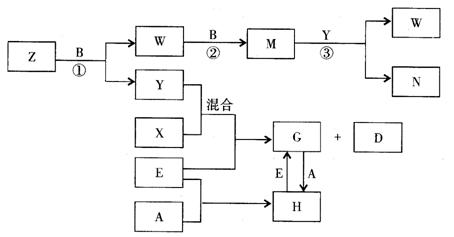
3.甲、乙、丙是三种常见的单质;A、B、C均是由两种元素组成中学化学中常见的无机物;上述物质间存在如下图所示转化关系(反应条件未注明)。
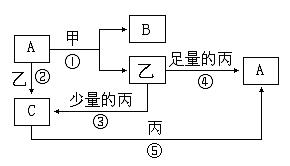 |
回答下列问题:
⑴若反应①中甲是常见金属,乙是常见非金属固态单质,则A的结构式是 ,
B的电子式是 ,C在日常生活中的用途是 。
⑵若反应①中甲是常见非金属气态单质,丙是常见金属,甲由短周期元素组成,乙与甲同主族、与丙同周期,且反应①、②、⑤通常在溶液中进行。请写出下列化学反应的离子方程式:
反应①: ;
反应②: ;
反应⑤: ;
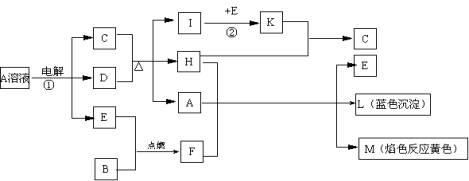
4.下图表示各物质之间的转化关系。已知:A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液。
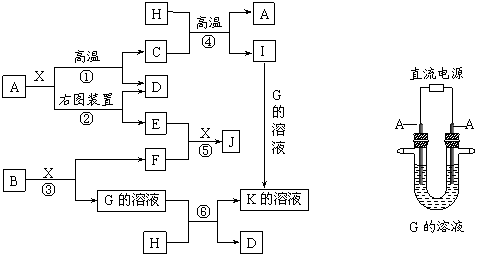 |
请按要求填空:
⑴写出B的电子式:______________________。
⑵写出生成E的电极反应式:______________________________________,反应⑤的现象是______________________________________。
⑶反应①的化学方程式是_____________________________________________,在实验室中引发反应④的操作是__________________________________________。
⑷反应⑥的离子方程式是_____________________________________________。
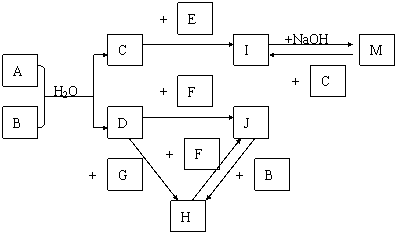
5.下图表示各物质之间的转化关系,其中A、B、C、G为单质。②为工业生产中常见反应,E是一种具有漂白作用的盐,Y易潮解,M是一种两性化合物,L是一种白色沉淀。
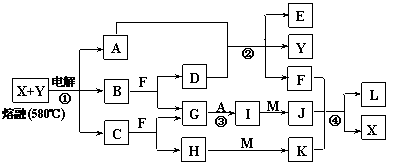
试回答下列有关问题:
⑴M的化学式 ,Y在实验室中的用途 (列举一例)。
⑵X的熔点为801℃,实际工业冶炼中常常加入一定量的Y共熔,猜想工业上这样做的目的: 。工业生产中,还常常利用电解X和F的混合物制取 。
⑶反应②的化学方程式是_______________________ ______________________。
⑷反应④的离子反应方程式是 。
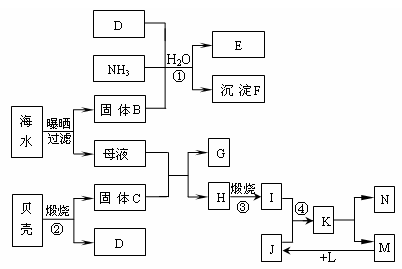 |
6.江苏省东临大海,利用海水等可制得多种化工产品。下图是以海水、贝壳等为原料制取几种化工产品的转化关系图,其中E是一种化肥,N是一种常见的金属单质。
试填写下列空白:
⑴N的化学式为:_________________;E的电子式____________________。
⑵写出反应①的化学方程式:________________________________________。
⑶反应④的离子方程式________________________________________________。
⑷由K溶液经如何处理才能制得N?___________________________________________
________________________________________________________________________。
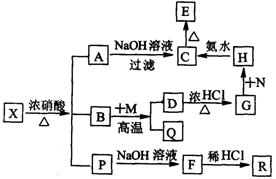 7.有一固体X它由两种常见元素组成,其中金属元素与另一元素的质量比为14:1。在一定条件下X可发生下列转化,有的反应标出全部产物,有的反应标出部分产物。P为混合物气体,R是无色无味能使澄清石灰水变浑浊的气体。C为红褐色物质,M为常见金属单质。
7.有一固体X它由两种常见元素组成,其中金属元素与另一元素的质量比为14:1。在一定条件下X可发生下列转化,有的反应标出全部产物,有的反应标出部分产物。P为混合物气体,R是无色无味能使澄清石灰水变浑浊的气体。C为红褐色物质,M为常见金属单质。
试填空:
⑴X的化学式为 。
⑵N应选择下列物质中的
_______(填序号)
a.KMnO4 b.HNO3 c.H2O2 d.C12
⑶写出反应的离子方程式:
D+G ;
H+C 。
⑷B+M反应的化学方程式: 。
8.下图表示各物质之间的转化关系。已知:常温下D、E、F、I、J为气体,且D、I是水煤气的主要成分;B是无色液体,M为红褐色固体,C的焰色反应为黄色。
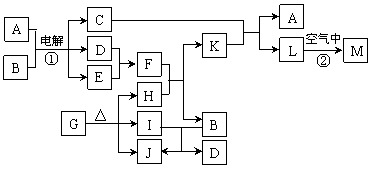 |
⑴基于反应①原理的化学工业称为 ,写出该反应的化学方程式 。
⑵写出K和E反应的离子方程式_______________________________________。
写出F溶液和H反应的离子方程式___________________________________。
⑶已知:由G分解得到的H、I、J三者的物质的量之比为1∶1∶1,则G的化学式为_____________。
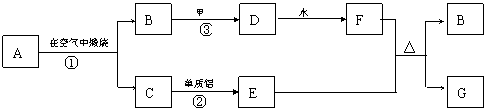 9.下图每一方框中的字母代表一种反应物或生成物,它们都是中学化学中常见的物质。其中A、C都是由两种元素组成的固态化合物,常温下甲是短周期元素的气体单质, E是过渡元素的单质。
9.下图每一方框中的字母代表一种反应物或生成物,它们都是中学化学中常见的物质。其中A、C都是由两种元素组成的固态化合物,常温下甲是短周期元素的气体单质, E是过渡元素的单质。
⑴若A是黄色固体,反应①用于工业生产,则A的化学式为________________,此时反应化学方程式为____________________________________。
⑵若A、C都是黑色固体,A经反应①生成C时,固体质量不变,则A的化学式为_______。
⑶反应③在工业生产中的条件是__________________________________。
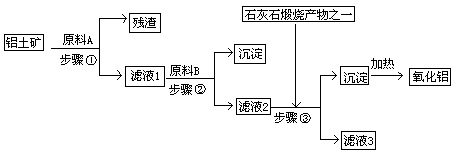 |
10.工业上用铝土矿(主要成分是Al2O3,还有少量的Fe2O3、SiO2)提取冶炼铝的原料氧化铝。工艺流程如下图:
⑴原料A的名称是_____________,步骤①反应的离子方程式是_________________。
⑵滤液1中要加入稍过量原料B,原料B的化学式是________________,步骤②反应的离子方程式是:__________________________________________。
⑶步骤③的化学方程式是:_____________________________________________。
⑷如果省去步骤①,即溶解铝土矿是从加入原料B开始,则会对氧化铝的提取有什么影响?
________________________________________________________________________。
11.A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。
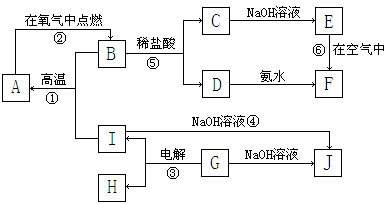 |
请填写下列空白:
⑴A、B、C、D、E、F六种物质中所含同一种元素在周期表中位置___________________。
⑵写出C、G物质的化学式。
C____________________ G______________________
⑶写出①、④、⑥反应的化学方程式:
反应①:___________________________________________________________
反应④:___________________________________________________________
反应⑥:___________________________________________________________
⑷从能量变化的角度看,①②③反应中属于△H<0的反应是___________。(填序号)
12.下图中D为常见的固体单质,E为无色有刺激性气味的气体,B、H、G为化合物,反应③为我国工业生产B的主要反应之一。(图中部分产物已略去)。
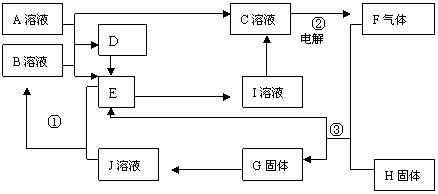 |
请按要求填空:
⑴写出A物质的化学式______________
⑵反应②中生成F气体的电极反应式为:________________________________
⑶反应③的化学方程式为:____________________________________________。当有12.0 g化合物H被氧化时,转移电子的物质的量为_________mol。
 |
13.X、Y、W是中学化学中常见的无机物,且各由两种元素组成;甲、乙、丙是三种常见的单质;这些化合物和单质间存在如下图所示转化关系(这些转化关系都不需要使用催化剂)。回答下列问题
⑴若甲为常见的金属单质,乙为黑色的非金属固态单质,且甲、乙、丙均由短周期元素组成。则化合物X与单质甲的化学反应方程式是_____________________。化合物X与单质乙的反应方程式________________________________。
⑵若丙是常见过渡元素的金属单质,乙在常温下为液态非金属单质。甲与乙同主族,且此过程中的反应都在溶液中进行。则:
①写出化合物W与单质丙反应的离子方程式________________________。
②若化合物X与单质甲以物质的量之比为1.25:1进行充分反应,则该反应的离子方程式为____________________________________。
14.一种白色晶体A极易溶于水,将A配成溶液进行如下框图所示的实验,实验现象及转化关系如下列框图所示。
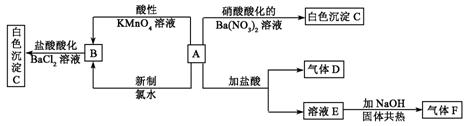
其中A为正盐,气体D能使品红溶液褪色,气体F能使湿润的红色石蕊试纸变蓝。试回答下列问题:
⑴写出下列物质化学式:A:_________________;C:_________________;
⑵写出下列反应的离子方程式:
①A和酸性KMnO4溶液:_____________________________。
②A和新制氯水:_____________________________________。
⑶通过本题的解答在检验SO![]() 时是使用HCl酸化的BaCl2溶液还是使用硝酸酸化的Ba(NO3)2,你得到的启示是:
时是使用HCl酸化的BaCl2溶液还是使用硝酸酸化的Ba(NO3)2,你得到的启示是:
____________________________________________________________________________________________________________。
15.已知A—L所代表的物质(或溶液中的溶质)都是中学化学里常见的物质。通常状况下,A、B均是淡黄色固体,D是气体单质,E是无色无味气体,K是不溶于水的酸。反应①~③是化学工业生产重要产品的全部反应,反应④是工业生产普通玻璃的反应之一。一定条件下,各物质间的相互转化关系如下图所示(反应时加入或生成的水均没标出)。
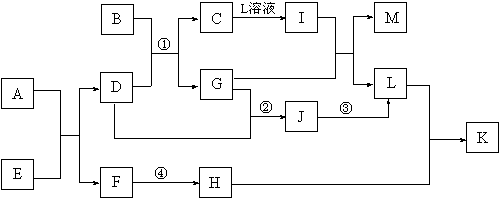
请填写下列空白:
⑴写出下列物质的化学式:B_________;D的同素异形体_________。(均填化学式)
⑵画出A中金属元素的原子结构示意图_____________;指出E分子中共价键的类型(填“极性键”或“非极性键”)____________。
⑶指出反应①②③是吸热反应,还是放热反应?____________。
⑷完成下列反应方程式:
①I+G→M+L的离子方程式:______________________________________________。
②写出反应④的化学方程式:_____________________________________________。
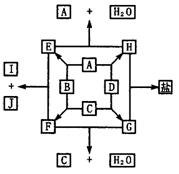 |
16.下边物质转化图中,A、B、C、D是周期表短周期元素组成的单质,A的组成元素的原子的次外层上只有2个电子,其最高氧化物的水化物是一种强酸。B、C的组成元素属同一主族。J、G分别是C的组成元素的最高价态和最低价态的化合物。冷凝E可使气体的颜色变浅。
⑴分别写出A、B、C、D的化学式:
A为___ ________;B为____ ____;C为________;D为______ __.
⑵写出生成I和J的化学方程式___________ _ __.
⑶E、F、G、J四种物质氧化性由强到弱的顺序是______ ________.
 |
17.下图中A—G是化合物,H是一种无色气态单质,D常温下是一种无色液体,它们有如下转化关系:
⑴写出A的名称: ;B分子的空间构型为: ;C结构式: ;
⑵C与E反应的化学方程式: ;
⑶写出少量A溶液与足量F的浓溶液反应的离子方程式:
。
18.下图为一些常见物质的转化关系图。电解C溶液的反应是无机化工生产中的一种重要反应,Q、M为常见单质;F、L是含有同一种元素的化合物,该元素在两种化合物中的价态不同。
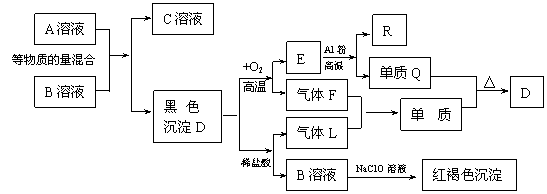
试回答下列问题:
⑴用化学式表示:B: D:
⑵完成下列反应的化学方程式:
①F+L=M+H2O 。
其中氧化产物与还原产物的物质的量比 。
②电解C的饱和溶液(用单线桥法表示其电子转移的方向和数目)
。
⑶写出R与NaOH溶液反应的离子方程式
。
 |
19.A、B、C、D、E、F、G、H、I、J、K、L是中学里常遇到的一些物质,它们之间有如下的转化关系,有些必要的信息已在图框中注明:
![]() 回答下列问题:
回答下列问题:
⑴H的电子式为___________。⑵在实验室中收集气体B的方法是_ ___ ;
在实验室中制取气体C的化学反应方程式是 .
⑶写出下列各方程式:
C+F→H+L化学反应方程式:________________ ;
I+E→K的离子反应方程式: ______________________ 。
20.A、B、C、D、E是五种中学化学常见的单质,已知A、B、C、D在常温下均为气态.其中D能分别跟A、B、C在一定条件下两两化合,生成化合物X、Y、Z;A与B、C均不能直接化合.有关的转化关系如下图所示(反应条件均已略去).
回答下列问题:
⑴A的化学式为_______________;
⑵写出反应③的化学反应方程式___________________________________________;
⑶Z和W在催化剂作用下反应生成C和Y,这是一个很有实际意义的反应,可以消除W对环境的污染,该反应的化学方程式为_____________________________________;
⑷将过量的E加到N的稀溶液中,若过程中转移电子的数目为3.01×1023个,则参加反应的E的质量为________g;
⑸将Z与N反应后的产物溶于水中,则溶液的pH(填“<”或“>”)________7,其原因是________________________________________________________________。
21.已知B是常见金属单质,E为常见非金属单质,H常温下为无色液体。根据下列关系,试回答:
⑴L的化学式: F的电子式: 。
⑵反应①的离子方程式: 。
⑶反应②,工业上采取的反应条件: 。
⑷每生成1molK,反应放出98.3kJ热量,该反应的热化学方程式为:
。
 |
22.下列每一方框中的字母代表某物质或其溶液,其中A为常见的气态氧化物,B为液态非金属单质,E、F为常见金属单质,I和M两溶液反应后可生成胶状白色沉淀,各物质有如下转化关系:
试填写下列空白:
⑴B的化学式为 ,F的化学式为 ;
⑵E 和氧化物G反应的化学方程式为 ;
⑶C和D在一定条件下可反应生成A和B,其反应的化学方程式为
。
二轮复习专题之无机推断参考答案
1.⑴ 干燥后加压液化贮存于钢瓶中
⑵![]() H-O-Cl
H-O-Cl ![]()
⑶4NH3+6NO![]() 5N2+6H2O 2NH3+3Cl2=6HCl+N2
5N2+6H2O 2NH3+3Cl2=6HCl+N2
2.⑴2Mg+CO2![]() 2MgO+C
⑵将D溶液在HCl气流中蒸干
2MgO+C
⑵将D溶液在HCl气流中蒸干
⑶②4NH3+5O2![]() NO+6H2O ⑷⑤C+4HNO3(浓)
NO+6H2O ⑷⑤C+4HNO3(浓)![]() CO2+4NO2↑+2H2O
CO2+4NO2↑+2H2O
⑸2NH4++2e-=2NH3↑+H2↑
3.⑴O=C=O ![]() 用作燃气
用作燃气
⑵①2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
②2Fe2++Br2=2Fe3++2Br- ⑤Fe+2Fe3+=3Fe2+
4.⑴Na+[![]() ]2-Na+
]2-Na+
⑵Fe+2OH――2e-=Fe(OH)2 白色物质迅速转变为灰绿色最终变为红褐色
⑶3Fe+4H2O![]() Fe3O4+4H2 加少量KClO3,插上镁条并将其点燃
Fe3O4+4H2 加少量KClO3,插上镁条并将其点燃
⑷2Al+2OH-+2H2O=2AlO2-+3H2↑
5.⑴Al2O3 用作干燥剂
⑵降低X、Y熔化时的温度,节约能源 Cl2、H2和NaOH
⑶2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
⑷Al3++3AlO2-+6H2O=4Al(OH)3↓
6.⑴Mg ![]()
⑵NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl
⑶MgO+2H+=H2O+Mg2+
⑷MgCl2溶液必须在氯化氢气体中进行蒸发结晶制得MgCl2晶体,熔融后电解才能制取金属镁
7.⑴Fe3C ⑵cd
⑶Fe3O4十8H+==Fe2++2Fe3++4H2O Fe3++3NH3·H2O==Fe(OH)3↓++3NH4+
![]()
8.⑴氯碱工业 2NaCl+2H2O![]() H2↑+C12↑+2NaOH
H2↑+C12↑+2NaOH
⑵2Fe2++Cl2=2Fe3++2Cl— FeO+2H+=Fe2++H2O⑶FeC2O4
9.⑴FeS2 4 FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
⑵Cu2S ⑶催化剂、400℃一500℃
10.⑴盐酸(硫酸、硝酸) Al2O3+6H+=2Al3++3H2O Fe2O3+6H+=2Fe3++3H2O
⑵NaOH H++OH-=H2O Fe3++3OH-=Fe(OH)3 ↓ Al3++4OH-=AlO2-+2H2O
⑶NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
⑷若用NaOH溶液溶解铝土矿,则有部分SiO2溶解在NaOH溶液中生成硅酸钠,最后使加热制得的Al2O3混有SiO2杂质
11.⑴第四周期、第Ⅷ族 ⑵FeCl2 Al2O3
⑶8Al+3Fe3O4![]() 4Al2O3+9Fe 2Al+2OH-+2H2O=2AlO2-+3H2↑
4Al2O3+9Fe 2Al+2OH-+2H2O=2AlO2-+3H2↑
4Fe(OH)2+O2+2H2O=4Fe(OH)3
⑷①②
12.⑴ Na2S2O3 ⑵ 4OH--4e-=O2↑+2H2O
⑶4FeS2+11O2![]() 2Fe2O3+8SO2 1.1
2Fe2O3+8SO2 1.1
⑷2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
13.⑴2Mg+CO2 2MgO+C CO2+C 2CO
⑵①2Fe3++Fe=3Fe2+ ②8Cl2+10Fe2++6Br-=16Cl-+3Br2+10Fe3+
14.⑴(NH4)2SO3 BaSO4
⑵①2MnO![]() +5SO
+5SO![]() +6H+==2Mn2++5SO
+6H+==2Mn2++5SO![]() +3H2O
+3H2O
②Cl2+H2O+SO![]() ==SO
==SO![]() +2H++2Cl-
+2H++2Cl-
⑶在确定溶液中不含Ag+等干扰离子存在时可选用盐酸酸化的BaCl2溶液作试剂检验SO![]() ,在确定溶液中不含SO
,在确定溶液中不含SO![]() 等干扰离子存在时可选用HNO3酸化的Ba(NO3)2溶液作试剂检验SO
等干扰离子存在时可选用HNO3酸化的Ba(NO3)2溶液作试剂检验SO![]()
15.⑴FeS2 O3
⑵Na  极性键
极性键
⑶放热反应
⑷①2Fe3+ + SO2 + 2H2O![]() 2Fe2+
+ SO42- + 4H+
2Fe2+
+ SO42- + 4H+
②Na2CO3 + SiO2![]() Na2SiO3
+ CO2↑
Na2SiO3
+ CO2↑
16.⑴![]()
![]() S
S ![]() ⑵
⑵![]()
⑶E、J、F、G或![]() >
>![]() >
>![]() >
>![]()
17.⑴碳酸氢铵 三角锥 O=C=O
⑵2CO2 + 2Na2O2==2Na2CO3 + O2
⑶NH4+ + HCO3- + 2OH- ==H2O + NH3·H2O + CO32-
18.⑴FeCl2 FeS
⑵①SO2+2H2S
3S↓+2H2O 2: 1
②2NaCl+2H2O
2NaOH+H2↑+Cl2↑ 单线桥略
⑶Al2O3+2OH— 2AlO2—+H2O
19.⑴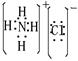 ⑵向下排空气法
4HCl+MnO2
⑵向下排空气法
4HCl+MnO2![]() MnCl2+Cl2↑+H2O
MnCl2+Cl2↑+H2O
⑶3Cl2+8NH3=N2+6NH4Cl Ag(NH3)![]() + OH—+3H+
+Cl—=AgCl↓+2NH4++H2O
+ OH—+3H+
+Cl—=AgCl↓+2NH4++H2O
20.⑴![]()
⑵![]() ;
;
⑶![]() ;
;
⑷14
⑸<
在溶液中![]() 电离出的
电离出的![]() 发生水解:
发生水解:![]()
![]()
![]() 使溶液呈酸性,故溶液的pH<7
使溶液呈酸性,故溶液的pH<7
21.⑴Cu(OH)2
⑵2Cu2++2H2O![]() 2Cu↓+O2↑+4H+
2Cu↓+O2↑+4H+
⑶常压,催化剂,400-500oC
⑷SO2(g) + 1/2 O2(g) ![]() SO3(g);△H=-98.3kJ/mol
SO3(g);△H=-98.3kJ/mol
22.⑴Br2 Fe
⑵2Al+Fe2O3![]() 2Fe+Al2O3;
2Fe+Al2O3;
⑶H2SO4(浓)+2HBr=Br2+SO2↑+2H2O