高三化学下学期第一次质量检测试题
相对原子质量:H:1、 C:12、 N:14、O:16 、Na:23 、Al:27 、Cl:35.5 、 K:39 、Cu:64
一.选择题
6.2007年我国自主研制的“嫦娥一号”将飞向月球.长征2号火箭承担运载“嫦娥一号”的使命。氢化锂、氘化锂、氚化锂可以作为启动长征2号(CZ2F)火箭发射的优良炸药。下列说法正确的是
A.LiH,LiD,LiT的摩尔质量之比为1:2:3
B.它们都是强氧化剂
C.H、D、T之间互称同素异形体
D.它们都是强还原剂
7能正确表示下列反应的离子方程式是:
A. 向偏铝酸钠溶液中滴加过量的碳酸氢钠溶液:
AlO2-+ 4H+= A13 + + 2H2O
B.用 NaOH 溶液吸收过量的硫化氢气体: 2OH-十 H2S =S2-+ 2H2O
C.氯化银溶于浓氨水:
AgCl + 2NH3·H2O = [ Ag ( N H3 ) 2 ] + + Cl-+ 2H2O
D.向沸水中滴加饱和的氯化铁溶液:
Fe3 + + 3H2O = Fe ( OH ) 3↓ + 3H+
8. 设NA为阿伏加德罗常数,下列说法正确的是
A、通常状况时,28g氮气所含原子数目为NA
B、常温常压下,1 mol二氧化氮完全被碱吸收消耗NA个氢氧根离子
C、在常温常压下,11.2L氯气所含有 原子数目为NA
D、标准状况时,22.4L一氯甲烷和二氯甲烷的混合物所含分子数为NA
9. 一定条件下反应mA(g)+ nB (g) ![]() pC(g)+qD(g);△H<0.在一密闭容器中进行,测得平均反应速度v(C)=2v(B)。若反应达平衡后保持温度不变,加大体系压强时平衡不移动,则m、n、p、q的数值可以是
pC(g)+qD(g);△H<0.在一密闭容器中进行,测得平均反应速度v(C)=2v(B)。若反应达平衡后保持温度不变,加大体系压强时平衡不移动,则m、n、p、q的数值可以是
A.2、2、1、2 B.3、1、2、2 C.3、1、2、1 D.1、3、2、2
10.过氧化氢在二氧化锰催化作用下分解放出氧气的反应机理如下:
①MnO2 + H2O2
+ 2H+ Mn2+ + O2↑+2H2O;
②Mn2+ + H2O2 MnO2 + 2H+。
下列说法正确的是
A.H2O2在①中是氧化剂,在②中是还原剂
B.Mn2+在①中是还原产物,在②中是氧化产物
C.在①中每生成1 mol O2,转移的电子数为2.408 × 1024
D.在二氧化锰催化作用下1 mol H2O2分解生成0.5 mol O2
11.25℃时,下列各组溶液等体积混合后,所得溶液pH最大的是
A.0.1 mol · L – 1CH3COOH溶液与0.1mol · L – 1 NaOH溶液
B.0.1 mol · L – 1 H2SO4溶液与0.2 mol · L – 1氨水
C.pH = 1的CH3COOH溶液与pH = 13的NaOH溶液
D.pH = 1的盐酸与pH = 13的Ba (OH)2溶液
![]() 12.X、Y、Z、W均为短周期元素,它们在周期表的位置如图所示,若W原子的最外层电子数是内层电子总数的7/10,下列说法中正确的是
12.X、Y、Z、W均为短周期元素,它们在周期表的位置如图所示,若W原子的最外层电子数是内层电子总数的7/10,下列说法中正确的是
A. 阴离子的半径从大到小排列顺序为:
X > Y > Z > W
B.Y元素的氢化物分子间可以形成氢键
C.Y的两种同素异形体在常温下可以相互转化
D.最高价氧化物对应的水化物的酸性:Z> W
13.取ag某物质A,在氧气中完全燃烧,使燃烧产物跟足量过氧化钠反应,反应后固体的质量增加了bg。若b>a,则A为
A.H2 B.CO C.C12H22O11 D.C6H12O6
26.(12分)A、B、C、D四种短周期元素,原子序数依次增大;A和C能形成一种分子X或一种+1价阳离子Y;B元素的原子最外层电子数是次外层电子数的2倍;C、D在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体。
试回答下列问题:
(1)A、B的元素符号分别为 、 。
(2)写出Y水解的离子方程式 。
(3)将9gB单质在空气中充分燃烧,所得气体通入1L 1mol/LNaOH溶液中,完全吸收后,溶液中各离子浓度由大到小的顺序是 。
(4)在101kPa时,1gX气体在D单质中充分燃烧,生成一种液态化合物和另一种对环境无污染的稳定物质,放出18.6kJ的热量。该反应的热化学方程式为 。
27.(17分) 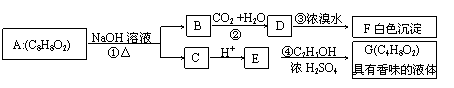 药用有机物A为一种无色液体.从A出发可发生一系列反应:
药用有机物A为一种无色液体.从A出发可发生一系列反应:
试回答:(1)化合物A的结构简式
(2)写出反应③④的反应类型:反应③ , 反应④
(3)有机物A的同分异构体甚多,其中属于羧酸类的化合物,且含有苯环结构的异构体有 种,
(4)E 的一种同分异构体H,已知 H可以和金属钠反应放出氢气,且在一定条件下可发生银镜反应.试写出 H的结构简式: . E的另一种 同分异构体R在一定条件下也可发生银镜反应,但不能和金属钠反应放出氢气.试写出R的结构简式: .
(5)写出反应②、③、④的化学方程式
28.(16分)为了测定一包含有碳酸钠杂质的碳酸氢钠样品的纯度,某校二个课外学习小组在实验室进行了如下实验:
(1)第一组同学称取样品m1 g置于坩埚中加热至恒重,根据质量减少来计算其纯度。
①为完成测定,以下图示中还缺少的仪器名称是 .

![]()
![]()
![]()
![]()
![]()
②加热至恒重的操作是: 加热、冷却、称量。重复操作,直到两次称量的质量差小于0.1g.这样做的目的是
 ③若坩埚质量为m0,恒重后坩埚和残留物质量为m2g,则计算碳酸氢钠样品纯度的计算式为w(NaHCO3)% =
×100% 。
③若坩埚质量为m0,恒重后坩埚和残留物质量为m2g,则计算碳酸氢钠样品纯度的计算式为w(NaHCO3)% =
×100% 。
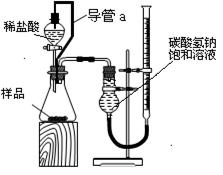
(2)第二组同学设计了如下图所示的装置来测定碳酸氢钠样品的纯度.回答下列问题:
①装置中导管a的作用是:Ⅰ
、
Ⅱ
.
②实验结束时,该组同学在测量实验中生成气体体积时应注意的问题是
a实验结束后立即读数,b待实验装置冷却后,上下移动碱式滴定管,使其中液面与干燥管中液面相平;c将视线与碱式滴定管内溶液的凹液面最低处相平来读取液体体积
③第二组同学在实验中准确测得3个数据:实验前样品的质量mg,实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL,由此欲计算碳酸氢钠样品纯度时发现少了一个必须的物理量,该物理量是 。
29(15分)物质A~F有如下图的转化关系,反应①、②、③均是在高温下进行的(必要时可使用催化剂).A是人类使用最广泛的金属,B是最常见的溶剂,E为一种还原性气体,而且其分子与氮气分子具有相同的电子数.
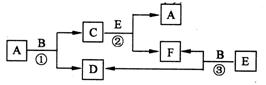
回答下列问题:
(1)写出物质C和E的化学式:C是________,E是________.
F的电子式是
(2)写出反应①的化学方程式:
(3)写出B只作还原剂的反应的一个化学方程式:
(4)H是一种微溶于水易溶于有机溶剂的可燃性气体,其分子与E分子具有相同的电子数,写出实验室制取H气体的化学方程式
。
高三第一次质量检测化学试题参考答案
6 D 7 C 8 B 9 B 10 D 11 A 12 B 13C
26.(12分)(1)H (1分) C(1分)
![]() (2)NH4++H2O NH3·H2O+H+ (3分)
(2)NH4++H2O NH3·H2O+H+ (3分)
(3)c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) (3分)
(4)4NH3(g)+3O2(g)=2N2(g)+6H2O(1); △H=-1264.8kJ/mol (4分)
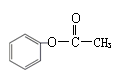 27.(17分)
27.(17分)
(1) (2)取代反应(1分) 酯化反应 (1分)
(3)4 (3 分)
(4)HOCH2CHO HCOOCH3
![]() (5)
(5)
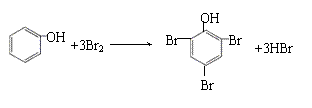 反应②
反应②
反应③
 |
反应④ CH3COOH +CH3CH2OH CH3COOC2H5+H2O
(结构式,方程式各2 分)
28.(16分)
(1)①坩埚钳 、干燥器 (2分)
②保证 NaHCO3全部分解 (2分)
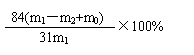 |
|
|
|
|
|
(2)①Ⅰ使分液漏斗内气体压强与锥形瓶内气体压强相等,使分液漏斗中的稀盐酸能顺利滴下(2分);
Ⅱ滴入锥形瓶的稀盐酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀盐酸引起的二氧化碳气体体积误差(2分)。
② b、 c(3分)
③ 该条件时的气体摩尔体积。(2分)
29.(15分)(1)Fe3O4 CO ![]()
|
(3) 2F2+2H2O=== 4HF+O2
![]() (4)CaC2+H2O Ca(OH)2 +C2H2
↑
(4)CaC2+H2O Ca(OH)2 +C2H2
↑
2007届一机一中高三第一次质量检测化学试题答题卡
化学试题得分:
| 题号 | 选择题 | 26 | 27 | 28 | 29 | 小计 |
| 分 数 |
选择题
| 题号 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答 案 |
26.(12分)(1)
(2)
(3)
(4)
27.(17分)
(1) (2)
(3)
(4)
(5)
反应②
反应③
反应④
28.(16分)
(1) ① 、
②
|
|
|
|
|
(2)①Ⅰ
、
Ⅱ
②
③
29.(15分)(1)
(2)
(3
(4)