高三化学下学期第四次周测试卷
班级_________________ 姓名_______________
可能用到的相对原子质量:H—1 C—12 O—16 Na—23 Mg—24 S—32 Cl—35.5 K—39 Ca—40 Cu—64
第Ⅰ卷 (共72分)
一.选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1.“在火星上找到水存在的证据”位居《science》杂志评出的2004年10大科技突破之首。下列关于水的说法中错误的是
A.水是生命活动必不可少的物质
B.水是由极性健构成的极性分子.
C.水是一种极弱的电解质,温度越高电离程度越大
D.高效催化剂可使水分解获得氢气,同时释放能量
2.放射性112277Uub的一个原子经过6次衰变(每次衰变都放出一个相同粒子)后,得到比较稳定的第100号元素镄(Fm)的含153个中子的核素。下列说法中正确的是
A.每次衰变都放出一个氘原子 B.最终得到核素的符号是镄![]()
C.Uub和Fm都是主族元素 D.上述Uub和Fm原子核中中子数和质子数之差相同
3. 下列有关实验室一般事故的预防和处理方法正确的是
A.燃着的酒精灯打翻失火,应立即用水浇灭
B.少量酸或碱滴到实验台上,立即用湿抹布擦净,再用水冲洗抹布
C.金属钠着火时,可用干粉灭火器来扑灭
D.蒸发食盐溶液时,发生液滴飞溅现象,应立即加水冷却
4.已知蓄电池在充电时作电解池,放电时作原电池。铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“—”。关于标有“+”的接线柱,下列说法中正确的是
A.充电时作阳极,放电时作正极 B.充电时作阳极,放电时作负极
C.充电时作阴极,放电时作负极 D.充电时作阴极,放电时作正极
5.NH4+离子浓度相同的下列各物质的溶液中,物质的量浓度最大的是
A.NH4 Al(SO4)2 B.NH4HCO3 C.NH4HSO4 D.NH4NO3
6.实验室用浓盐酸与二氧化锰反应制取氯气,下列有关说法中正确的是(气体体积在标准状况下测定)
A.若提供0.4molHCl,MnO2不足量,则可制得氯气2.24L
B.若提供0.4molHCI,MnO2过量,则可制得氧气2.24L
C.若有0.4 molHCI参与反应,则可制得氯气2.24L
D.若有0.4 molHCI被氧化,则可制得氯气2.24L
7.用下图装置制取、提纯并收集表中的四种气体(a、b,c表示相应仪器中加入的试剂),其中可行的是
| 气体 | a | b |
| |
| A | NO2 | 浓硝酸 | 钢片 | 氢氧化钠溶液 |
| B | SO2 | 浓硫酸 | Cu | 酸性高锰酸钾溶液 |
| C | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| D | CO2 | 稀硫酸 | CaCO3粉末 | 浓硫酸 |
8.t℃时CuSO4的溶解度是Sg,其饱和溶液密度为dg/cm3,物质的量
浓度为cmol/L。向足量饱和溶液中加入mg无水CuSO4或蒸发掉ng水后恢复到t℃,均能获得Wg胆矾晶体,下列关系式正确的是
![]()
![]()
![]()
![]()
二.选择题(本题包括10小题,第9-16题每小题4分,第17、18每小题5分,共42分。每小题有一个或两个选项符合题意。)
9.口香糖中常用木糖醇做甜味剂,木糖醇可以防止龋齿,木糖醇的结构简式为:
![]() ,下列有关木糖醇的说法正确的是
,下列有关木糖醇的说法正确的是
 A.木糖醇是—种单糖,不能发生水解反应
A.木糖醇是—种单糖,不能发生水解反应
B.木糖醇易溶解于水,能发生酯化反应
C.木糖醇在口腔中不易被氧化为酸
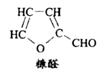
D.木糖醇脱去三分子水可得糠醛(结构如右图)
10.将一元酸HA的溶液与一元碱BOH的溶液等体积混合,若所得溶液呈垦酸性,下列有关判断正确的是
A.若混合前酸、碱pH之和等于14,则HA肯定是弱酸
B.若混合前酸、碱物质的量浓度相同,则HA肯定是弱酸
C.溶液中水的电离程度:混合溶液>纯水>BOH溶液
D.混合溶液中离子浓度一定满足:c(B+)>c(A-)>c(H+)>c(OH-)
 11.用NA表示阿伏加德罗常数,下列说法中正确的是
11.用NA表示阿伏加德罗常数,下列说法中正确的是
A.乙烯和丙烯的混合物1.4g中含有0.1NA个碳原子
B.6.8g熔融的KHSO4中含有0.1NA个阳离子
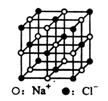
C.23.4gNaCl晶体中含有0.1NA个右图所示的结构单元
D.电解精炼铜时转移0.1NA个电子时阳极溶解3.2g铜
12.下列各组离子能大量共存,当溶液中c(H+)=10-1mol/L时,有气体产生;而当溶液中c(H+)=10-13mol/L时,又能生成沉淀。试组离子可能是
A.Na+、Cu2+、NO3-、CO32- B.Ba2+、K+、Cl-、HCO3-
C.Fe2+、Na+、SO42-、NO3- D.Mg2+、NH4+、SO42-、Cl-
13.巳知25℃、l0lkPa下,石墨、金刚石燃烧的热化学方程式分别为;
C(石墨)+O2(g)=CO2(g);△H= —393.51kJ/mol C(金刚石)+O2(g)=CO2(g);△H=-395.4l kJ/mol
据此推理所得到的下列结论正确的是
A.金刚石的燃烧热比石墨的燃烧热小 B.石墨晶体中碳碳键的强度小于金刚石
C.石墨的能量比金刚石的能量高 D.由石墨制备金刚石—定是吸热反应
14.下列反应的离子方程式书写正确的是
A.等体积等物质的量浓度的氢氧化钠溶液与明矾溶液混合:
Ba2++3OH-+Al3++ SO42-=BaSO4↓+Al(OH)3↓
B.向苯酚钠溶液中通人少量CO2:C6H5O-+CO2+H2O→C6H5H↓+HCO3-
C.向硫代硫酸钠溶液中滴人过量稀硫酸:4H++2S2O32-=3S↓+ SO42-+2 H2O
|
15.与铁相似,金属锡能溶于盐酸生成氯化亚锡,氯化亚锡又能被氯化铁氧化为氯化锡。则下列有关微粒氧化、还原能力的比较中,正确的是
A.氧化能力:Sn4+<Sn2+ B.氧化能力:Fe3+<Sn4+
C.还原能力:Fe2+< Sn2+ D.还原能力:Fe < Sn
16.A和B是短周期元素,A2一与B+的核外电子总数之差为8,则下列说法正确的是
A.A和B的原子序数之差为8 B.A和B原子的最外层电子数之和为8
C.A和B原子的最外层电子数之差为7 D.A和B原子的核外电子数总和可能为11
17.A、B分别是M元素的碳酸盐和碳酸氢盐,将一定量A、B的混合物与足量盐酸反应,消耗HCl与生成CO2的物质的量之比为3:2。已知M可能是ⅠA族或ⅡA族元素,则混合物中A、B的物质的量之比可能是
A.3﹕1 B.2﹕1 C.1﹕2 D.1﹕1
 18.甲、乙两容器都发生反应2A(g)+B(g)==xC(g),两容器温度和初始压强相同。甲容器中充入2molA和1molB,达平衡后,C在平衡混合气中的体积分数为
18.甲、乙两容器都发生反应2A(g)+B(g)==xC(g),两容器温度和初始压强相同。甲容器中充入2molA和1molB,达平衡后,C在平衡混合气中的体积分数为![]() 、物质的量为n1;乙容器中充入1.4molA、0.7molB和0.6molC,达平衡后C在平衡混合气中的体积分数为
、物质的量为n1;乙容器中充入1.4molA、0.7molB和0.6molC,达平衡后C在平衡混合气中的体积分数为![]() 、物质的量为n2。下列说法中正确的是
、物质的量为n2。下列说法中正确的是
A.若甲、乙两容器均为恒容容器,则x必等于2
B.若甲、乙两容器均为恒压容器,则x必等于3
C.若甲为恒压容器、乙为恒容容器,且x≠3,则n1必大于n2
D.若甲为恒容容器、乙为恒压容器,且x=3,则n1必大于n2
第Ⅱ卷(共78分)
三、(本题包括2小题,共21分)
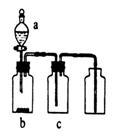
19.(8分)右上图是某学生设计的制取和收集某些气体的实验装置(可加热)。 使用该装置制备和收集以下气体,可用排空气法收集的是 ,可用排水法收集的是 (填编号)。
A、用Zn与稀盐酸反应制H2 B、用MnO2与双氧水反应制O2
C、用MnO2与浓HCl反应制C12 D、用Mn02与KCl03反应制O2
E、用CaCO3与稀盐酸反应制CO2 F、用Cu与稀HNO,反应制NO
G、用固体NH。C1和消石灰制NH3
20.(13分)某学生计划用37%,密度为1.19 g/ml的浓盐酸配制0.2mol/L的稀盐酸500mL,若实验仪器有: A、100mL量筒 B、托盘天平 C、玻璃棒 D、100mL容量瓶 E、10mL量筒 F、胶头滴管 G、100mL烧杯 H、500mL容量瓶
(1)实验时应选用的仪器是(填编号):
(2)在容量瓶的使用方法中,下列操作不正确的是(填编号):
A、使用容量瓶前检查它是否漏水;
B、容量瓶用蒸馏水洗净后,不经干燥直接用于配溶液;
C、配制溶液时,将所取液体或固体直接倒人容量瓶中,缓慢加入蒸馏水到液面接近容量瓶刻度lcm一2cm处时,改用滴管滴加蒸馏水至溶液的凹液面正好与刻度线相切;
D、将容量瓶倾斜,使溶解的溶液直接沿容量瓶内壁倾注入容量瓶;
E、当液面达刻度线后,盖好容量瓶的瓶塞,将容量瓶反复颠倒、摇匀。
(3)该学生用上述准确配制的0.2mol/L的盐酸通过中和滴定方法来测定某NaOH和 Na2CO3,混合溶液中两种溶质的物质的量浓度。设计以下两个实验方案:(已知指示剂发生颜色变化的pH范围分别是:甲基橙:3.1—4.4,酚酞:8.2—10。常温下,二氧化碳饱和溶液的pH约为3.9)
方案I:①取混合溶液VmL,加人足量BaCl:溶液后,以酚酞为指示剂,用上述盐酸滴定,到滴定终点时耗用盐酸V。mL;②再另取混合溶液VmL,以甲基橙为指示剂,用上述盐酸滴定,到滴定终点时,耗用盐酸V,mL
方案II:操作方法与[方案I]相同,但①②两过程所用的指示剂作了调换,即①以甲基橙为指示剂,②以酚酞为指示剂。假设以上操作都是准确的,试评价两个方案的合理性,若合理,只写出计算c(NaOH)、c(Na2CO3)物质的量浓度的数学表示式;若不合理,请简要说明理由.
四.(本题包括2小题,共18分)
21.(6分)化学上将一步完成的反应称为基元反应。只由一个基元反应构成的化学反应称为简单反应;由两个或两个以上基元反应构成的化学反应称为复杂反应。对于基元反应:aA+bB→cC+dD,其速率可以表示为v=k·{c(A)}a·{c(B)}b (k称为速率常数),复杂反应的速率取决于慢的基元反应。已知反应NO2+CO→NO+CO2,在不同的温度下反应机理不同,请回答下列问题:
(1)温度高于220℃时,实验测得该反应的速率方程是v=k·c(NO2)·c(CO),则该反应是_______________________(填“简单反应”或“复杂反应”)。
(2)温度低于250℃时,实验测得该反应的速率方程是v=k·{c(NO2)}2,又知该反应是由两个基元反应构成的复杂反应,其中较慢的基元反应的反应物和生成物均为氮氧化物(目前已被科学家确认的氮氧化物有N2O、NO、NO2、N2O3、 N2O4 、N2O5 、NO3等)。
请你根据上述事实,大胆猜想:反应“NO2+ CO→NO+CO2”,在该条件下的反应机理(用方程式表示该反应的历程,并在括号内注明“快反应”或“慢反应”)。
①________________________________________________( );
②________________________________________________( )。
22.(12分)下图表示各物质之间的转化关系。已知:A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液。请按要求填空:
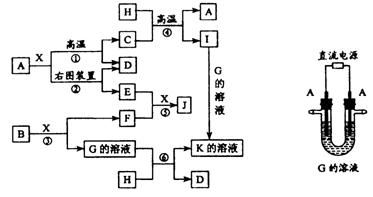
(1)写出B的电子式:____________________________________。
(2)写出生成E的电极反应式:_____________________________________,反应⑤的现象是___________________________________________。
(3)反应①的化学方程式是_________________________________________,在实验室中引发反应④的操作是______________________________________。
(4)反应⑥的离子方程式是________________________________________。
五.(本题包括2小题,共21分)
23.(11分)下图表示各物质之间的转化关系。已知:A、B、I都是XY2型化合物,且阳离子相同,A、B晶体中阴、阳离子个数比都是1∶1,但I晶体中阴、阳离子个数比是2∶1,I常用作干燥剂。
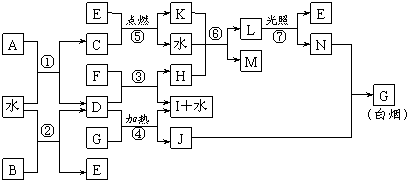 |
请按要求填空:
⑴G的电子式是_______________;
⑵反应⑥的化学方程式是__________________________________,反应⑤在空气中发生时的现象是________________________________,已知C的燃烧热是1300 kJ·mol-1,表示C的燃烧热的热化学方程式是________________________________________。
⑶根据上图中物质之间的转化关系及题中所给信息判断,B的化学式是_________。
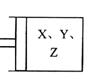 24.(10分)如右图所示,将6molX和3molY混合气体置于体积可变的
24.(10分)如右图所示,将6molX和3molY混合气体置于体积可变的
等压容器中,在一定温度下发生如下反应:2X(g)+Y(g) ![]() 2z(g)。
2z(g)。
反应达到平衡状态A时,测得气体总物质的量为6.6mol。若X、Y、
z的起始物质的量分别用a、b、c表示,回答下列问题:
(1)达平衡状态A时,Y的转化率为 ,在达到平衡状态A的容器中通人少量Y.体系中X的体积分数 (填“增大”或“减小”或“不变”)。
(2)若起始时a=3.2mol,且达到平衡后各气体的体积分数与平衡状态A相同,则起始时b、c的取值分别为 , 。
(3)若要使反应开始时向逆反应方向进行,且达到平衡后各气体的物质的量与平衡状态A相同,则起始时c的取值范围是 。
六.(本题包括2小题,共18分)
25.(7分)取MgS固体2.8g溶于100mL1mol/L的硫酸,放出硫化氢1008mL(已折合成标准状况下的气体体积)。
(1)求所得溶液中氢硫酸的物质的量浓度?(溶液体积变化忽略不计)
(2)加热驱尽溶液中硫化氢后,为使金属镁离子完全沉淀,至少应加入lmol/L的NaOH溶液多少毫升?
26.(11分)现有一包铝热剂是铝粉和氧化铁粉末的混合物,在高温下使之充分反应,将反应后的固体分为两等份,进行如下实验(计算pH时假定溶液体积没有变化):
①向其中一份固体中加入100 mL 2.0 mol·L—1的NaOH溶液,加热使其充分反应后过滤,测得滤液的pH=14;
②向另一份固体中加入140 mL 4.0 mol·L—1的HCl溶液,使固体全部溶解,测得反应后所得溶液中只有H+、Fe2+和Al3+三种阳离子且pH=0。
⑴计算这包铝热剂中铝的质量和氧化铁的质量。
⑵计算实验②产生气体的体积(标准状况下)。
![]()
 高三化学第四次周测试卷 .
高三化学第四次周测试卷 .
答题纸
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||
| 答案 | ||||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
第Ⅰ卷(选择题 共72分)
第Ⅱ卷(非选择题 共78分)
三. (本题包括2小题,共21分)
19.(8分)可用排空气法收集的是 ,可用排水法收集的是 (填编号)。
20.(1) (5分) 实验时应选用的仪器是(填编号):
(2)(2分)在容量瓶的使用方法中,操作不正确的是(填编号):
(3)(6分)试评价两个方案的合理性,若合理,只写出计算c(NaOH)、c(Na2CO3)物质的量浓度的数学表示式;若不合理,请简要说明理由.
方案I:
方案II:
四.(本题包括2小题,共18分)
21.(1)(2分)该反应是_______________________(填“简单反应”或“复杂反应”)。
(2)(4分) 在该条件下的反应机理(用方程式表示该反应的历程,并在括号内注明“快反应”或“慢反应”)。
①________________________________________________( );
②________________________________________________( )。
22.(12分,每空2分)(1)写出B的电子式:______________________。
(2)写出生成E的电极反应式:_____________________________________,
反应⑤的现象是___________________________________________。
(3)反应①的化学方程式是_________________________________________,
在实验室中引发反应④的操作是______________________________________。
(4)反应⑥的离子方程式是______________________________________ 。
五.(本题包括两小题,共21分)
23.(11分,除热化学方程式3分外,余每空2分)
⑴G的电子式是_______________;
⑵反应⑥的化学方程式是__________________________________,
反应⑤在空气中发生时的现象是________________________________,
已知C的燃烧热是1300 kJ·mol-1,表示C的燃烧热的热化学方程式是____________
。
⑶根据上图中物质之间的转化关系及题中所给信息判断,B的化学式是_________。
24.(10分,每空2分)
(1)达平衡状态A时,Y的转化率为 ,在达到平衡状态A的容器中通人少量Y.体系中X的体积分数 (填“增大”或“减小”或“不变”)。
(2)若起始时a=3.2mol,且达到平衡后各气体的体积分数与平衡状态A相同,则起始时b、c的取值分别为 , 。
(3)若要使反应开始时向逆反应方向进行,且达到平衡后各气体的物质的量与平衡状态A相同,则起始时c的取值范围是 。
六.(本题包括两小题,共18分)
25.(7分)(1)求所得溶液中氢硫酸的物质的量浓度?(溶液体积变化忽略不计)
(2)至少应加入lmol/L的NaOH溶液多少毫升?
26.(11分)(1)计算这包铝热剂中铝的质量和氧化铁的质量。
(2)计算实验②产生气体的体积(标准状况下)。
![]()
 高三化学第四次周测试卷
高三化学第四次周测试卷
答题纸
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||
| 答案 | D | D | B | A | B | C | D | C | ||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | BC | A | AC | BC | D | B | C | D | BD | CD |
第Ⅰ卷(选择题 共72分)
第Ⅱ卷(非选择题 共78分)
三. (本题包括2小题,共21分)
19.(8分)可用排空气法收集的是 A ,可用排水法收集的是 ABF (填编号)。
20.(1) (5分) 实验时应选用的仪器是(填编号):CEFGH
(2)(2分)在容量瓶的使用方法中,操作不正确的是(填编号): CD
(3)(6分)试评价两个方案的合理性,若合理,只写出计算c(NaOH)、c(Na2CO3)物质的量浓度的数学表示式;若不合理,请简要说明理由.
方案I:
方案II:
四.(本题包括2小题,共18分)
21.(1)(2分)该反应是 简单反应 (填“简单反应”或“复杂反应”)。
(2)(4分) 在该条件下的反应机理(用方程式表示该反应的历程,并在括号内注明“快反应”或“慢反应”)。
①___2NO2→NO3+NO (慢反应)__________
②___ NO3+CO→NO2+CO2(快反应)__________
22.(12分,每空2分)(1)写出B的电子式:______________________。
(2)写出生成E的电极反应式:Fe+2OH--2e-=Fe(OH)2
反应⑤的现象是_白色物质迅速转变为灰绿色最终变为红褐色。
|
在实验室中引发反应④的操作是_加少量KClO3,插上镁条并将其点燃。
(4)反应⑥的离子方程式是_2Al+2OH-+2 H2O =2AlO2-+3H2↑_。
五.(本题包括两小题,共21分)
23.(11分,除热化学方程式3分外,余每空2分)
⑴G的电子式是_____![]() _;
_;
⑵反应⑥的化学方程式是_ Ca(ClO)2+CO2+H2O=CaCO3+2HClO _,
反应⑤在空气中发生时的现象是_火焰明亮并伴有浓烈黑烟,
已知C的燃烧热是1300
kJ·mol-1,表示C的燃烧热的热化学方程式是CH≡CH(g)+![]() O2(g)→2CO2(g)+H2O(l);ΔH=-1300 kJ·mol-1
O2(g)→2CO2(g)+H2O(l);ΔH=-1300 kJ·mol-1
⑶根据上图中物质之间的转化关系及题中所给信息判断,B的化学式是CaO2。
24.(10分,每空2分)
(1)达平衡状态A时,Y的转化率为 80% ,在达到平衡状态A的容器中通人少量Y.体系中X的体积分数 减小 (填“增大”或“减小”或“不变”)。
(2)若起始时a=3.2mol,且达到平衡后各气体的体积分数与平衡状态A相同,则起始时b、c的取值分别为 b=1.6mol/L , C为任意值 。
(3)若要使反应开始时向逆反应方向进行,且达到平衡后各气体的物质的量与平衡状态A相同,则起始时c的取值范围是 4.8 <C≦ 6 。
六.(本题包括两小题,共18分)
26.(11分)(1)计算这包铝热剂中铝的质量和氧化铁的质量。
n(Al)=n(NaOH)×2=0.2 mol, m(Al)=5.4 g
实验②所得溶液中,根据“电荷守恒”有n(H+)+2×n(Fe2+)+3×n(Al3+)=n(Cl-)
则n(Fe2+)=![]() =0.06 mol
=0.06 mol
铝热剂中n(Fe2O3)=n(Fe2+)×![]() ×2=0.06 mol,m(Fe2O3)=9.6 g
×2=0.06 mol,m(Fe2O3)=9.6 g
(2)计算实验②产生气体的体积(标准状况下)。
V(H2)=n(H2)×22.4 L·mol-1=[n(Al)×![]() ×
×![]() +n(Fe)×
+n(Fe)×![]() ]×22.4 L·mol-1=2.688 L
]×22.4 L·mol-1=2.688 L
 c
c