专题九:《化学中的各种平衡》
海门实验学校
【考点分析】
1.了解化学中的各种平衡。
2.了解化学反应的可逆性。理解化学平衡的含义及其与反应速率的内在联系。
3.理解勒沙特列原理的含义。掌握浓度、温度、压强等条件对化学平衡移动的影响。
4.理解水的电离及电解质的电离平衡概念。
【典型例析】
【例1】在化学中存在着各类平衡,请同学们列举我们所接触到的各类平衡?
| 平衡类型 | 举例 | 平衡特征 | 遵循原理 |
| 化学平衡 | N2 + 3H2 D 2NH3 | 动 等 定 变
| 勒夏特列原理 |
| 电离平衡 | HAc DH++ Ac- | ||
| 水解平衡 | Ac-+H2O D HAc + OH- | ||
| 溶解平衡 | Mg(OH)2(s) DMg2+(aq) + 2OH-(aq) |
【点评】通过举例使学生了解化学中的各种平衡。
【例2】 在日常生产、生活中,我们在哪些方面应用了勒夏特列原理?
| 生产生活实例 | 涉及的平衡 | 根据勒原理所采取的措施或原因解释 |
| 1.接触法制硫酸 | 2SO2+O2 D 2SO3 | 通入过量的空气 |
| 2.合成氨工业 | N2+3H2 D 2NH3 | 高压(20MPa-50MPa),及时分离液化氨气 |
| 3.金属钠从熔化的氯化钾中置换金属钾 | Na + KCl D NaCl + K | 控制好温度使得钾以气态形式逸出。 |
| 4.候氏制碱法 | NH3+CO2+H2O=NH4HCO3 NH4HCO3+NaClD NaHCO3+NH4Cl | 先向饱和食盐水中通入足量氨气 |
| 5.草木灰和铵态氮肥不能混合使用 | CO32-+H2OD HCO3-+OH- NH4++H20D NH3·H2O + H+ | 两水解相互促进,形成更多的NH3·H2O,损失肥效 |
| 6.配置三氯化铁溶液应在浓盐酸中进行 | Fe3++3H2OD Fe3++3H+ | 在强酸性环境下,Fe3+的水解受到抑制 |
| 7.用热的石碱水洗油腻 | CO32-+H2OD HCO3-+OH- | 加热促进水解,OH-离子浓度增大 |
【点评】通过举例使学生了解日常生活、生产中所涉及到的各种平衡,及各种平衡的具体应用。
【例3】(04江苏18题)在容积固定的密闭容器中存在如下反应: A(g)+3B(g) ![]() 2C(g);△H<0
2C(g);△H<0
某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
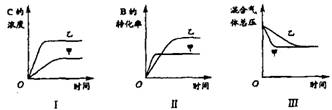
下列判断一定错误的是
A.图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
【解析】催化剂只能改变化学反应速率,不能使化学平衡发生移动,若研究催化剂对反应的影响,则图Ⅰ中甲、乙两种情况下C的浓度应该相等;图Ⅱ若是研究压强对反应的影响,由于甲先达平衡,则甲的压强比乙大,而压强越大B的转化率越高,与图Ⅱ矛盾;图Ⅱ若是研究温度对反应的影响,由于甲先达平衡,则甲的温度比乙高,而正反应方向放热,所以从乙→甲平衡向逆反应方向移动,B的转化率减小与图Ⅱ相符;图Ⅲ中甲、乙达到相同的平衡状态且甲先达平衡,与D项所述情况相符。
【答案】A B
【点评】本题主要考查外界条件(温度、压强、催化剂)对化学平衡的影响及学生对图象的分析能力。
【例4】(03江苏第18题)将0.2mol·L-1HCN溶液和0.1mol·L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是
A c(HCN)<c(CN-) B c(Na+)>c(CN-)
C c(HCN)-c(CN-)=c(OH-) D c(HCN)+c(CN-)=0.1mol·L-1
【解析】0.2mol·L-1HCN溶液和0.1mol·L-1的NaOH溶液等体积混合后,得到0.05mol·L-1HCN和0.05mol·L-1 NaCN的混合溶液,由于混合以后溶液显碱性。即CN-水解程度大于HCN电离程度,所以c(HCN) >c(CN-) 。所以A错误。根据电荷守恒c(Na+)+C(H+)=C(OH-)+ c(CN-),因为C(OH-)>C(H+),所以c(Na+)>c(CN-),所以B正确。根据物料平衡c(HCN) +c(CN-)=0.05mol·L-1+0.05mol·L-1=0.1mol·L-1 所以D正确。假如HCN不电离,则水解了的CN- 应等于OH-,即c(CN-) + C(OH-)= c(HCN),而实际上HCN 存在电离平衡,所以C 错误。
【答案】BD
【点评】本题涉及酸碱中和反应以及电解质的电离和盐类的水解两种平衡,是一道考查思维灵敏和严密性的综合题。
【例5】(江苏03年第26题)(12分)I.恒温、恒压下,在一个可变容积的容器中发生如下发应:
A(气)+B(气)![]() C(气)
C(气)
(1)若开始时放入1molA和1molB,到达平衡后,生成a molC,这时A的物质的量为 mol。
(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为 mol。
(3)若开始时放入x molA,2molB和1molC,到达平衡后,A和C的物质的量分别是ymol和3a mol,则x= mol,y= mol。
平衡时,B的物质的量 (选填一个编号)
(甲)大于2 mol (乙)等于2 mol
(丙)小于2 mol (丁)可能大于、等于或小于2mol
作出此判断的理由是
。
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是 。
II.若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上述反应。
(5)开始时放入1molA和1molB到达平衡后生成b molC。将b与(1)小题中的a进行比较 (选填一个编号)。
(甲)a<b (乙)a>b (丙)a=b (丁)不能比较a和b的大小
作出此判断的理由是 。
【解析】
(1)由于平衡时生成a molC,则同时反应了A 、B各a mol,所以平衡时A的物质的量为(1-a)mol 。
(2)由于在恒温、恒压下,开始时加入3molA和3molB,达平衡后,生成C的物质量也是开始时的3倍,即C 的物质量为3(1-a)mol 。
(3)达平衡后,C 的物质的量是3a mol ,与(2)等效,则开始时放入的各物质也与(2)等效。所以X+1=3,即X =2。Y=3(1-a)mol。平衡时B的物质量也为(3-3a )mol。当a=1/3时,(3-3a )等于2,当a <1/3时,(3-3a )>2,当a >1/3时,(3-3a )<2。选丁。
(4)若在(3)的平衡混合物中再加入3molC,由于是恒温、恒压,所以平衡时与(1)等效,所以达平衡时,C 的物质的量分数与(1)相同,即![]() 。
。
(5)由于温度和体积不变,随着反应的进行,压强变小,平衡向逆方向移动,所以平衡时C 的物质的量b <a,选乙。
【答案】(1)(1-a) (2)3a (3)2 3-3 a 丁
若3a>1,B的物质的量小于2mol;若![]() ,B的物质的量等于2mol;
,B的物质的量等于2mol;
若3a<1,B的物质的量大于2mol
(4)![]()
(5)乙 因为(5)小题中容器容积不变,而(1)小题中容器的容积缩小,所以(5)小题的容器中的压力小于(1)小题容器中的压力,有利于逆向反应,故反应达到平衡后a>b。
【点评】本题考查的知识点是化学平衡及平衡移动等基本概念;考查学生分析问题、开发信息、发现规律和运用规律,从而解决问题的能力,是属于探究性层次的试题。
本题分两部分:Ⅰ.是在恒温恒压下的气体反应:A(g)+B(g)===C(g)是气体物质的量减少的原因,因此也是恒压时体积缩小的反应。题目设置了三种情况,有层次地向考生提出问题,解决了前一问题,就为解决后一问题提供了台阶。
Ⅱ.设置的情景是起始条件相同、恒容时建立平衡和恒压时建立平衡两种情况下,比较C 的物质的量的大小。
【方法归纳】
1、方法与技巧
①等价转化思想:等价转化思想是一种数学思想,借助到化学平衡中,可以简化分析过程。化学平衡状态的建立与反应途径无关,无论可逆反应是从正反应方向开始,还是从逆反应方向开始,或从中间状态开始,只要起始投入的物质的量相当,则均可达到等效平衡状态。这里所说的“相当”即“等价转化”的意思。
②放大缩小思想:该方法适用于起始投入的物质的量存在于一定倍数关系的反应。它指的是将反应容积的梯级扩大一定的倍数,让起始反应物的浓度相同,则在一定的条件下,可建立相同的平衡状态。然后,在此基础上,进行压缩,使其还原为原来的浓度。分析在压缩过程中,平衡如何移动,再根据勒夏特列原理,分析相关量的变化情况。
③大于零思想:对于可逆反应,不论什么情况下,一定是反应物与生成物共存的状态,即任何物质的物质的量均大于零。
2、解题注意点
认真阅读试题,弄清题目中问的是什么?给出的条件是什么?列出解题的关键字词,是解答此类试题的关键。不少考生由于不深入地观察思考,对题设条件以点盖面、以偏盖全,忽视了题中的隐含条件,匆忙地依靠熟题效应,简单地给出答案,结果造成错误。
3、命题趋势
化学平衡是每年高考的必考内容,命题一般集中在以下几项:
1、 根据外界条件的变化判断化学平衡移动的方向;
2、 由平衡移动的方向判断反应的热效应;
3、 由平衡体系压强的变化推断反应物和生成物里气体物质的系数关系;
4、 能对平衡体系进行有关起始浓度、变化浓度、平衡浓度及反应转化率等方面的计算。
[课堂训练]
1、下列事实中不能用勒夏特列原理来解释的是( )
A.往硫化氢水溶液中加碱有利于S2-的增加 B.加催化剂有利于合成氨反应
C.合成氨时不断将生成的氨液化,有利于提高氨的产率。D.合成氨时常采用500℃的高温
2、已知工业上真空炼铷原理如下:2RbCl +Mg D MgCl2 +2Rb(气),对于此反应的进行能给予正确解释的是( )
A.铷的金属活动性不如镁强,故镁可置换铷。B.铷的沸点比镁低,把铷蒸气抽锄时平衡右移。
C.氯化镁的稳定性不如氯化铷强。 D.铷的单质状态较化合态更稳定。
3、(05上海16)欲使0.1mol/L的 NaHCO3溶液中c(H+)、c(CO32—)、c(HCO3—) 都减少,其方法是
A.通入二氧化碳气体 B.加入氢氧化钠固体
C.通入氯化氢气体 D.加入饱和石灰水溶液
4、(04江苏10)用pH均为2的盐酸和醋酸溶液,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗盐酸和醋酸溶液的体积分别为Vl和V2,则Vl和V2的关系正确的是
A.V1>V2 B.V1<V2 C.V1=V2 D.V1≤ V2
5、(03江苏17)在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的体积和pH都相等,向两烧杯中同时加入质量不等的锌粒,反应结束后得到等量的氢气。下列说法正确的是
A 甲烧杯中放入锌的质量比乙烧杯中放入锌的质量大
B 甲烧杯中的酸过量
C 两烧杯中参加反应的锌等量
D 反应开始后乙烧杯中的c(H+)始终比甲烧杯中的c(H+)小
6、(05广东7)下图所示的直型石英玻璃封管中充有CO气体,左端放置不纯的镍(Ni)粉。在一定条件下,Ni可以与CO(g)发生如下反应:
 | |||
 | |||
但Ni粉中的杂质不与CO(g)发生反应。玻璃管内左右两端的温度分别稳定在350K和470K,经过足够长时间后,右端的主要物质是
A、纯Ni(s)和Ni(CO)4(g) B、纯Ni(s)和CO(g)
C、不纯Ni(s)和CO(g) D、不纯Ni(s)和Ni(CO)4(g)
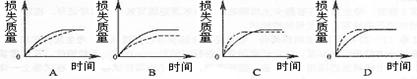
7.(04上海 8)将A g块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如下图的实线所示,在相同的条件下,将B g (A)B)粉末状碳酸钙与同浓度盐酸反应,则相应的曲线(图中虚线所示)正确的是( )
8.(04广东9)一定温度下,反应2SO2+O2![]() 2SO3,达到平衡时,n(SO2):n(O2):n(SO3)=2:3:4。缩小体积,反应再次达到平衡时,n(O2)=0.8
mol,n(SO3)=1.4 mol,此时SO2的物的量应是
2SO3,达到平衡时,n(SO2):n(O2):n(SO3)=2:3:4。缩小体积,反应再次达到平衡时,n(O2)=0.8
mol,n(SO3)=1.4 mol,此时SO2的物的量应是
A.0.4 mol B.0.6 mol C.0.8 mol D.1.2 mol
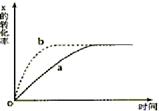 9.(04广东18)右图曲线a表示放热反应X(g)+Y(g)
9.(04广东18)右图曲线a表示放热反应X(g)+Y(g) ![]() Z(g)+M(g)+N(g)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应的过程按b曲线进行,可采取的措施是
Z(g)+M(g)+N(g)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应的过程按b曲线进行,可采取的措施是
A.升高温度
B.加大X的投入量
C.加催化剂
D.增大体积
10.
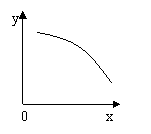 (05广东14)在一定条件下,固定容积的密闭容器中反应:2NO2(g)
(05广东14)在一定条件下,固定容积的密闭容器中反应:2NO2(g)![]() O2(g) + 2NO(g);ΔH>0, 达到平稳。当改变其中一个条件X,Y随X的变化符合图中曲线的是
O2(g) + 2NO(g);ΔH>0, 达到平稳。当改变其中一个条件X,Y随X的变化符合图中曲线的是
A、当X表示温度时,Y表示NO2的物质的量
B、当X表示压强时,Y表示NO2的转化率
C、当X表示反应时间时,Y表示混合气体的密度
D、当X表示NO2的物质的量时,Y表示O2的物质的量
11、(05上海16)欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO32¯)、c(HCO3¯)都减少,其方法是( )
A、通入二氧化碳气体 B、加入氢氧化钠固体
C、通入氯化氢气体 D、加入饱和石灰水溶液
12、(05全国卷Ⅲ10)向0.1 mol·L-1NaOH溶液中通入过量CO2后,溶液中存在的主要离子是
A.Na+、CO![]() B.Na+、HCO
B.Na+、HCO![]()
C.HCO![]() 、CO
、CO![]() D.Na+、OH-
D.Na+、OH-
[课堂训练] 答案:1.BD 2.B 3. D 4. A 5. AC 6.B 7. C 8.
[课后训练]
![]() 1.(00全国13)在一密闭容器中,反应 aA(气) bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
1.(00全国13)在一密闭容器中,反应 aA(气) bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
A.平衡向正反应方向移动了
B.物质A的转化率减少了
C.物质B的质量分数增加了
D.a>b
![]() 2.(00全国16)已知反应A+3B 2C+D在某段时间内以A的浓度变化表示的化学反应速度为mol·L-1·min-1,则此段时间内以C的浓度变化表示的化学反应速率为
2.(00全国16)已知反应A+3B 2C+D在某段时间内以A的浓度变化表示的化学反应速度为mol·L-1·min-1,则此段时间内以C的浓度变化表示的化学反应速率为
A.0.5mol·L-1·min-1 B.1 mol·L-1·min-1
C.2 mol·L-1·min-1 D.3 mol·L-1·min-1
3.(00广东20)同温同压下,当反应物分解了8%时,总体积也增加8%的是
![]() A.2NH3(g)
N2(g)+3H2(g)
A.2NH3(g)
N2(g)+3H2(g)
![]() B.2NO(g)
N2(g)+O2(g)
B.2NO(g)
N2(g)+O2(g)
![]() C.2NO3(g)
4NO2(g)+O2(g)
C.2NO3(g)
4NO2(g)+O2(g)
![]() D.2NO2(g)
2NO(g)+O2(g)
D.2NO2(g)
2NO(g)+O2(g)
![]() 4.(00上海19)对于反应2SO2+O2
4.(00上海19)对于反应2SO2+O2![]() 2SO3,下列判断正确的是
2SO3,下列判断正确的是
A.2体积2SO2和足量O2反应,必定生成2体积SO3
B.其他条件不变,增大压强,平衡必定向右移动
C.平衡时,SO2消耗速度必定等于O2生成速度的两倍
D.平衡时,SO2浓度必定等于O2浓度的两倍
5、(03全国11)某温度下,在一容积可变的容器中,反应2A(g)+B(g)![]() 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是
2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是
A.均减半 B.均加倍 C.均增加1mol D.均减少1mol
![]() 6.( 04全国Ⅲ-9)在恒温恒容条件下,能使A(g)+B(g) C(g)+D(g)正反应速率增大的措施是
6.( 04全国Ⅲ-9)在恒温恒容条件下,能使A(g)+B(g) C(g)+D(g)正反应速率增大的措施是
A.减小C或D的浓度 B.增大D的浓度
C.减小B的浓度 D.增大A或B的浓度
7.(04天津13)一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g)![]() 2SO3(g)达到平衡后改变下述条件,SO3气体平衡浓度不改变的是
2SO3(g)达到平衡后改变下述条件,SO3气体平衡浓度不改变的是
A. 保持温度和容器体积不变,充入1molSO3(g)
B. 保持温度和容器内压强不变,充入1molSO3(g)
C. 保持温度和容器内压强不变,充入1molO2(g)
D. 保持温度和容器内压强不变,充入1molAr(g)
8.(04广东5)在恒温时,一固定容积的容器内发生如下反应:2NO2(g)
![]() N2O4(g),达平衡是,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数
N2O4(g),达平衡是,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数
A.不变 B.增大 C.减小 D.无法判断
9、(00春季18)浓度均为0.1mol/L的甲酸和氢氧化钠溶液等体积相混合后,下列关系式正确的是
A.c(Na+)>c( HCOO-) >c( OH-) >c( H+)
B.c( HCOO-) >c( Na+) >c( OH-) >c( H+)
C.c( Na+) =c( HCOO-) =c( OH-) =c( H+)
D.c( Na+) =c( HCOO-) >c( OH-) >c( H+)
10、(00全国10)室温下,在pH=12的某溶液中,由水电离的c( OH-) 为
A.1.0×10-7mol·L-1 B.1.0×10-6mol·L-1
C.1.0×10-2mol·L-1 D.1.0×10-12mol·L-1
11、(00广东7)PH=7的盐酸和PH=9的氢氧化纳溶液以体积比11:9混合,混合液的pH
A.为7.2 B.为8 C.为6 D.无法计算
12、(00上海17)等物质的量浓度的下列溶液中,NH4+离子的浓度最大的是
A.NH4Cl B.NH4HCO3 C.NH4HSO4 D.NH4NO3
13、(01春季18)在0.1mol·L-1 Na2CO3溶液中,下列关系正确的是
A.c(Na+)=2c(CO32-) B.c(OH-)=2c(H+)
C.c(HCO3-)>c(H2CO3) D.c(Na+)<{c(CO32-)+c(HCO3-)}
14、(01上海19)将0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10rnL混合后,溶液显酸性,则溶液中有关微粒的浓度关系正确的是
A.c (Ac-)>c (Cl-)>c (H+)>c (HAc)
B.c (Ac-)>c (Cl-)>c (HAc)>c(H+)
C.c (Ac-)=c (Cl+)>c (H+)>c (HAc)
D.c (Na+)+c (H+)=c (Ac-)+c (Cl-)+c (OH-)
15、(05江苏18)一定温度下,在恒容密闭容器中发生如下反应:2A(g) + B(g) ![]() 3C(g),若反应开始时充入2molA和2molB,达平衡后A的体积分数为a%。其它条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是
3C(g),若反应开始时充入2molA和2molB,达平衡后A的体积分数为a%。其它条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是
A.2mol C B.2molA、1molB和1molHe(不参加反应)
C.1molB和1molC D.2molA、3molB和3molC
18.答案: AB
16.(04全国Ⅰ29)恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:
![]() N2
(g) + 3 H2(g)
2NH3(g)
N2
(g) + 3 H2(g)
2NH3(g)
⑴若反应达平衡时某时刻t时,nt (N2) = 13mol,nt (NH3) = 6mol,计算a的值
⑵反应达平衡时,混合气体的体积为726.8L(标况下),其中NH3的含量(体积分数)为25%。计算平移时NH3的物质的量。
⑶原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始)∶n(平) = 。
⑷原混合气体中,a∶b = 。
⑸达到平衡时,N2和H2的转化率之比,α(N2)∶α (H2)= 。
⑹平衡混合气体中,n(N2)∶n(H2)∶n(NH3) = 。
17、(01上海26)用实验确定某酸HA是弱电解质。两同学的方案是:
甲:① 称取一定质量的HA配制0.lmol/L的溶液100mL;
② 用pH试纸测出该溶液的pH值,即可证明HA是弱电解质。
乙:① 用已知物质的量浓度的HA溶液、盐酸,分别配制pH=l的两种酸溶液各100mL;
② 分别取这两种溶液各10mL,加水稀释为100mL;
③ 各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现 象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH 1(选填>、<、=)
乙方案中,说明HA是弱电解质的现象是 (多选扣分)
(a)装HCl溶液的试管中放出H2的速率快;
(b)装HA溶液的试管中放出H2的速率快;
(c)两个试管中产生气体速率一样快。
(3)请你评价:乙方案中难以实现之处和不妥之处
、
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述。
(1)100mL容量瓶(注:未标明规格的扣 分) (2)>b(多选扣分) (3)配制pH=l的HA溶液难以实现 不妥之处在于加入的锌粒难以做到表面积相同
(4)配制NaA溶液,测其pH值>7即证明HA是弱电解质
18、已知,(1)Cu2+、Fe2+在pH=4—5的条件下不水解,而Fe3+几乎全部水解。(2)双氧水(H2O2)是强氧化剂,在酸性条件下,它的还原产物是H2O。现用粗氧化铜(含少量铁)制取氯化铜溶液的过程如下:
①取50mL纯净盐酸,加入一定量粗氧化铜,加热搅拌,充分反应后过滤,测得滤液pH为3。
②向滤液中加入双氧水、搅拌。
③调节②中的溶液的为4,过滤。
④把③所得滤液浓缩。
回答以下问题:
(1)②中所发生反应的离子方程式是 。
(2)③中使pH升到4采取的措施是,加入过量的( ),并微热、搅拌。
A.氢氧化钠 B.氨水 C.氯化铜 D.氧化铜
(3)③中过滤后的滤渣的成分是 。
19.⑴反应mA+nB![]() pC在某温度下达到平衡。
pC在某温度下达到平衡。
①若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系是______。
②若C为气体,且m+ n =p,在加压时化学平衡发生移动,则平衡必定向____方向移动。
③如果在体系中增加或减少B的量,平衡不发生移动,则B肯定不能为_____态。
④若升高温度,A的转化率降低,则此反应的逆反应是_______热反应。
⑵有可逆反应:A(g)+B(g)![]() 3C(g),下图分别表示在不同条件下,生成物C在反应混合物中的百分含量(C%)和反应时间表(t)的关系图。
3C(g),下图分别表示在不同条件下,生成物C在反应混合物中的百分含量(C%)和反应时间表(t)的关系图。
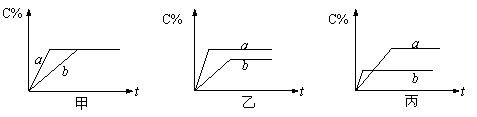 |
按下述要求填空:
①若甲图中两条曲线分别表示有无催化剂时的情况,则______曲线表示无催化剂。
②若乙图中两条曲线分别表示200℃和100℃的情况,则该可逆反应的正反应是_____热反应。
③若丙图中的两条曲线分别表示不同压强下的情况,则____曲线表示压强较大时的情况。
20、(10分)有甲、乙两个容积相等的恒容密闭容器,向甲中通入6mol A和2mol B,向乙中通入1.5mol A、0.5mol B和3molC和2molD,将两容器的温度恒定在770K,使反应3A(g)+B(g)![]() xC(g) +D(s)达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,试回答下列有关问题:
xC(g) +D(s)达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,试回答下列有关问题:
(1)若平衡时,甲、乙两容器中A的物质的量相等,则x=_________;若平衡时,甲、乙两容器中A的物质的量不相等,则x=_________。
(2)平衡时甲、乙两容器中A、B的物质的量之比是否相等____________(填“相等”或“不相等”),平衡时甲中A的体积分数为____________。
(3) 若平衡时,甲、乙两容器中A的物质的量相等,改为按不同配比作为乙的起始物质,达到平衡后,C的体积分数都仍为0.2。
①反应从逆反应方向开始,则D的起始物质的量应满足的条件是________
②若加入0.6molA和0.2molB,则C和D起始物质的量分别应满足______,______
(4)若平衡时两容器中的压强不相等,则两容器中压强之比为_____________。
21.常温下将0.01molNH4Cl和0.002molNaOH溶于水配成1L溶液。
⑴用化学用语表示该溶液中的三个平衡关系是:①________________________;
②___________________;③______________________________________。
⑵这些微粒中浓度为0.01mol/L的是________浓度为0.002mol/L的是_________。
⑶物质的量之和为0.01mol的两种微粒是_________________。
⑷ _________和________两种微粒数量之和比OH-多0.008mol。
22.一定温度下,有a、盐酸;b、硫酸;c、醋酸三种酸的稀溶液。(用a、b、c、<、=、>号填写)
①当其物质的量浓度相同时,c(H+)由大到小的顺序是___________________,
②同体积同物质的量浓度的三种酸,中和NaOH能力的顺序是___________________,
③当其c(H+)相同时,物质的量浓度由大到小的顺序为_____________________,
④当c(H+)相同、体积相同时,分别加入足量锌,相同状况产生的气体体积由大到小的
顺序为______________________。
⑤当pH相同、体积相同时,同时加入锌,若产生相同体积的氢气(相同状况)则开
始时反应速率__________________,反应所需的时间___________________。
⑥将c(H+)相同的三种酸均稀释10倍,c(H+)由大到小的顺序为__________________。