高三化学上学期市统考模拟测试题
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。共150分。考试用时120分钟。
第Ⅰ卷(选择题 共60分)
可能用到的相对原子质量:H—1 C—12 N—14 O—16 Na—23 Mg—24
Al—27 S—32 Cl—35.5 V—51
一、选择题(本题包括6小题,每小题4分,共24分。每小题只有一个选项符合题意)
1.下列说法中正确的是
A.禽流感是一种传染病,高温蒸煮不能杀灭禽流感病毒。
B.蒸发食盐溶液时,发生液滴飞溅现象,应立即加水冷却
C.用饱和NaHCO3溶液可以除去CO2气体中混有的少量SO2
D.油条制作时常加入明矾(KAl(SO4)2)作膨化剂,以补充人体所需要的微量元素
2.火星探测器发回的信息表明,火星上存在针铁矿[Goethite,化学式:FeO(OH)]和黄钾铁矾[Jarosite],从而证明火星表面曾经存在过水。这一发现被《人民日报》评为2004世界十大新闻之首。已知两种矿物中铁的价态相同,则黄钾铁矾{化学式记为:KFe3(SO4)2(OH)n}中n值为:
A.4 B.5 C.6 D.7
3.鉴别氯化铁溶液和氢氧化铁溶胶最简便的方法是
A.观察颜色 B.渗析 C.利用电泳现象 D.利用丁达尔现象
4.据称2004年冬季将是自1869年人类有气象观测记录以来的四大暖冬之最。江苏气温预计较常年偏高4-6℃。这与下列各组中的两种气体在大气中的含量都有关系的是
A.SO2、CO2 B.NO2、CO C.CO2、CH4 D.NO、O3
5.物质X(□)和物质Y(〇)的反应如下图所示,对该反应的描述,下列反应方程式正确的是
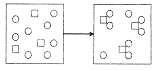
A.3X+8Y=X3Y8 B.3X十8Y=3XY2十2Y
C.3X+6Y=X3Y6 D.X+2Y=XY2
6.生命起源的研究是世界性科技领域的一大课题,科学家模拟10亿年前的还原性大气环境进行紫外线辐射实验,认为生命起源的第一层次是产生了
A.氨基酸 B.蛋白质 C.羧酸 D.糖类
二、选择题(本题包括9小题,每小题4分,共36分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
7.我国支持“人文奥运”的一个重要体现是坚决反对运动员服用兴奋剂。某种兴奋剂的结构简式如右图所示,有关该物质的说法不正确的是
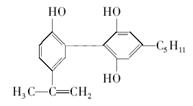
A.遇FeCl3溶液显紫色,因为该物质与苯酚互称为同系物
B.该分子中的所有碳原子不可能共面
C.1 mol 该物质与浓溴水和H2反应时最多消耗Br2和H2的量分别为4 mol 、7 mol
D.滴入酸性KMnO4溶液,观察到紫色褪去,无法证明结构中一定存在碳碳双键
8.三国时代,诸葛亮领兵南征孟获,遇到了“哑泉”,士兵饮后致哑,腹痛,甚至死亡。又有一“安乐泉”饮后可解“哑泉”之毒。1995年10月国内某报刊报道,经科研人员研究,“哑泉”水中溶有CuS04,“安乐泉”水质偏碱性。下列有关说法可能符合题意的是
①“哑泉”之毒是由于水中的Cu2+使人体中的蛋白质变性
②“哑泉”之毒是由于水中的SO42-使人体中的蛋白质变性
③“哑泉”之毒是由于水中的Cu2+水解显酸性使人体中的蛋白质变性
④“安乐泉”能解“哑泉”之毒的离子方程式为Cu2++2 OH-=Cu(OH)2↓
A.①④ B.②④ C.③ D.均不正确

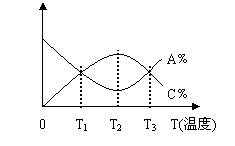
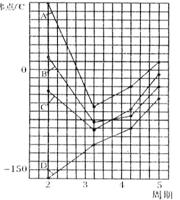
![]() 9. 10.已知可逆反应:a A(g) +b B(g) c C(g) 中,各物质的含量A﹪和C﹪随温度的变化曲线如图,下列说法正确的是
9. 10.已知可逆反应:a A(g) +b B(g) c C(g) 中,各物质的含量A﹪和C﹪随温度的变化曲线如图,下列说法正确的是
A.该反应在温度T1和T3时达到过化学平衡
B.该反应在温度T2时达到过化学平衡
C.该反应的逆反应是放热反应
D.升高温度,平衡会向正反应方向移动
10.某老师在课堂上做了一个如右图所示的实验,发现烧杯中酸性高锰酸钾溶液褪色。若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,最终溶液呈血红色。判断下列说法中正确的是
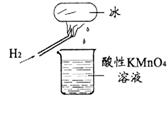
A.该条件下生成的水分子化学性质比较活泼
B.该条件下H2被冷却为液态氢,液氢的水溶液具有还原性
C.该条件下H2燃烧生成了既具有氧化性又具有还原性的物质
D.该条件下H2燃烧的产物中可能还有一定量的H2O2
11.实验测得常温下0.1 mol/L某一元酸(HA)溶液的pH不等于l ,0.1 mol/L某一元碱(BOH)溶液里:C(H+)/C(OH—)=10—12。将这两种溶液等体积混合后,所得溶液里各离子的物质的量浓度的关系正确的是
A.C(B+)>C(A—)>C(OH—)>C(H+) B.C(A—)>C(B+)>C(H+)>C(OH—)
C.C(B+)+C (H+)=C(A—)+C(OH—) D.C(B+)>C(A—)>C(H+)>c(OH—)
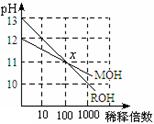 12.MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如右图所示。下列叙述中正确的是
12.MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如右图所示。下列叙述中正确的是
A.MOH是一种强碱
B.在x点,c(M+) = c(R+)
C.在x点,ROH完全电离
D.稀释前,c(ROH) =10 c(MOH)
13.下列离子组在pH=0的溶液里能大量共存的是
A.Na+、Fe2+、Cl—、NO3— B.K+、Al3+、HCO3—、SO42—
C.NH4十、Mg2十、Br—、SO42— D.K十、Na+、S2—、SO3 2一
14.高温下,超氧化钾晶体呈立方体结构。晶体中氧的化合价可看作部分为0价,部分为-2价。下图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则下列说法正确的是
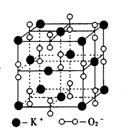
A.晶体中与每个K+距离最近的K+有12个
B.晶体中每个K+ 周围有8个O2—,每个O2-周围有8个K+
C.超氧化钾的化学式为KO2,每个晶胞含有14个K+和13个O2—
D.晶体中,0价氧原子与-2价氧原子的数目比可看作为3∶1
15.工业生产苯乙烯是利用乙苯的脱氢反应:
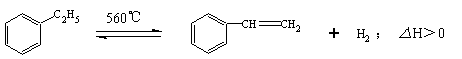
针对上述反应,有人提出如下观点,其中合理的是
A.在保持体积一定的条件下,充入较多的乙苯,可以提高乙苯的转化率
B.在保持压强一定的条件下,充入不参加反应的气体,有利于提高苯乙烯的产率
C.在加入乙苯至达到平衡的过程中,混合气体的平均相对分子质量在不断增大
D.仅从平衡移动的角度分析,工业生产苯乙烯选择恒压条件优于恒容条件
请将选择题答案填入下表:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 选项 |
第Ⅱ卷(非选择题 共90分)
三、(本题包括2小题,共22分)
16.(9分)请按要求填空
(1)测定硫酸铜晶体结晶水含量所用到的玻璃仪器有 ;
在硫酸铜晶体结晶水含量的测定实验中,若坩埚的质量为m,坩埚与硫酸铜晶体的质量为m1,加热后称量坩埚与无水硫酸铜的质量为m2,则晶体中结晶水的质量分数ω=____________________(写计算式)。
如果实验中加热温度过高,固体颜色变黑,则测定结果会____________(填“不变”、“偏高”、“偏低”)。
(2) 在做银镜反应实验之前试管洗涤步骤依次为:先用 洗、再用自来水洗、最后用蒸馏水洗;
在做过银镜反应实验之后试管洗涤步骤依次为:先用 洗、再用自来水洗、最后用蒸馏水洗;
17.(13分)下图所示装置进行有关实验,将A逐滴加入B中
![]()
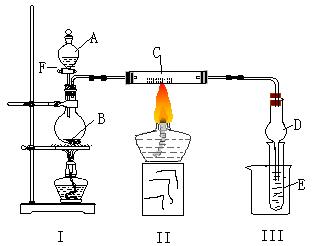
⑴若A是实验室的一种常用燃料,B是生石灰,实验中观察到C中黑色固体逐渐变红,当C中黑色固体大部分变红时,关闭F,然后往烧杯中加入热水,静止一会,观察到III中试管壁出现了光亮的银镜,则A是 ,C是 ,请写出反应管C中所发生的反应方程式: 。 试管E中所发生反应的离子方程式: 。
⑵若I处酒精灯不加热, B、C仍是实验(1)中原物质,实验中也观察到C中黑色固体逐渐变红,同时可观察到E中溶液先形成沉淀,然后沉淀溶解,并有一种无色无味的气体逸出,当溶液恰好澄清时,关闭F,然后往烧杯中加入热水,静止一会,观察到III中试管壁也出现了光亮的银镜,则A是 ,E中是 与葡萄糖的混合液(写化学式)。请写出反应管C中所发生反应的方程式: 。仪器D在此实验中的作用是 。
⑶若B为浓硫酸,E为苯酚钠溶液,C仍旧不变,A是只含一个碳的一种有机物也能发生银镜反应,实验中同样能观察到C中黑色固体逐渐变红,同时可观察到试管中溶液变浑浊,则A可能是 ,然后往烧杯中加入沸水,可观察到试管中的现象是 ,此实验中浓硫酸的作用是 。写出(1)中A和(3)中A二种物质在浓硫酸存在时所发生的反应方程式:
 ,此反应中浓硫酸的作用是
。
,此反应中浓硫酸的作用是
。
四、(本题包括3小题,共22分)
18.(8分)右图中A、B、C、D四条曲线是表示ⅣA、ⅤA、ⅥA、ⅦA族元素的气态氢化物的沸点变化曲线,其中A、D 分别表示____ __ 、__ _____族元素气态氢化物的沸点变化;同一族中第3、4、5周期元素的气态氢化物沸点依次升高,其原因是 ;图中第2周期有三种元素的气态氢化物沸点显著高于相应的同族第3周期元素气态氢化物的沸点,其原因是________________ ____ ___。
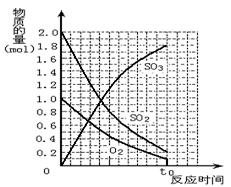
19.(6分)如图1,将2 mol SO2和1 mol O2混合置于体积可变的密闭容器中,在T1温度下发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g);△H<0。当反应进行到时间t0时达到平衡状态,测得混合气体的总物质的量为2.1 mol。试回答:
2SO3(g);△H<0。当反应进行到时间t0时达到平衡状态,测得混合气体的总物质的量为2.1 mol。试回答:
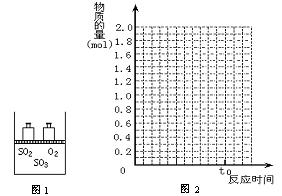
⑴在图2中作出反应混合物中各组分气体的物质的量随反应进行到t0时的变化曲线;
⑵当反应进行到t1时间时(t1>t0),给上述反应容器加热到温度为T2 (T2>T1),反应在t3 时间时(t3>t1)重新达到平衡状态,新平衡混合物中气体的总物质的量 ________2.1 mol(填“<”、“>”或“=”)。
⑶若起始时加入0.6 mol SO2、0.3 mol O2和x mol SO3,保持温度不变,达到平衡状态后,各气体的体积分数与上述平衡状态相同,x的值为__________。
20.(8分)有A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4Cl溶液、盐酸和Na2SO4溶液中的一种。
⑴已知A、B的溶液中水的电离程度相同,A、C溶液和pH相同。A是____________溶液,B是______________溶液,C是_______________溶液,D是_______________溶液。
⑵若B溶液中c(OH-)与C溶液中的c(H+)相同,现将B的溶液稀释10倍后溶液的pH值用pHB表示,C溶液的pH值用pHC表示,则pHB+pHC__________________(填大于或等于某个数)。
⑶A的溶液中各离子浓度大小的关系是(用不等号连接)
五、(本题包括2小题,共22分)
21.(10分)今有分子量为58的几种有机物,试写出符合条件的有机物的结构简式
⑴若该有机物为烃,则可能的结构简式为: 、 。
⑵若该有机物是一种饱和一元醛,则其结构简式为: 。
⑶若该有机物1mol能与足量银氨溶液作用可析出4molAg,则有机物的结构简式为: 。
⑷若该有机物能与金属钠反应,又能使溴的四氯化碳溶液褪色,则该有机可能是
。(注羟基连在双键上的有机物极不稳定)
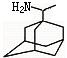 22.(12分)新华网北京06年3月16日电农业部防治高致病性禽流感工作新闻发言人贾幼陵16日说,广西南宁市和西藏拉萨市疫区已经解除封锁。“这标志着我国高致病性禽流感阻击战取得了阶段性成果。”金刚甲烷、金刚乙胺等已经批准用于临床治疗人类禽流感;金刚甲烷、金刚乙胺和达菲已经批准可用于预防人类禽流感。
22.(12分)新华网北京06年3月16日电农业部防治高致病性禽流感工作新闻发言人贾幼陵16日说,广西南宁市和西藏拉萨市疫区已经解除封锁。“这标志着我国高致病性禽流感阻击战取得了阶段性成果。”金刚甲烷、金刚乙胺等已经批准用于临床治疗人类禽流感;金刚甲烷、金刚乙胺和达菲已经批准可用于预防人类禽流感。
⑴金刚乙胺,又名α—甲基—1—金刚烷甲基胺,其化学结构简式如图所示,其分子式为:______ _____ 。
⑵金刚乙胺是金刚乙烷的衍生物,金刚乙烷有很多衍生物,它们可以相互衍变。下图就是它的部分衍生物相互衍变图。
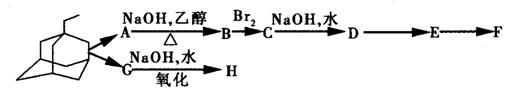
经检测发现,A和G的分子式都为C12H19Cl,E分子中有两个C=O键,但与新制氢氧化铜反应得不到红色沉淀;1mol F与足量的钠完全反应生成22.4L气体(标况下);H具有酸性,且分子式中只比F少1个O原子。据此回答下列问题:(可用“R”表示![]() )
)
①写出D、H的结构简式:D______ _____;H____ ______。
②写出C+D的化学方程式:__________ __________;
A→B、E→F的反应类型分别为:______ ____、_____ _____。
③F在一定条件下,可发生缩聚反应,形成高分子化合物I,试写出I的结构简式:
____ ____。
④金刚乙烷在一定条件下可发生氯取代,其一氯取代物有几种:________ __。
六、(本题包括2小题,共24分)
23.(10分)现有A、B两种链状饱和一元醇的混合物0.3 mol,其质量为13.8g。已知A和B碳原子数均不大于4,且A<B。
⑴混合物中A可能的分子式 ,B可能的分子式 、 。
⑵若n(A) ∶n(B)=1 ∶1时,B的名称是 、 。
⑶若n(A) ∶n(B)≠1 ∶1时,B的结构简式为 、 、
、 。
n(A) ∶n(B) = 。
24.(14分)Cu、Cu2O和CuO组成的混合物,加入100mL0.6 mo1.L-1HNO3溶液恰好使混合物溶解,同时收集到224mLNO气体(标准状况)。求:
⑴写出Cu2O跟稀硝酸反应的化学反应方程式 _。
⑵产物中硝酸铜的物质的量_____ _____mol。
⑶如混合物中含0.01moLCu,则其中Cu2O、CuO的物质的量分别是___ __mol、
___ ___mol。
⑷如混合物中Cu的物质的量为X,求其中Cu2O、Cu O的物质的量及X的取值范围:
、 、 。
高三市统考模拟测试答案
1.C 2.C 3.D 4.C 5.D 6.A
7.A 8.A 9.B 10.CD 11.AC 12.BC 13.C 14.AD 15.BD
16.(9分)(1)玻璃棒、干燥器、酒精灯、研钵(3分) ![]() ×100% (2分)偏高(2分)(2)NaOH溶液(1分) 稀HNO3溶液(1分)
×100% (2分)偏高(2分)(2)NaOH溶液(1分) 稀HNO3溶液(1分)
17.(13分)(1)乙醇 CuO CuO+CH3CH2OH → CH3CHO+Cu+H2O
CH3CHO + 2[Ag(NH3)2]+ + 2OH - →CH3COO- + NH4+ + 2Ag↓+ 3NH3 + H2O
(2)浓氨水 AgNO3 3CuO+2NH3→N2+3Cu+3H2O 防止倒吸。
(3)HCOOH 变澄清 脱水性 HCOOH+C2H5OH → HCOOC2H5+H2O
催化剂和吸水剂
 18.(4分)ⅥA ⅣA
18.(4分)ⅥA ⅣA
随着相对分子质量的增大,分子间作用力增大,
它们分子间存在氢键,分子间作用里增大(每空1分)
19.(8分)(1)(每条曲线1分)
(2)> (2分)
(3)大于零的任意值 (3分)
20.(8分)
(1)NH4Cl;CH3COONa;盐酸 ;Na2SO4 (4分)
(2)>13 (2分)
(3)c(Cl-)>c(NH4+)>c(H+)>c(OH-) (2分)
21.(8分,每小题2分)
(1)CH3CH2CH2CH3,CH3CH(CH3)2(2)CH3CH2CHO(3)OHC-CHO(4)CH2=CH-CH2OH
22.(10分)(1)C12H21N(2分) (2)①R-CHOH-CH2OH(2分)R-CH2COOH(2分)
②R-CHBr-CH2Br+2NaOH →2NaBr +R-CHOH-CH2OH (2分)消去反应 (1分)还原反应(1分)
![]()
![]() ③[OCHR-CO]
n (2分)④5种(1分)
③[OCHR-CO]
n (2分)④5种(1分)
23.(12分)(1)CH4O 1分;C3H8O或C4H10O各1分 (2) 1-丙醇或2-丙醇…各1分
(3)CH3CH2CH2CH2OH;CH3CH2CH(OH)CH3;CH3CH(CH3)CH2OH;CH3C(CH3)2OH;各1分;2 :1 1分
24.(12分) (1)3Cu2O+14HNO3=6Cu(NO3)2+2NO↑+7H2O(2分)
(2)0.025mol(2分); (3)0.005mo1 0.005mol(2分)
(4)(0.015-x)mol(2分) (x-0.005)mol(2分)0.005<X<0.015(2分)