高三化学下册第二次月考试卷
高 三 化 学
可能用到的原子量:H 1 Li 7 C 12 N 14 O 16 Na 23 Al 27 S 32 Cl 35.5
Fe 56 Cu 64 Zn 65 Br 80 Ag 108 I 127 Ce 140 Pb 207
一、单项选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意).
1.CCTV《科技博览》报道,2004年3月中科院首创用CO2合成可降解塑料聚二氧化碳。下列相关说法合理的是
A.聚二氧化碳塑料与干冰互为同素异形体
B.聚二氧化碳塑料是通过加聚反应制得的
C.聚二氧化碳塑料与干冰都属于纯净物
D.聚二氧化碳塑料的使用会产生白色污染
2.纤维素被称为第七营养素。食物中的纤维素虽然不能为人体直接提供能量,但能促进肠道蠕动,粘附并带出有害物质。从纤维素的化学成分看,它是一种
A.二糖 B.多糖 C.氨基酸 D.脂肪
3、下列每组各有三对物质,它们都能用分液漏斗分离的是
A、乙酸乙酯和水,酒精和水,苯酚和水 B、二溴乙烷和水,溴苯和水,硝基苯和苯
C、甘油和水,乙醛和水,乙酸和乙醇; D、油酸和水,甲苯和水,已烷和水。
4.化学实验中常将溶液或试剂进行酸化,下列酸化处理的措施正确的是
A.定性检验SO32-,将BaCl2溶液用于NHO3酸化
B.为提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液酸化
C.检验溶液中是否含有Fe2+时,用硝酸酸化
D.检验溶液中是否含有SO42-时,在无其他阳离子干扰的条件下,用盐酸酸化后加BaCl2溶液
5.背景材料:①“神舟六号” 的防护层由聚四氟乙烯和玻璃纤维布组合而成;②光化学烟雾是导致珠三角地区空气质量下降的重要原因;③近期,黄冈市举行“液氯泄漏”预警演习;④据湖北省环境质量监测所抽查显示,新装修住房甲醛含量7成超标。⑤在广东、香港海域,渤海湾均出现过大面积的赤潮。据此判断,下列说法正确的是
(1)“神舟六号” 的防护层是复合材料,四氟乙烯属于不饱和烃。
(2)光化学污染主要是由氮氧化物和碳氢化物引起的。
(3)发生“液氯泄漏”时,应疏导群众立即逆风向高处远离出事地点
(4)为降低甲醛含量,新装修住房应紧闭门窗,并放置一盆水
(5)赤潮是指在一定条件下海洋中某些生物短时间内大量繁殖或聚集,使海水变红色、褐色的现象
A.(1)(2)(3) B.(1)(2)(5) C.(2)(3)(5) D.(2)(4)(5)
6.将某溶液逐滴加入Fe(OH)3溶胶内,开始时产生沉淀,继续滴加时沉淀又溶解,该溶液是
A.2 mol·L-1H2SO4溶液 B.2 mol·L-1NaOH溶液
C.2 mol·L-1MgSO4溶液 D.硅酸溶胶
7.拟晶(quasicrystal)是一种具有凸多面体规则外形但不同于晶体的固态物质。Al65Cu23Fe12是2000年之前发现的几百种拟晶之一,具有合金的某些优良物理性能。有关这种拟晶的说法错误的是
A.Al65Cu23Fe12的硬度比金属Al、Cu、Fe都大
B.Al65Cu23Fe12中三种金属的化合价均可视作零
C.Al65Cu23Fe12不可用作长期浸泡在海水中的材料
D.1mol Al65Cu23Fe12溶于过量的硝酸时共失去265 mol电子
8.强酸和强碱稀溶液的中和热可表示为:H+(aq)+OH-(aq)=H2O(l),△H=–57.3kJ·mol-1已知:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l);△H1 , 1/2H2SO4(aq)+NaOH(aq)=1/2Na2SO4(aq)+H2O(l);△H2
HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(l);△H3 上述反应均为在溶液中的反应,则△H1、△H2、△H3的关系正确的是
A.△H1=△H2=△H3 B.△H2<△H1<△H3
C.△H2<△H3<△H1 D.△H2=△H3<△H1
二、不定项选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分。选两个且都正确的得满分,但只要选错一个该小题就为0分)
9.设NA为阿伏加德罗常数的值,下列叙述中正确的是
A.35.5g超氧化钾(KO2)所含的阴离子中电子数为8NA
B.标准状况下,11.2L氯仿中含有的C-Cl键的数目为1.5NA
C.常温常压下,92gNO2和N2O4混合气体中含有的原子数为6NA
D.工业电解精炼铜时电解池中每转移1mol电子阳极上溶解的铜原子数为0.5 NA
10.下列离子方程式正确的是
A.Ca(HCO3)2溶液中加入足量的Ba(OH)2溶液:
Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
B.将少量硝酸银溶液滴入氨水中:Ag++2NH3·H2O=[Ag(NH3)2]++2H2O
C.甲醛溶液中加入足量的银氨溶液并加热:
HCHO+2[Ag (NH3)2] ++2OH-![]() HCOO-+NH4++2Ag↓+3NH3+H2O
HCOO-+NH4++2Ag↓+3NH3+H2O
D.苯酚钠溶液中通入少量的CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3-
11.已知NaHSO3溶液和Na2CO3溶液混合后加热煮沸能产生CO2气体。现有浓度均为0.1mol/L的NaHSO3溶液和NaHCO3溶液,两溶液中各粒子物质的量浓度的关系一定正确的是(R表示S或C)
A.c(Na+)+c(H+)=c(HRO3-)+c(RO32-)+c(OH-)
B.c(H+)+c(H2RO3)=c(RO32-)+c(OH-)
C.c(Na+) >c(HRO3-) >c(H+) >c(OH-)>c(RO32-)
D.c(HRO3-)>c(H2RO3)>c(OH-)>c(RO32-)>c(H+)
12.粗盐中含有可溶性杂质CaCl2、MgCl2和Na2SO4,若要得到纯净的NaCl固体,有如下实验操作:①加入过量Ba(OH)2溶液、②加入过量NaOH溶液、③加入过量BaCl2溶液、④加入过量Na2CO3溶液、⑤加入过量盐酸、⑥过滤、⑦蒸发结晶。正确的实验操作顺序是
A.③②④⑥⑤⑦ B.③④②⑤⑦ C.②③④⑤⑥⑦ D.①④⑥⑤⑦
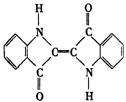 13.历史上最早使用的还原性染料是靛蓝,其结构式如右图,下列关于它的性质的叙述中错误的是
13.历史上最早使用的还原性染料是靛蓝,其结构式如右图,下列关于它的性质的叙述中错误的是
A.它的苯环上的一氯取代物有4种
B.它的分子式是C16H10N2O2
C.它是高分子化合物
D.它可使溴水褪色
14.11、某溶液中加入过量盐酸产生沉淀,滤液中再通入硫化氢又产生沉淀,不符合此现象的组是:
A.Hg2+、Al3+、Ba2+、Na+ B.Ag+、Fe3+、Mg2+、Cs+
C.Ag+、Cu2+、Rb+、NH4+ D.Fe2+、Ca2+、Li+、K+
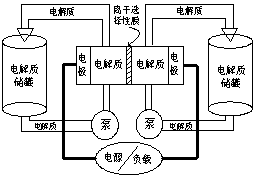 15.下图是一种正在投入生产的大型蓄电系统。左右两侧为电解质储罐,中央为电池,电解质通过泵不断在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过;放电前,被膜隔开的电解质为Na2S2(右罐)和NaBr3(左罐),放电后,分别变为Na2S4和NaBr。下列说法正确的是
15.下图是一种正在投入生产的大型蓄电系统。左右两侧为电解质储罐,中央为电池,电解质通过泵不断在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过;放电前,被膜隔开的电解质为Na2S2(右罐)和NaBr3(左罐),放电后,分别变为Na2S4和NaBr。下列说法正确的是
A.电池充电时阳极电极反应式为:3Br--2e-=Br3-
B.电池放电时,负极电极反应式为:2S22-+2e-=S42-
C.电池放电时,电池的总反应方程式为:Na2S4+3NaBr=2Na2S2+NaBr3
D.在充电过程中Na+通过膜的流向为从左到右
16.在恒温恒容的密闭容器中,发生反应3A(g)+B(g)![]() xC(g)。
xC(g)。
Ⅰ、将3molA和2molB在一定条件下反应,达平衡时C的体积分数为a;
Ⅱ、若起始时A、B、C投入的物质的量分别为n(A)、n(B)、n(C),平衡时C的体积分数也为a。
下列说法正确的是
A.若Ⅰ达平衡时,A、B、C各增加1mol,则B的转化率将一定增大
B.若向Ⅰ平衡体系中再加入3molA和2molB,C的体积分数若大于a,可断定x>4
C.若x=2,则Ⅱ体系起始物质的量应当满足3 n(B)=n(A)+3
D.若Ⅱ体系起始物质的量当满足3 n(C) +8n(A)=12 n(B)时,可断定x=4
二、不定项选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个该小题就为0分)
三、(本题包括2小题,共22分)
17.高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。
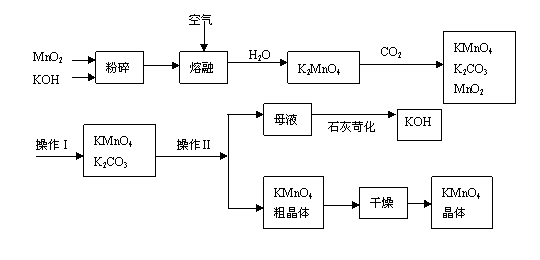

(1)KMnO4稀溶液是一种常用的消毒剂。其消毒机理与下列物质相同的是______(填代号)。
a. 84消毒液(NaClO溶液) b. 双氧水 c. 苯酚 d. 75%酒精
(2)上述流程中可以循环使用的物质有______________、______________(写化学式)。
(3)若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得__________mol KMnO4。
(4)该生产中需要纯净的CO2气体。若实验室要制备纯净的CO2所需试剂最好选择___________(选填代号)。
a. 石灰石 b. 稀HCl c. 稀H2SO4 d. 纯碱
所需气体发生装置是_____________(选填代号)。
(5)操作Ⅰ的名称是_____________;操作Ⅱ是根据KMnO4和K2CO3两物质在__________(填性质)上差异,采用____________(填操作步骤)、趁热过滤得到KMnO4粗晶体的。
18..用Na2SO3和硫粉在水溶液中加热反应可以制得Na2S2O3。10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60g和212g,常温下,从溶液中析出晶体是Na2S2O3·5H2O 。Na2S2O3在酸性溶液中立即完全分解:Na2S2O3+2HCl = S↓+ SO2↑+H2O + 2NaCl。现取15.1g Na2SO3溶于80mL水,另取5.00g硫粉,用少量乙醇润湿后(以便硫能被水浸润),加到上述溶液中,用小火加热至微沸。反应约为1h后过滤,滤液在100℃经蒸发、浓缩、冷却至10℃后析出Na2S2O3·5H2O晶体。
(1)若加入的硫粉不用乙醇润湿,对反应的影响是
A.会降低反应速度 B.需要提反应温度
C.将增大体系的pH D.会减少产量
(2)反应1h后过滤,其目的是 。
(3)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是 。它是由 而产生。
(4)设Na2SO3与S完全反应,当将滤液蒸发浓缩后,冷却至70℃,溶液的体积约30 mL。该溶液是否达到饱和?试通过计算说明(70℃时Na2S2O3饱和溶液的密度为1.17 g·cm-3)。
(5)若要计算在100℃下将溶液蒸发至体积为30mL,再冷却至10℃时所得到的Na2S2O3·5H2O的质量,你认为
A.前面提供的数据已足够
B.还要提供100℃时溶液的密度为1。14g·cm-3
C.还需要提供结晶后剩余溶液的体积
(6)根据第(5)小题你选择(如选A则直接计算,如选B或C则可选用其数据),计算从10℃、30mL溶液中结晶而出的 Na2S2O3·5H2O的质量。
四、(本题包括2小题,共18分)
19.A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A、C及B、D分别是同一主族元素,B、D元素的原子核中质子数之和是A、C两元素原子核中质子数之和的两倍,又知四种元素的单质中有两种气体、两种固体。请回答:
⑴C、D组成的常见化合物,其水溶液呈碱性,原因是 ____________(用离子方程式表示)。写出两种均含A、B、C、D四种元素的化合物相互间发生反应,且生成气体的离子方程式 ___________。
⑵D的单质能跟C的最高价氧化物水化物的浓溶液发生氧化还原反应,生成的两种正盐的水溶液均呈碱性,写出该氧化还原反应的离子方程式:
_ ________________________。
⑶A、B、D间可形成甲、乙两种微粒,它们均为负一价双原子阴离子且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为 。
 20右图是元素R的单质及其重要化合物在一定条件下相互转化的关系图(生成物中不含该元素的物质均已略去)
20右图是元素R的单质及其重要化合物在一定条件下相互转化的关系图(生成物中不含该元素的物质均已略去)
已知,F可用作化肥也可用来作炸药,G可用于建筑工程上的抗冻剂和防腐剂。据此回答下列问题。
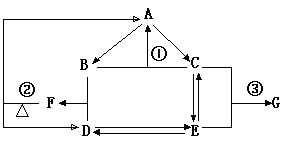
(1)写出反应①的化学方程式 并指出该反应在现代工业上的重要意义:
(2)物质B的分子空间构型为
(3)已知反应②是氧化还原反应,其氧化产物与还原产物的质量比为
(4)写出反应③的离子方程式
五、(本题包括1小题,共10分)
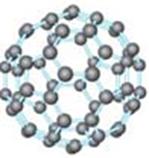
21.21世纪80年代日本科学家应用电子计算机模拟出结构类似于
C60(分子结构如右图所示)的物质N60,计算机模拟结果显示,
N60与C60有相似的结构但稳定性较差。科学家预测,将
N2进行冷冻或加压,然后运用高强度激光照射能转变为N60分子团,
该分子团具有极强的挥发性,在受热情况下瞬间分解为N2并释放出大量的能量。
已知E(N-N)=167kJ·mol-1,E(N=N)=418kJ·mol-1,E(N≡N)=942kJ·mol-1。(E表示键能,即打开1mol气态化学键所需要的能量)
回答下列问题:
⑴ N60分子中每个N原子最外层有 个电子;
⑵ N60稳定性较差的原因可能是 ;
⑶ 1molN60受热分解为N2时放出的热量为 ;
(4)N60潜在的商业用途可能是
六、(本题包括2小题,共18分)
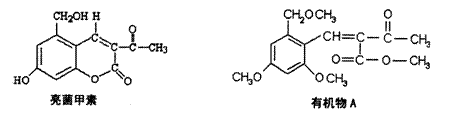
22利胆解痉药“亮菌甲素”跟(CH3)2SO4反应生成A。二者的结构简式如图。
 |
试回答:
(1)“亮菌甲素”的分子式为 ,1mol“亮菌甲素”跟浓溴水反应时最多消耗 mol Br2;A不能发生的化学反应有 。
(2)有机物A能发生如下转化。
提示:
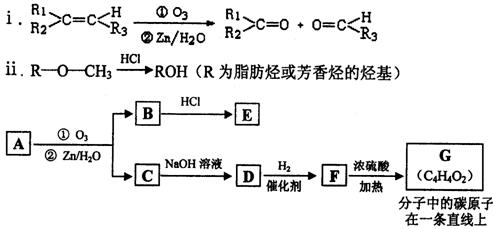
①C→D的化学方程式为 。
②1 mol G跟1 mol H2在一定条件下反应,生在物的结构简式为 。
③符合下列条件的E的同分异构体有 种,写出其中任意一种的结构简式。
a.遇FeCl3溶液呈紫色
b.不能发生水解反应,能发生银镜反应
c.苯环上的一氯取代物只有一种,分子中无甲基
23一种链状单烯烃A通过臭氧氧化并经锌和水处理得到B和C。化合物B含碳69.8%,含氢11.6%,B无银镜反应。D在浓硫酸存在下加热,可得到能使溴水褪色且只有一种结构的物质E。G的分子式为C7H14O2。有关转化关系如下;
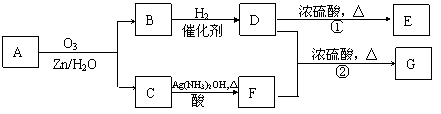 |
(1)B的相对分子质量是__________________。
(2)写出结构简式:A__________________、E_______________________。
(3)写出反应①、②的反应类型:①________________、②_______________。
(4)写出反应②的化学方程式:__________________________________________。
(5)F的一种同分异构体能发生酯化反应和银镜反应,写出该物质银镜反应的化学方程式:
七、(本题包括2小题,共18分)
24蓄电池是一种可以反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应是:NiO2+Fe+2H2O![]() Fe(OH)2+Ni(OH)2
Fe(OH)2+Ni(OH)2
(1) 若此蓄电池放电时,该电池某一电极发生还原反应的物质是 (填序号)。
A.NiO2 B.Fe C.Fe(OH)2 D.Ni(OH)2
(2) 假如用此蓄电池分别用来电解以下两种溶液,工作一段时间后都分别消耗0.36g水,且电解池的电极均为惰性电极,试回答下列问题。
①电解M(NO3)x溶液时某一极增加了ag M,则金属M的相对原子质量的计算式为
(用“a、x表示)。
②电解含有0.01molCuSO4和0.0lmolNaCl的混合溶液l00mL,阳极产生标准状况气体 L;将电解后溶液加水稀释至1 L,此时溶液的pH=
25(9分)某研究性学习小组对铝热反应实验展开研究。现行高中化学教材(必修加选修)中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | - |
I.⑴某同学根据数据推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的推测是否合理?答:_________________(填“合理”或“不合理)
⑵设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是_______________。
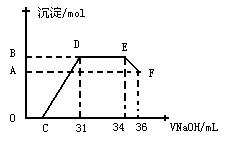 II.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
II.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
⑴图中OC段没有沉淀生成,此阶段
发生反应的离子方程式为 。
⑵在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为 ;
⑶B与A的差值为 mol。
⑷B点对应沉淀的物质的量为 mol,C点对应的氢氧化钠溶液的体积为 mL