高三化学下册第四次月考试卷
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,全卷满分108分。
考试时间90分钟。
可能用到的相对原子质量:H 1 C 12 Ne 20 O 16 Na 23 Al 27 S 32 Cl 35.5
第Ⅰ卷(选择题 共48分)
一, 选择题(每题只有1个正确答案,每小题3分,共计48分)
1. 1999年新发现的一种元素的同位素,其质量数为298,原子核外电子数为114。该同位素原子的中子数为
A.70 B.114 C.184 D.298
2. 设阿佛加德罗常数的的值为NA,下列叙述正确的是
A. 1molD2O所含质子数为12 NA
B.10g氖气所含原子数为NA
C.7.1 g氯气与足量NaOH溶液反应/转移的电子数为0.1 NA
D.标准状况下,1L水所含分子数为1/22.4 NA
3.下列化合物中阴离子半径和阳离子半径之比最小的是
A.LiI B. CsF C.KCl D. NaBr
4.氯气通入含有下列离子的溶液中不会与氯气反应的离子是
A.OH- B.S2- C.SO32- D.H+
5.测量气体在标准状况下的密度是确定未知物质的相对分子质量常用的方法。在标准状况下,100 mL某气体的质量为0.125 g,则该气体的相对分子质量是
A.14 B.28 C.42 D.36
6.体积相同的两个容器中,一个盛有N2O、另一个盛有C3H8,在同温同压下两容器内的气体一定不相同的是
A.原子数 B.分子数 C.质量 D.密度
7. 下列分子的电子式书写正确的是
A
氨 ![]() B 四氯化碳
B 四氯化碳 ![]()
C 氮 ![]() D 二氧化碳
D 二氧化碳 ![]()
8.用惰性电极实现电解,下列说法正确的是
A 电解稀硫酸溶液,实质上是电解水,故溶液pH不变
B 电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小
C 电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1:2
D 电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1:1
9.两份质量都是Ng的硫粉,分别与足量的氢气、氧气完全反应,混合反应后的生成物,使之充分反应,可析出硫的质量是(单位:g)
A.2N B.1.5N C.N D.0.5N
10.能正确表示下列反应离子方程式的是
A. 用氨水吸收少量二氧化硫:NH3·H2O+SO2=NH![]() +HSO
+HSO![]()
B. 金属铝溶于氢氧化钠溶液:Al+2OH-=AlO![]() +H2
+H2
C. 氯气通入水中:Cl2+H2O=2H++Cl-+ClO-
D. 次氯酸钙溶液中通入少量CO2:Ca2++2ClO-+H2O+CO2=CaCO3↓+2 HClO
11.某溶液既能溶解AI(OH)3,又能溶解H2SiO3,在该溶液中可以大量共存的离子组是
A.Na+、SO42-、Cl-、ClO- B.K+、Na+、HCO3-、NO3-
C.H+、Mg2+、SO42-、NO3- D.Ag+、K+、NO3- 、Na
12.已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是
A.H2O(g)=H2(g)+1/2O2(g) ΔH= +242kJ·mol-1
B.2H2(g)+O2(g)=2H2O(l) ΔH= -484kJ·mol-1
C.H2(g)+1/2O2(g)=H2O(g) ΔH= +242kJ·mol-1
D.2H2(g)+O2(g)=2H2O(g) ΔH= + 484kJ·mol-1
13.A、B、C、D四种短周期元素的原子半径依次减小,A与C的核电荷数之比为3∶4,D能分别与A、B、C形成电子总数相等的分子X、Y、Z。下列叙述正确的是
A.X、Y、Z的稳定性逐渐减弱
B.X、Y、Z三种化合物的熔沸点逐渐升高
C.A与C可形成离子化合物
D.A、B、C、D只能形成5种单质
14.下列能用来证明SO2有氧化性的实验是
A.SO2通入品红溶液中 B.SO2通入KMnO4溶液中
C.SO2通入NaOH溶液中 D.SO2通入氢硫酸溶液中
15.某Al2(SO4)3溶液Vml中含有a克Al3+,取出V/10ml,将其稀释成Vml后,溶液中的SO42-的物质的量浓度为
A.50a/(9V) mol/L B.500a/(9V) mol/L
C.100a/(9V) mol/L D.5a/(9V) mol/L
16.在一定条件下,使CO和O2的混合气体26 g充分反应,所得混合物在适当温度下跟足量的Na2O2固体反应,结果固体增重14 g,则原混合气体中O2和CO的质量比可能是( )
①4︰9 ②6︰7 ③1︰1 ④7︰6
A.①② B.①③ C.③④ D.②④
第I卷答题栏
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | C | C | B | D | B | A | C | D | B | D | A | A | B | D | A | A |
第Ⅱ卷(非选择题 共60分)
二.(本题共38分)
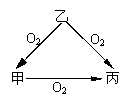 17(5分). 常温下某种淡黄色固体甲,与它的气态氢化物乙和氧化物丙之间有如图的转化关系。试回答下列问题:
17(5分). 常温下某种淡黄色固体甲,与它的气态氢化物乙和氧化物丙之间有如图的转化关系。试回答下列问题:
(1)甲是_ S____,乙是_H2S_______,丙是__SO2____。
(2)乙和丙发生反应时,无论乙和丙的物质的量之比如何,反应
得到的氧化产物与还原产物的质量比都是 2:1 。
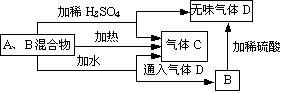
18(12分).用A、B两种常见化合物组成的混合物,其焰色反应均
为黄色,其相互关系如图(其他物质均略去)。
|
![]()
![]() 已知:2B E+D+H2O. 根据上图关系,回答下列问题:
已知:2B E+D+H2O. 根据上图关系,回答下列问题:
(1)写出A、B、C、D的化学式:A__Na2O2___,B__NaHCO3___,C_O2____,D_CO2___。
(2)写出A与水反应的化学方程式:__2Na2O2+2H2O==4NaOH+O2___。
(3)加热后,若只得到一种固态化合物,则A与B的物质的量之比的最大值为_39/84__。
19(11分)。下表是元素周期表的一部分,回答下列有关问题:
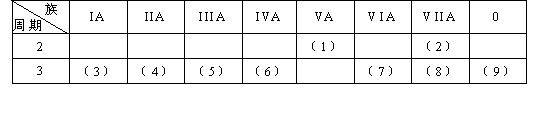
1在这些元素中,最活泼的金属元素是(写元素符号,下同)__Na _,最活泼的非金属元素是__F__,最不活泼的元素是__Ar__。
2在这些元素的最高价氧化物对应水化物中,酸性最强的是_HClO4__,碱性最强的是__NaOH_,呈两性的氢氧化物是_Al(OH)3__,写出三者之间相互反应的化学方程式__ Al(OH)3+_3HClO4===_Al(ClO4)3_+3H2O___, Al(OH)3+NaOH===NaAlO2+2H2O .
3在这些元素中,原子半径最大的是_Na__,原子半径最小的是__F__。
4在(3)与(4)中,化学性质较活泼的是__Na__.
20(10分)。A、B、C、D四种短周期元素,原子序数依次增大,离子半径依次减小,A与C可形成原子个数比分别为1∶1和1∶2的两种离子化合物,A与D的原子序数之和等于B与C的原子序数之和,请回答下列问题:
(1)写出元素符号:B_F____,D__Mg____。
(2)A、C形成的离子化合物与CO2发生氧化还原反应的化学方程式
_ _2Na2O2_+2 CO2===2Na2CO3+O2 __。
![]() (3)1 mol C的氢氧化物与1 mol B单质在一定条件下恰好完全反应,生成一种盐、水及一种气体,写出该反应的化学方程式__2F2+2NaOH===2NaF+OF2 +H2O_____。
(3)1 mol C的氢氧化物与1 mol B单质在一定条件下恰好完全反应,生成一种盐、水及一种气体,写出该反应的化学方程式__2F2+2NaOH===2NaF+OF2 +H2O_____。
(4)B、C形成的化合物的电子式为___![]() _____。
_____。
三.(本题共22分)
21(10分).实验室配制500mL0.1mol/L Na2CO3溶液,回答下列问题:
(1)应用托盘天平称取十水碳酸钠晶体 14.3 g
(2)用托盘天天和小烧杯称出碳酸钠晶体的质量,其正确操作顺序的标号为 BADCFEB (同一步骤可用多次)
A.调整零点 B.将游码移至刻度尺的零刻度处 C.将碳酸钠晶体放入小烧杯中称量 D.称量空的小烧杯 E.将砝码放回砝码盒内 F.记录称量的结果
(3)配制Na2CO3溶液时需用的主要仪器有托盘天平、滤纸、烧杯、药匙、 玻棒 ,
500ml容量瓶 , 胶头滴管 。
(4)若实验遇到下列情况,溶液的浓度是偏高,偏低还是不变?
A加水时超过刻度线 偏低 , B忘记将洗涤液加入容量瓶 偏低 ,
C 容量瓶内壁附有水珠而未干燥处理 不变 。
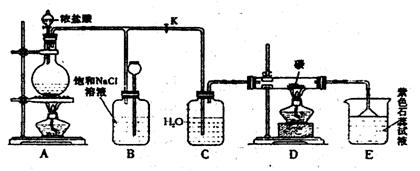 |
![]()
![]() (1)A为氯气发生装置,写出反应的化学方程式__MnO2+4HCl
MnCl2+Cl2 +2H2O__。
(1)A为氯气发生装置,写出反应的化学方程式__MnO2+4HCl
MnCl2+Cl2 +2H2O__。
![]() (2)实验开始先点燃A处的酒精灯,打开旋 塞K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C瓶后进入D,D装置内盛有碳粉,发生氧化还原反应,生成CO2和HCl,写出D装置中反应的化学方程式__2Cl2+2H2O+C CO2+4HCl___;装置C的作用是
(2)实验开始先点燃A处的酒精灯,打开旋 塞K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C瓶后进入D,D装置内盛有碳粉,发生氧化还原反应,生成CO2和HCl,写出D装置中反应的化学方程式__2Cl2+2H2O+C CO2+4HCl___;装置C的作用是
_ 提供水蒸气___。
(3)E处石蕊试液的现象是___溶液变红___。
(4)D处反应完毕后,关闭旋塞K,移去酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是___分液漏斗下端液面上升____。
(5)若要在标准状况下制取11.2L氯气,至少需要12mol/L的盐酸 167ml ml。