高三联合体化学综合练习(二)
 [ ]1.2006年6月5日是第35个世界环境日,我国环保总局确定的主题见右图。下列措施不符合这一主题的是
[ ]1.2006年6月5日是第35个世界环境日,我国环保总局确定的主题见右图。下列措施不符合这一主题的是
A.用“绿色化学”工艺,使原料尽可能转化为所需要的物质
B.回收废电池,减少对环境的污染
C.为使农作物高产,大量施用化肥和农药
D.推广垃圾分类存放,分类回收,分类处理
[ ]2.下列实验操作中,先后顺序正确的是
A.稀释浓硫酸时,先在烧杯中加入一定体积的浓硫酸,后注入蒸馏水
B.为测定硫酸铜晶体的结晶水含量,称样时,先称取一定量的晶体,后放入坩埚
C.为检验酸性溶液中的Cl-和SO42-,先加硝酸银溶液,滤去沉淀后再加入硝酸钡溶液
D.在制取干燥纯净的氯气时,先使氯气通过水(或饱和食盐水),后通过浓硫酸
[ ]3.下列离子方程式正确的是
A.碳酸钙溶于醋酸:CaCO3 + 2H+ =Ca2+ + CO2↑+ H2O
B.F2与NaOH溶液反应:F2 + 4OH-=2F- + O2 + 2H2O
C.往NaHSO4溶液中逐滴滴入Ba(OH)2溶液至恰好呈中性:Ba2+ + 2OH- + SO42- + 2H+=BaSO4↓ + 2H2O
D. 氯化铝溶液中加入过量氨水:Al3+ + 4NH3•H2O = AlO2- + 4NH4+ + 2H2O
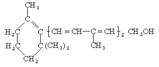 [ ]4.已知维生素A的结构式为关于它的下列叙述中, 正确的是
[ ]4.已知维生素A的结构式为关于它的下列叙述中, 正确的是
①维生素A与乙醇具有相同的官能团,是一种醇,
②1mol维生素A在催化剂作用下, 可以和5mol氢气完全加成,
③维生素A分子中含有苯环结构, ④维生A的分子式为C20H30O,
A. ①③④ B. 全部 C. ①②④ D. ②③
[ ]5.甲、乙两种非金属:①甲比乙容易与H2化合;②甲单质能与乙的阴离子发生置换反应;③甲的最高价氧化物对应水化物的酸性比乙的最高价氧化物对应的水化物的酸性强;④与某金属反应时,甲原子得电子数目比乙的多;⑤甲的单质熔、沸点比乙的低。能说明甲比乙的非金属性强的是
A.只有④ B.只有⑤ C.①②③ D.①②③④⑤
[ ]6.已知H2O2的分子空间结构可在二面角中表示,如图所示:则有关H2O2结构的说法中正确的是
![]() A.分子的正、负电荷重心重合
B.分子中各原子在同一条直线上
A.分子的正、负电荷重心重合
B.分子中各原子在同一条直线上
C.H2O2是极性分子 D.H2O2是非极性分子
[ ]7.用NA表示阿伏加德罗常数,下列叙述中正确的是
A.12 g金刚石晶体中含有碳碳键的数目为4NA
B.常温常压下46 g N2O4和NO2的混合气体含有的原子总数为3NA
C.标准状况下.22.4 L CH3CHO能与NA个氢分子加成 D.SiO2晶体中,有NA个Si就有2 NA个Si-O键
[ ]8.共价键断裂有均裂和异裂两种方式,均裂:A:B→A·+B·,异裂:A:B→A++[∶B]-。下列化学反应中发生共价键均裂的是
A.2K+2H2O=2KOH+H2↑ B.2Na+2C2H5OH=2C2H5ONa+H2↑
C.Na2CO3+H2O=NaHCO3+NaOH D.CH3COOH+C2H5OH→CH3COOC2H5+H2O
[ ]9.向碳酸钠溶液中加入氢氧化钙(固体)至CO32-沉淀完全后,过滤测得滤液的总质量比原NaCO3溶液减少0.13g。若将反应后的溶液稀释至1L,所得溶液的PH值为
A.14 B.13 C.12 D.10
[ ]10.用NA表示阿伏加德罗常数,下列说法正确的是:
①18g D2O含有的电子数为10NA ②同温、同压下,相同体积的氟气和氩气所含的原子数相等 ③标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA ④标准状况下 22.4L NO2气体中的分子数为NA⑤1mol Na2O2与水完全反应时转移电子数为2NA⑥12克石墨含C-C键1.5NA
A.③⑤⑥ B.③⑥ C.①②④⑤ D.③④⑥
[ ]11.下列说法正确的是
A.pH=2的一元酸A和一元酸B,分别加入足量的镁粉,放出H2前者多,则A一定为弱酸,B可能为强酸
B.Li、Na、Mg、Al四种金属中的任三种混合,若1mol混合物与足量盐酸反应可放出1molH2,则其可能的组合只有二种:Li、Mg、Al的混合物或Na、Mg、Al的混合物
C.Fe和浓HNO3反应,若还原产物只有NO2生成,则溶液中的盐只有Fe(NO3)3
D.任意金属阳离子M m+和N n +,若氧化性M m+强于N n+,则金属性M弱于N
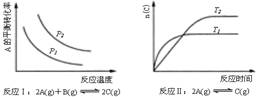
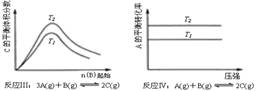 [ ]12.某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):
[ ]12.某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):
根据以上规律判断,上列结论正确的是
A.反应Ⅰ:△H>0,P2>P1 B.反应Ⅱ:△H<0,T1<T2
C.反应Ⅲ:△H>0,T2>T1;或△H<0,T2<T1 D.反应Ⅳ:△H<0,T2>T1
[ ]13.已知Al和Ga是同族元素,且都是两性元素,并知Al(OH)3的碱性比Ga(OH)3大。若将等物质的量的Al和Ga溶于NaOH溶液中,然后再通入CO2,则
A.Ga(OH)3先沉淀 B.Al(OH)3和Ga(OH)3同时沉淀
C.Al(OH)3先沉淀 D.无法判断两种沉淀的先后顺序
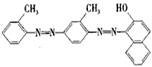 [ ]14.化学工作者一直关注食品安全,发现有人将工业染料“苏丹红1号”非法用作食用色素。苏丹红是一系列人工合成染料,其中“苏丹红4号”的结构式如下:下列关于“苏丹红4号”说法正确的是
[ ]14.化学工作者一直关注食品安全,发现有人将工业染料“苏丹红1号”非法用作食用色素。苏丹红是一系列人工合成染料,其中“苏丹红4号”的结构式如下:下列关于“苏丹红4号”说法正确的是
A. 不能发生加成反应 B. 属于芳香烃
C. 可以使酸性高锰酸钾溶液褪色 D. 属于甲苯同系物
[ ]15.硫代硫酸钠可作为脱氯剂,已知25.0mL0.100mol·L-1Na2S2O3溶液恰好把224mL(标准状况下)Cl2完全转化为Cl-离子,则S2O32-将转化成
A.S2- B.S C.SO32- D.SO42-
[ ]16.某研究性学习小组为了探索镁粉与FeCl3溶液的反应机理,做了如下两组实验:①将镁粉投入冷水中,未见明显现象;②将镁粉投入FeCl3y溶液中,观察到有气泡产生,溶液颜色逐渐变浅,同时逐渐产生红褐色沉淀。则下列有关镁与FeCl3溶液反应的叙述中,正确的是
A.镁只与FeCl3溶液中的Fe3+直接反应 B.气泡是镁与FeCl3溶液中的水直接反应产生的
C.红褐色沉淀是镁与水反应生成的Mg(OH)2与Fe3+反应所得
D.气泡是镁与FeCl3水解生成的盐酸反应产生的
[ ]17.磁流体是电子材料的新秀,它既具有同体的磁性,又具有液体的流动性。制备时将含等物质的量的FeSO4和Fe2(SO4)3的溶液混合,再滴入稍过量的氢氧化钠溶液,随后加入油酸钠溶液,即可生成黑色的、分散质粒子的直径在5.5nm~36nm的磁流体。下列说法中正确的是
A.所得的分散系属于悬浊液 B.所得的分散系中的分散质为Fe2O3
C.给分散系通电时阳极周围黑色加深 D.该分散系能产生丁达尔效应
[ ]18.下面二维平面晶体所表示的化学式为AX3的是
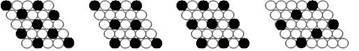
A. B. C. D.
[ ]19.将pH=3的盐酸溶液和pH=11的氨水等体积混合后,溶液中离子浓度关系正确的是
A.c(NH4+)>c(Cl-)>c(H+)>c(OH-) B.c(NH4+)>c(Cl-)> c(OH-)>c(H+)
C.c(Cl-)>c(NH4+)>c(H+)>c(OH-) D.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
[ ]20.将相同物质的量浓度的某弱酸HX溶液与NaX溶液等体积混合,测得混合溶液中c(Na+)>c(X-),则下列关系错误的是
A.c(OH-)>c(H+) B.c(HX)<c(X-)
C.c(X-)+c(HX)==2c(Na+) D.c(HX)+c(H+)==c(Na+)+c(OH-)
[ ]21.一元酸HA溶液中,加入一定量强碱MOH溶液后,恰好完全反应,反应后的溶液中,下列判断正确的是
A.c(A-)≥c(M+) B.c(A-)≤c(M+)
C.若MA不水解,则c(OH-)<c(H+) D.若MA水解,则c(OH-)≥c(H+)
[ ]22.将pH值为8的NaOH溶液与pH值为10的 NaOH溶液等体积混和后,溶液中的氢离子浓度(mol·L-1)最接近于
A.1/2(10-8+10-10) B.(10-8+10-10) C.(1×10-14-5×10-5) D.2×10-10
23.用于分离或提纯物质的方法有:A.蒸馏(分馏) B.盐析C.过滤 D.重结晶 E.升华 F.渗析 G.加热分解 。下列各组混合物的分离或提纯应选用上述哪一种方法最合适?(把选用的方法的标号填入括号内) (1)除去Ca(OH)2溶液中悬浮的CaCO3微粒( ) (2)除去Fe(OH)3胶体中混有的Cl-离子( ) (3)除去乙醇中的少量水( ) (4)除去氧化钙中的碳酸钙( )(5)除去固体碘中混有的砂子 ( )
24.用实验确定某酸HB的弱电解质。两同学的方案是:
甲:①称取一定质量的HB配制0.1mol/L的溶液100mL;
②用pH试纸测出该溶液的pH值,即可证明HB是弱电解质。
乙:①用已知物质的量浓度的HB溶液、盐酸,分别配制pH = 1的两种酸溶液各100mL;
②分别取这两种溶液各10mL,加水稀释为100mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HB是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是
(2)甲方案中,说明HB是弱电解质的理由是测得溶液的pH 1(选填>、<、=)
乙方案中,说明HB是弱电解质的现象是
A.HCl溶液的试管中放出H2的速率快; B.装HB溶液的试管中放出H2的速率快;
C.两个试管中产生气体速率一样快。
(3)请你评价:乙方案中两个难以实现之处
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表达
25.配平下列化学方程式,将化学计量数填入空格内并回答有关的问题:
⑴白磷也可与热的CuSO4溶液反应,其化学方程式为:
[ 1 1 ]P+[ 15 ]CuSO4+[ 2 4 ]H2O===[ 5 ]Cu3P+[ 6 ]H3PO4+[ 15 ]H2SO4
其中氧化剂是 ,若有1molCuSO4参加反应,则它氧化的P的物质的量是 。
⑵配平下列反应的离子方程式:
[ 2 ]Fe(OH)3+[5- n]ClO-+[2n ]OH-===[ 2 ]FeO4n-+[5- n]Cl-+[n+ 3]H2O
已知有3.21g Fe(OH)3参加反应,其转移了5.4×1022个电子,则n= ,FeO4n-中铁的化合价为 +6 ,根据上述情况推测, FeO4n-能和下列 B、C 物质反应(只填序号):
A. KMnO4 B. SO2 C. H2S D. O2
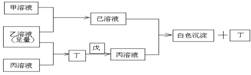 26.有常见A、B、C三种短周期元素,它们的原子序数逐渐增大,B元素原子最外层电子数是C元素原子最外层电子数的一半,A元素最外层电子数比B多一个。甲、乙、丙是3种含氧酸的钠盐,甲中含B元素,乙中含C元素,丙中含A元素,甲、丙溶液pH>7,乙溶液pH<7;丁为气体,戊为淡黄色固体。甲、乙、丙、丁、戊、己六种物质之间的相互反应关系如下图:请回答:
26.有常见A、B、C三种短周期元素,它们的原子序数逐渐增大,B元素原子最外层电子数是C元素原子最外层电子数的一半,A元素最外层电子数比B多一个。甲、乙、丙是3种含氧酸的钠盐,甲中含B元素,乙中含C元素,丙中含A元素,甲、丙溶液pH>7,乙溶液pH<7;丁为气体,戊为淡黄色固体。甲、乙、丙、丁、戊、己六种物质之间的相互反应关系如下图:请回答:
(1)写出C元素的原子结构示意图_______________,写电子式:丁 戊
(2)用有关化学用语解释:
乙溶液呈酸性的原因 ;
丙溶液呈碱性的原因 ;
(3)写出有关反应的离子方程式:
①乙溶液+丙溶液→丁 ;
②己溶液+丙溶液→丁 。
27.下图中,A为气体非金属单质,D是空气中含量最多的气体,B、E、Z为无色氢化物,其中B、E为有刺激性气味的气体,C是由三种短周期非金属元素组成的离子化合物,F、I、L为白色沉淀,其中F不溶于稀硝酸,N、P是金属单质;反应②在E的浓溶液中进行,反应⑦在E的稀溶液中进行,反应②、⑦均可用于实验室制取某种气体(图中部分反应物和生成物没有列出)。
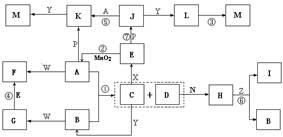 请按要求回答:
请按要求回答:
⑴写出C的电子式 ,I的化学式 ;
⑵反应③的化学方程式
⑶反应④的离子方程式为
⑷由C制取E时反应物的状态是 ,由J制取L时反应的环境是 。
28.已知:①![]()
![]()
![]()
②![]()
分子量:![]() 分子量:
分子量:![]()
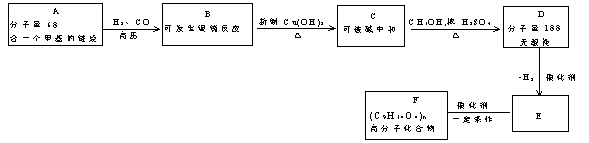
(1)写出化合物A、E、F的结构简式:
A ;E ;F 。
(2)写出B与足量![]() 悬浊液反应的化学方程式:
悬浊液反应的化学方程式:
29.有一瓶溶液只含Cl-、![]() 、
、![]() 、Na+、
、Na+、![]() 、K+、Mg2+ 七种离子中的某几种。经实验:
、K+、Mg2+ 七种离子中的某几种。经实验:
(1)
原溶液 ![]() 白色沉淀;
白色沉淀;
(2) 将(1)所得溶液 ![]() 放出使紫色石蕊试液变蓝的气体;
放出使紫色石蕊试液变蓝的气体;
(3) 原溶液中加BaCl2溶液不产生沉淀。
(4)原溶液中加AgNO3溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解
回答下列问题:
(1)原溶液中一定含有的离子是_________________________,一定不含有的离子是_________________
(2)有同学认为实验(4)可以省略,你认为呢?(填符号:A-可以,B -不可以)
说明理由
答案
1C 2D 3C 4C 5C 6C 7B 8D 9C 10B 11C 12C 13C 14C 15D 16D 17D 18BC 19B 20B 21B 22A
23.(1)C(2)F(3)A(4)G(5)E
24.(1)100mL容量瓶 (2)> B
(3)配制pH =1的HB溶液难以实现;加入的锌粒难以做到表面积相同
(4)配制NaB溶液,测其pH值>7即证明HB是弱电解质
(注:本题解答若操作简单、现象明显、不是化学教材中讲过的常规方法应属创新,经认可后可得分)
25.⑴[ 11 ]P+[ 15 ]CuSO4+[ 24 ]H2O===[ 5 ]Cu3P+[ 6 ]]H3PO4+[ 15 ]H2SO4
P、CuSO4 ,0.2mol 。
⑵[ 2 ]Fe(OH)3+[5-n]ClO-+[2n ]OH-===[ 2 ]FeO4n-+[5-n]Cl-+[n+3]H2O
n= 2 ,+6 , B、C
26.
(1)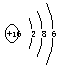 ;
; ;
; ;
;
(2)NaHSO4=Na++H++SO42-、NaHSO4在水溶液中完全电离出氢离子使溶液呈酸性
![]() CO32-+H2O HCO3-+OH-、CO32-水解使溶液呈碱性
CO32-+H2O HCO3-+OH-、CO32-水解使溶液呈碱性
(3)2H++CO32-=H2O+CO2↑;
2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑
27.⑴ Mg(OH)2
⑵4Fe(OH)2+O2+2H2O=4Fe(OH)3
⑶ Ag(NH3)2++ OH-+3H++Cl-=2NH4++AgCl↓+ H2O
⑷C为固体,X为浓溶液
28. (1)A:![]() E:
E: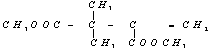
F: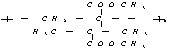
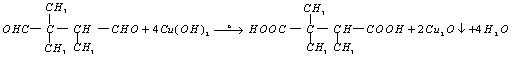 29.(1)Mg2+、
29.(1)Mg2+、![]() 、Cl-(2分);
、Cl-(2分); ![]() 、
、![]() (2分);Na+ 、 K+、
(2分);Na+ 、 K+、
(2)A
溶液显电中性有阳离子存在必有阴离子存在(其他答案合理给分)