高三联合体化学综合练习(三)
[ ]1.化学反应2X+3Y![]() 2Z开始X的浓度为2mol/L,Y的浓度4mol/L,4min后X的浓度为1mol/L,则Y的速率为
2Z开始X的浓度为2mol/L,Y的浓度4mol/L,4min后X的浓度为1mol/L,则Y的速率为
A.0.75mol/(L·min) B.0.5 mol/(L·min) C.0.25 mol/(L·min) D.0.375 mol/(L·min)
[ ]2.已知X元素的某种同位素的氯化物XCln为离子晶体,晶体中X元素的微粒核内中子数为m ,核外电子数为y,则该同位素的符号是
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
[ ]3.下列各种溶液中,能大量共存的离子组是
A.pH=1的溶液中:Mg2+、Fe3+、NO3-、[Ag(NH3)2]+
B.[H+]=10-14mol·L-1 的溶液中:Na+,AlO2- ,HS-,SO42-
C.pH=3的溶液中:Mg2+,Fe3+,Cu2+,SO42-
D.使紫色石蕊试液变红色的溶液中:K+,Na+,Ca2+,HCO3-
[ ]4.可逆反应A+B(g)![]() C达到平衡后,无论加压或降温。B的转化率都增大,则下列结论正确的是
C达到平衡后,无论加压或降温。B的转化率都增大,则下列结论正确的是
A. A为固体,C为气体,正反应为放热反应 B. A为气体,C为固体,正反应为放热反应
C. A为气体,C为固体,正反应为吸热反应 D. A、C均为气体,正反应为吸热反应
[ ]5.一定温度下,石灰乳悬浊液中存在下列平衡:Ca(OH)2(S)![]() Ca2+(aq)+2OH-(aq),当向一定量的石灰乳悬浊液中加入少量生石灰时,下列说法正确的是
Ca2+(aq)+2OH-(aq),当向一定量的石灰乳悬浊液中加入少量生石灰时,下列说法正确的是
A.溶液中Ca2+离子数目减少 B.溶液c(Ca2+)减小
C.溶液的C(OH-)增大 D.溶液中溶质的质量分数增大
[ ]6.合成氨工业对国民经济和社会发展具有重要的意义。哈伯法合成氨需要在20-50MPa的高压和500℃的高温下,并用铁作为催化剂,氨的转化率为10%-15%。最近美国俄勒冈大学的化学家使用了一种名为trans-Fe(DMeOPrPE)2的催化剂,在常温下合成出氨,反应方程式可表示为N2+3H2→2NH3,有关说法正确的是
A.哈伯法合成氨是吸热反应,新法合成氨是放热反应
B.新法合成和哈伯法相比不需要在高温条件下,可节约大量能源,具有发展前景
C.新法合成能在常温下进行是因为不需要断裂化学键
D.新的催化剂降低了反应所需要的能量,降低了活化分子百分数
[ ]7.一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g)![]() 2SO3(g)达到平衡后改变下述条件,SO3气体平衡浓度不改变的是
2SO3(g)达到平衡后改变下述条件,SO3气体平衡浓度不改变的是
A. 保持温度和容器体积不变,充入1molSO3(g)B. 保持温度和容器内压强不变,充入1molSO3(g)
C. 保持温度和容器内压强不变,充入1molO2(g) D. 保持温度和容器内压强不变,充入1molAr(g)
[ ]8.在相同条件下(T=500K),相同体积的甲、乙两容器中,甲充入1gSO2、1gO2,乙充入2gSO2、2gO2,下列叙述中错误的是
A.化学反应速率:乙>甲 B.SO2转化率:乙>甲
C.平衡后O2浓度:乙>甲 D.平衡后SO3的体积分数:乙>甲
[ ]9.将 lmolSO2和 l mol O2 通入体积不变的密闭容器中,在一定温度和催化剂作用下,反应达到平衡时 SO3为0.3mol,若此时移走 0.5mol O2和 0.5mol SO2则反应达到新的平衡时,SO3的物质的量A.0.3mol B.0.15mol C.小于 0.15mol D.大于0.15mol而小于 0.3mol
[ ]10.某苯的衍生物,含有两个互为对位的取代基,其分子式为C8H10O,其中不溶解于NaOH溶液的该衍生物的结构式有
A.1种 B.2种 C.3种 D.4种
[ ]11.分子式与苯丙氨酸(![]() )相同,且同时符合下列两个条件:①有带两个取代基的苯环 ②有一个硝基直接连接在苯环上的异构体的数目是
)相同,且同时符合下列两个条件:①有带两个取代基的苯环 ②有一个硝基直接连接在苯环上的异构体的数目是
 A.3
B.5
C.6
D.10
A.3
B.5
C.6
D.10
[ ]12.以乙醇为原料,用下述6种类型的反应:①氧化;②消去;③加成;④酯化;⑤水解;⑥加聚,来合成乙二酸乙二酯(结构简式如图所示)的正确顺序是
A.①⑤②③④ B.①②③④⑤ C.②③⑤①④ D.②③⑤①⑥
 [
]13.经一定时间后,可逆反应aA+bB
[
]13.经一定时间后,可逆反应aA+bB
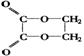
![]() cC中物质的含量A%和C%随温度的变化曲线如右图所示,下列说法正确的是
cC中物质的含量A%和C%随温度的变化曲线如右图所示,下列说法正确的是
A.该反应在T1、T3温度时达到化学平衡 B.该反应在T2温度时达到化学平衡
C.该反应的逆反应是放热反应
D.升高温度,平衡会向正反应方向移动
[ ]14.某铁的氧化物,在一定条件下用100ml 7mol/L 的盐酸恰好完全溶解,当向所得溶液中通入0.56L(标准状况)的氯气时,刚好使溶液中Fe2+完全转化成Fe3+。则该氧化物的化学式表示为
A.FeO B.Fe3O4 C.Fe4O5 D.Fe5O7
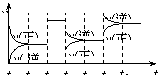 15.某密闭容器中发生如下反应:X(g)+3Y(g)
15.某密闭容器中发生如下反应:X(g)+3Y(g)![]() 2Z(g);ΔH<0
2Z(g);ΔH<0
右图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件
有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
A.t2时加入了催化剂 B.t3时降低了温度
C.t5时增大了压强 D.t4~t5时间内转化率最低
[ ]16.相同温度下,同物质的量浓度的Na2SO3和Na2CO3的两种溶液中,下列关系式正确的是
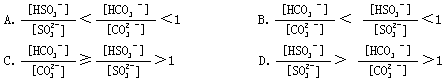
[ ]17.不溶于水的氧化亚铜可溶于含硫酸铁的硫酸溶液中,这时生成的硫酸亚铁可用酸性高锰酸钾溶液滴定,从而测定氧化亚铜的量:Cu2O+Fe2(SO4)3+H2SO4——FeSO4+CuSO4+H2O FeSO4+KMnO4+H2SO4——Fe2(SO4)3+MnSO4+K2SO4+H2O 由上述反应知;0.1mol/L的KMnO4溶液1mL相当于氧化亚铜的量是
A. 360mg B. 3.6g C. 0.36g D. 2.5×10-4mol
[ ]18.pH=3的某酸与pH=11的Ba(OH)2等体积混合,则pH混
A. pH混≤7 B. pH混>7 C. pH混=7 D. pH混≥7
[ ]19.下列离子方程式正确的是
A.碳酸氢镁溶液和过量的NaOH溶液反应:Mg2++2OH-=Mg(OH)2↓
B.二氧化硫气体通入过量的Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
C.Ba(OH)2溶液中滴入NaHSO4至pH等于7:Ba2++OH-+H++SO42-=BaSO4↓+H2O
![]() D.KHS的水解: HS-+H2O H2S+OH-
D.KHS的水解: HS-+H2O H2S+OH-
[ ]20.为证明盐的水解释吸热的,四位同学分别设计了如下方案,其中正确的是
A.甲同学:在醋酸钠溶液中滴加2滴酚酞试剂,加热后红色加深,说明盐类水解是吸热的。
B.乙同学:在盐酸中加入氨水,混合液温度上升,说明盐类水解是吸热的。
C.丙同学:将硝酸铵晶体溶于水,水温降低,说明盐类水解是吸热的。
D.丁同学:在氨水中加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热的
[ ]21.下图为两种氨基酸的结构示意图,若二者通过肽键形成二肽,则形成的二肽共有几种结构
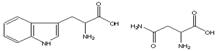 A.2种 B.3种
C.4种 D.5种
A.2种 B.3种
C.4种 D.5种
[ ]22.国家食品药品监督管理局今年通报了查处齐齐哈尔第二制药有限公司假药案的最新进展情况:齐二药违反有关规定,将“二甘醇”辅料用于“亮菌甲素注射液”生产,导致多人肾功能急性衰竭。齐二药购入的药用辅料“丙二醇”实际为“二甘醇”。“二甘醇”在病人体内氧化成草酸,导致肾功能急性衰竭。又知“二甘醇(Diethylene glycol)”又称乙二醇醚或二乙二醇醚。下列关于“丙二醇”和“二甘醇”及“乙二醇”的有关说法正确的是
A.丙二醇是乙二醇的同系物 B.它们具有相同种类和数目的官能团,性质上完全相同
C.“丙二醇”和“二甘醇”在病人体内都能被氧化为草酸 D.分离“丙二醇”和“二甘醇”可采用分液的方法
[ ]23.若NA为阿伏加德罗常数,下列说法中正确的是
A.常温常压下,11.2LN2和NO的混合气体所含的原子数为NA
B.1 mol C8H18分子中,共价键总数为25NA C.在1molSiO2晶体中含 Si-O键的数目为2NA
D.含0.1 mol H2O2的水溶液跟MnO2充分作用,反应过程中转移的电子总数为0.2NA
[ ]24.在一个固定容积的密闭容器中充入2molNO2,一定温度下建立如下平衡:2NO2 ![]() N2O4
N2O4
此时平衡混合气中NO2的体积分数为X%,若再充入1molN2O4在温度不变的情况下,达到新的平衡时,测得NO2的体积分数为Y%,则X和Y的大小关系正确的是
A.X>Y B.X<Y C.X=Y D.不能确定
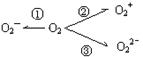 25.(1)据报道,意大利科学家使用普通氧分子和带正电的氧离子作用,制成了新型的氧分子O4 ,它的结构很复杂,可能具有与S4相似的长方形结构,
25.(1)据报道,意大利科学家使用普通氧分子和带正电的氧离子作用,制成了新型的氧分子O4 ,它的结构很复杂,可能具有与S4相似的长方形结构,
下列有关O4的说法不正确的是
A.O4与O3、O2都是氧的同素异形体 B.O4分子内存在极性键
C.合成O4的反应可看作核聚变反应,即不属于化学变化
D.O4的能量比普通氧分子高,将来可用作更强力的火箭推进的氧化剂
(2)制备O2—、O22—、O2+的化合物是可能的,它们通常是在氧分子进行下列反应时生成的(如上图)。在这些反应中(填序号.下同) 相当于氧分子的氧化, 相当于氧分子的还原。
(3)各写出一种含有O2—、O22—的物质的化学式: 、
26.在一固定容积的密闭容器中,保持一定条件下进行以下反应:X(气)+2Y(气)![]() 3Z(气),已知加入1 molX和3molY。达到平衡后,生成a mol Z。
3Z(气),已知加入1 molX和3molY。达到平衡后,生成a mol Z。
(1)在相同实验条件下,若在同一容器中改为加入2 mol X和6 mol Y,达到平衡后,Z的物质的量为 。
(2)在相同实验条件下,若在同一容器中改为加入2 mol X和8 mol Y,若要求在反应混合气体中Z体积分数不变,则还需加入Z mol。
(3)在相同实验条件下,若在同一容器中改为加入0.5molX,则需加入 mol Y, mol Z,才能使平衡时Z为0.9a mol。
27.⑴室温下取0.2mol·L-1HCl溶液与0.2mol·L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
① 混合溶液中水电离出的c(H+)__________0.2mol·L-1 HCl溶液中电离出的c(H+);(填“>”、“<”、或“=”)
② 求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Cl-) - c(M+) = ______________ mol·L-1 c(H+) - c(MOH) = _______________ mol·L-1
⑵ 室温下如果取0.2mol·L-1 MOH溶液与0.1 mol·L-1 HCl溶液等体积混合,测得混合溶液的pH<7则说明MOH的电离程度________MCl的水解程度。(填“>”、“<”、或“=”),混合液中各离子浓度由大到小的顺序为
28.烯烃通过臭氧化并经锌和水处理得到醛或酮,例如:
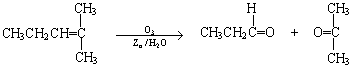 |
一种链状单烯烃A通过臭氧化并经锌和水处理得到B和C。化合物B含碳69.8%,含氢11.6%,B无银镜反应。D在浓硫酸存在下加热,可得到能使溴水褪色且只有一种结构的物质E。其转化关系如下;
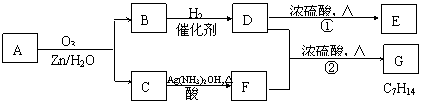 |
请回答下列问题:
(1) B的相对分子质量是______________。
(2) 写出结构简式:A__________________ 、E_______________________ 。
(3) 写出反应①、②的反应类型:①____________、②_______________。
(4) 写出反应②的化学方程式: 。
29.有X、Y、Z三种同周期的短周期元素,已知:①X2-、Y- 两种离子的最外层电子数均与此外层电子数相等;②Z与Y可组成离子化合物ZY2 请回答:
(1)Y的最高价氧化物对应水化物的化学式是
(2)Z的单质可以在CO2中燃烧,请写出该反应的化学方程式:
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体W。
①已知一定条件下,每1 molW气体被O2氧化放热98.0 kJ。若2 mol该气体与1 mol O2在此条件下发生反应,达到平衡时放出的热量是176.4 kJ,则W气体的转化率为: 。
②将足量的W气体与含1.5 mol Y的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种Y的氧化物,同时有1.5mol电子转移,则该Y的氧化物的化学式是: 。
30.A、B、D、E是周期表中前20号元素,它们的原子序数依次增大。EA2与水反应产生可燃性气体和白色浆状物,向该浆状物中通入AB2气体可得另一白色不溶物。B、D同主族,D的阴离子与E的阳离子具有相同的核外电子排布。请回答:
(1)写出元素符号:A 、B 。
(2)已知AD2与AB2的结构相似,AD2的结构式为 ,该分子是 (填“极性分子”或“非极性分子”)。
(3)镁条在AB2中燃烧的化学方程式为 。
(4)将D单质放入浓HNO3中加热,生成红棕色气体和一种强酸,该反应的离子方程式为
(5)A可形成二元弱酸H2A2O4。0.1 molH2A2O4与100 mL 2 mol/L的KOH溶液反应后,溶液中的离
子浓度由大到小的排列顺序是 。
31.氙有一种化合物XeO3,但极不稳定,易转化为其单质而具有强氧化性,将适量XeO3投入60mL0.1mol/L的Mn(NO3)2的水溶液中恰好完全反应,放出唯一气体氙单质,在标准状况下体积为112mL,则
⑴反应后的溶液中,锰在化合物中的化合价为__________
⑵该反应除有气体生成外,还有一明显的实验现象为
⑶若将所得溶液稀释至180mL,溶液的PH为____________(设生成的酸均为强酸)
答案
1D 2D 3C 4B 5A 6B 7B 8C 9C 10B 11C 12C 13B 14D 15A 16A 17D 18A 19D 20A 21C 22A 23B 24A
25(1)B、C (2)② ;①、③ (3)K O2、 Na2 O2
26(1)2amol;(2)6mol;(3)1.9mol,1.2mol.
27⑴ ① > ② 9.9×10-7 1.0×10-8 ⑵ < c(Cl-) > c(M+) > c(H+) > c(OH-)
28.(1)86
(2)A:(CH3CH2)2C=CHCH3 E:CH3CH=CHCH2CH3
(3)①消去反应 ②酯化(取代)反应
(4)CH3COOH+CH3CH2CH(OH)CH2CH3![]() CH3COOCH(CH2CH3)2+H2O
CH3COOCH(CH2CH3)2+H2O
29.![]() (1)HClO4
(1)HClO4
(2)2Mg+CO2 2MgO+C
(3)① 90% ② ClO2
30.(1)C O
|
|
|
|
(4)S+4H++6NO3 == SO4 +6NO2↑+2H2O
|
[c (HC2O4— )与c (H+ )顺序颠倒不扣分]
31.(1)+7 (2)溶液显紫色(3)1