高三联合体化学综合练习(四)
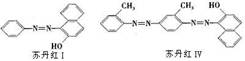 [ ]1.前不久在央视爆光的用苏丹红Ⅳ号饲养鸭子生红心鸭蛋的报道让人触目惊心。苏丹红有Ⅰ、Ⅱ、Ⅲ、Ⅳ号四种,均具有致突变性和致癌性。 “苏丹红Ⅳ号”与“苏丹红Ⅰ号”主体结构相同,但存在差别,均有致癌作用,它们的结构如图所示.则下列有关苏丹红有Ⅰ号和苏丹红Ⅳ号的叙述正确的是
[ ]1.前不久在央视爆光的用苏丹红Ⅳ号饲养鸭子生红心鸭蛋的报道让人触目惊心。苏丹红有Ⅰ、Ⅱ、Ⅲ、Ⅳ号四种,均具有致突变性和致癌性。 “苏丹红Ⅳ号”与“苏丹红Ⅰ号”主体结构相同,但存在差别,均有致癌作用,它们的结构如图所示.则下列有关苏丹红有Ⅰ号和苏丹红Ⅳ号的叙述正确的是
A.苏丹红Ⅰ号和苏丹红Ⅳ号都是有毒物质,两者互为同系物。
B.它们均能与NaOH溶液、FeCl3溶液、溴水等物质反应。
C.它们分子中的所有原子都可能在同一平面上。
D.苏丹红Ⅰ号和苏丹红Ⅳ号均属于芳香族化合物,也属于氨基酸,能发生加成反应.
[ ]2.类推是在化学学习和研究中常用的思维方法,但类推出的结论最终要经过实践的检验才能决定其正确与否,下列几种类推结论中不正确的是
A.钠、镁都是活泼金属,由金属钠和镁引起火灾都不能用干冰灭火器灭火
B.NaHC03溶液能与NaAl02反应生成白色沉淀,NaHS03溶液也能与NaAl02反应生成白色沉淀
C.NH4C1、NH4I结构相似,将两种固体分别加热,都分解生成HX和NH3
D.原电池中通常是活泼金属做负极,不活泼金属做正极,用铜和铝与浓硝酸构成原电池时,铝是正极
[ ]3. 下列实验操作正确的是
①将未经湿润的pH试纸浸到某溶液中,过一会取出与标准比色卡比较测得该溶液的pH ②使用碱式滴定管盛装KMnO4溶液滴定Na2SO3溶液 ③将3滴浓硫酸滴入蓬松的脱脂棉中搅拌加热,在其中加入2滴2%CuSO4溶液,再加入足量的10%NaOH溶液,并加热至沸腾,可证明纤维素的水解 ④用热水加热乙醛和银氨溶液的混合液做乙醛的银镜实验 ⑤向蛋白质溶液中加入无机盐(如Na2SO4、CuSO4)浓溶液,可使蛋白质盐析而分离提纯 ⑥实验室制肥皂时,将适量植物油、乙醇和NaOH溶液混合,并不断搅拌、加热,直到混合物变稠,即可得到肥皂 ⑦配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加浓硫酸 ⑧检验红砖中的氧化铁成分时,向红砖粉末中加入盐酸,放置至充分沉淀后,取上层清液于试管中,滴加KSCN溶液2滴~3滴即可
A.①③⑥⑧ B.②③⑥⑧ C.②④⑥⑦ D.③④⑧
[ ]4.将一定量铁粉和硫粉的温合物隔绝空气共热,充分反应后冷却,再加入足量稀H2SO4,得到标准状况下的气体11.2L,则原混合物可能的组成是(n代表物质的量)
A.![]() ,总质量等于44g B.
,总质量等于44g B.![]() ,总质量等于44g
,总质量等于44g
C.![]() ,总质量大于44g D.
,总质量大于44g D.![]() ,总质量小于44g
,总质量小于44g
[ ]5.NA为阿伏加德罗常数,下列说法中不正确的是
A.16.9gBaO2固体中阴、阳离子总数为0.3NA B.2.3g钠被O2完全氧化时,失去电子数为0.1NA
 C.质子总数为5NA的重水(D2O)的物质的量为0.5mol
C.质子总数为5NA的重水(D2O)的物质的量为0.5mol
D.大在标准状况下,11.2L甲烷与乙烯的混合物所含氢原子的数目为2NA
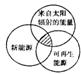
[ ]6.“能源分类相关图”如右图所示,四组能源选项中,全部符合图中阴影部分的能源是
A.煤炭、石油、潮汐能 B.水能、生物能、天然气
C.太阳能、风能、沼气 D.地热能、海洋能、核能
|
|
A.Z、W均匀为气体,X、Y有一种是气体
B.Z、W中有一种是气体,X、Y皆为非气体
C.X、Y、Z皆为气体,W为非气体
D.X、Y均不为气体,W、Z中有一种是气体
[ ]8.从某些方面看,NH3与H2O,NH![]() 与H3O+、HN
与H3O+、HN![]() 与OH-,N3-与O2-两两相似,据此判断下列反应:①
与OH-,N3-与O2-两两相似,据此判断下列反应:①![]() ②
②![]()
③![]() ④
④![]() 其中正确的是A.只有② B.只有③ C.只有②③ D.都正确
其中正确的是A.只有② B.只有③ C.只有②③ D.都正确
[ ]9.有机物甲分子式为C11H14O2 .在酸性条件下水解生成乙和丙,丙遇FeCl3溶液显紫色,丙的相对分子质量比乙大20,甲的结构有
A.3种 B.4种 C.6种 D.8种
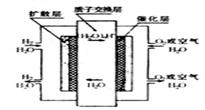 [ ]10.零排放燃料电池曾被美国《时代》杂志列为21世纪改变人类生活的十大新科技之首。其中质子交换膜燃料电池的工作原理如右图所示,下列选项中不正确的是
[ ]10.零排放燃料电池曾被美国《时代》杂志列为21世纪改变人类生活的十大新科技之首。其中质子交换膜燃料电池的工作原理如右图所示,下列选项中不正确的是
A. 该电池的正极反应式为:O2+4H++4e-==2H2O
B. 该电池的负极反应式为:2H2-4e-== 4H+
C. 该电池的总反应式为:2H2+O2==2H2O
D. 导电离子:H+(质子)由正极定向移动至负极
[ ]11.下列各溶液中,微粒的物质的量浓度关系正确的是
A. 10mL 0.5mol/L CH3COONa溶液与5mL 1mol/L盐酸混合:c(Cl-)>c(Na+)>c(H+)>c(OH-)
B. 0.1mol/L pH为4的NaHB溶液中: c(HB-)>c(B2-)>c(H2B)
C. 在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
D. c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:c[(NH4)2CO3]<c[(NH4)2SO4]<c(NH4Cl)
[
]12.在![]() 溶液中,加入ag铜,完全溶解后,再加入bg铁,充分反应后得到cg残余固体,且
溶液中,加入ag铜,完全溶解后,再加入bg铁,充分反应后得到cg残余固体,且![]() ,则下列说法正确的是
,则下列说法正确的是
A.残余固体全部是铜
B.最后得到的溶液中一定含![]() 和Fe3+
和Fe3+
C.将残余固体加入到稀H2SO4中,有气泡产生 D.最后得到的溶液中可能含有Fe3+
[ ]13.下列有关说法正确的是
A.物质熔沸点的高低顺序是:晶体硅>氯化钠>冰>氖气 B.微粒半径由小到大顺序是:H-<Li+<H+C.溶液中结合H+能力由强到弱的顺序是:SO42- >H2PO4->CH3COO->HCO3-
D.CO2、HClO、CF4、PCl3四种物质分子中的所有原子都满足最外层为8电子的稳定结构
[ ]14.下列离子方程式正确的是
A.硫酸铝溶液中加入过量氨水:Al3++4OH-=AlO-2+2H2O
B.向硅酸钠溶液中通入过量的CO2:SiO2-3+2CO2+2H2O=H2SiO3↓+2HCO-3
C.过量铁粉与一定量稀硝酸反应:Fe+4H++NO-3=Fe3++NO↑+2H2O
D. NaHSO4溶液与Ba(OH)2溶液混合呈中性: HSO4—+Ba2++ OH—=BaSO4↓+ + H2O
 [ ]15.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn
+ 2K2FeO4 + 8H2O 3Zn(OH)2
+ 2Fe(OH)3 + 4KOH下列叙述正确的是
[ ]15.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn
+ 2K2FeO4 + 8H2O 3Zn(OH)2
+ 2Fe(OH)3 + 4KOH下列叙述正确的是
A.放电时负极反应为:Zn—2e— +2OH—= Zn(OH)2
B.充电时阴极反应为:Fe(OH)3 —3e— + 5 OH— = FeO![]() + 4H2O
+ 4H2O
C.放电时每转移3 mol电子,正极有1mol K2FeO4被氧化 D.放电时正极附近溶液的碱性增强
[ ]16.甲、乙两容器都发生反应2A(g)+B(g) ![]() xC(g),两容器温度和初始压强相同。甲容器中充入2molA和1molB,达平衡后,C在平衡混合气中的体积分数为w,物质的量为n1;乙容器中充入1.4molA、0.7molB和0.6molC,达平衡后C在平衡混合气中的体积分数为w,物质的量为n2。下列说法中正确的是
xC(g),两容器温度和初始压强相同。甲容器中充入2molA和1molB,达平衡后,C在平衡混合气中的体积分数为w,物质的量为n1;乙容器中充入1.4molA、0.7molB和0.6molC,达平衡后C在平衡混合气中的体积分数为w,物质的量为n2。下列说法中正确的是
A.若甲、乙两容器均为恒容容器,则x必等于2 B.若甲、乙两容器均为恒压容器,则x必等于3
C.若甲为恒压容器、乙为恒容容器,且x≠3,则n1必大于n2
D.若甲为恒容容器、乙为恒压容器,且x=3,则n1必大于n2
[ ]17.下列各选项所述的两个量,前者一定大于后者的是
①HF和HBr的沸点,②纯水在25℃和80℃时的pH,③同温下分别在100g水中最多能溶解的无水CuSO4和CuSO4·5H2O的质量,④25℃时,等体积的pH都等于3的盐酸和AlCl3溶液中,已电离的水分子数,⑤在NH3+NO→N2+H2O反应中,被氧化和被还原的N原子数,⑥耐火材料MgO和CaO的熔点,⑦H-和H+离子半径,⑧金刚石晶体和石墨晶体中,每个最小碳环里所含的实际碳原子数
A.①②⑥ B.①②③⑤ C.⑤⑥⑦ D.①②⑥⑦
[ ]18.常温下,等体积的下列各组酸和碱的溶液混和后,溶液pH<7的是 ①pH之和为14的硝酸和氢氧化钾溶液; ②pH之和为15的盐酸和氨水溶液; ③pH之和为14的醋酸和苛性钠溶液;④pH之和为13的硫酸和氢氧化钡溶液
A.② B.①② C.②③ D.③④
[ ]19.在一定温度下将H2O、O2、CO2三种气体的混合气通过足量的Na2O2固体后,体积变为原来的8/9(同温、同压),原混合气体中H2O、O2、CO2物质的量之比可能为
A.2∶7∶1 B.3∶14∶1 C.6∶7∶3 D.2∶7∶2
20.某化学兴趣小组按照下列方案进行“由含铁废铝制备硫酸铝晶体”的实验:
步骤1:取一定量含铁废铝,加足量的NaOH溶液,反应完全后过滤。
步骤2:边搅拌边向溶液中滴加稀硫酸至溶液pH=8~9,静置、过滤、洗涤。
步骤3:将步骤2中得到的固体溶于足量的稀硫酸。
步骤4:将得到的溶液范发浓缩、冷却、结晶、过滤、干燥。 请回答以下问题:
(1)上述实验中的过滤操作需要玻璃棒、 、 等玻璃仪器。
(2)步骤1过滤的目的是 。
(3)当步骤2中溶液的pH=8~9时,检验沉淀是否完全的方法是 。
(4)步骤2中溶液的pH较难控制,可改用 。
21.(1)下列盛放物质的方法,错误的是 (选填序号)。
A.把汽油放在带橡皮塞的细口玻璃瓶中 B.把硝酸放在棕色广口玻璃瓶中
C.把烧碱溶液放在带磨口塞的玻璃瓶中 D.把新制氯水放在无色玻璃瓶中
(2)现有下列仪器或用品:a.铁架台(含铁圈、各式铁夹) b.锥形瓶 c.酸式滴定管和碱式滴定管
d.烧杯(若干) e.玻璃棒 f.胶头滴管 g.天平(含砝码) h.滤纸 i.量筒 j.过滤漏斗
现有下列试剂:A.NaOH固体 B.标准NaOH溶液 C.未知浓度盐酸 D.蒸馏水 E.碳酸钠
溶液 F.氯化镁溶液 试填空:
①过滤,应选用的上述仪器和用品是 (选填序号)。
②配制一定物质的量浓度的氢氧化钠溶液时,还缺少的仪器是
③做酸碱中和滴定时,还缺乏的试剂是 。
④进行中和滴定时,绝不可用将要盛的溶液事先润洗的仪器是下列的 (选填序)。
a.酸式滴定管 b.碱式滴定管 c.量筒 d.锥形瓶
22.碱式氯化铜 (Cupric Chloride,不溶于水的绿色结晶)是一种农药,分子式:
CuCl2·3Cu(OH)2·XH2 O(X=1/2,1,2)为验证其组成并确定X值,某学生设计了以下几步实验
① 取a g的晶体制成粉末。②晶体加热确认质量不再变化为止(铜仍为二价),冷却后称其质量为b g
③另取a g的晶体,溶于足量某溶剂中充分溶解得到溶液。 ④向③得到的溶液中加入足量的硝酸银溶液,最后得到纯净固体称量为c g。若以上操作均正确,试回答下列问题:
A.将晶体制成粉末,所用的主要化学仪器 (填仪器名称,下同);灼烧晶体时所用主要仪器是 。以上四步中,用到玻璃棒的步骤有 (选填:①②③④)
B.步骤②灼烧后得到的固体应为: 。C.步骤③所用的溶剂可能是 。
D.步骤④主要包括加入足量硝酸银溶液→ → → 晾干→称量
E.若组成符合通式,则计算X的表达式为: (用字母表示)。
23.现有浓度为0.1mol·L-1的五种电解质溶液 ①Na2CO3 ②NaHCO3 ③NaAlO2 ④CH3COONa ⑤NaOH 已知:CO2+3H2O+2AlO2-====2Al(OH)3↓+CO32-
(1)这五种溶液的pH由小到大的顺序是 (填编号)
(2)将五种溶液稀释相同的倍数时,其pH变化最大的是 (填编号)
(3)在上述五种溶液中分别加入AlCl3溶液,以产生无色无味气体的是 (填编号)
(4)将上述①、②、③、④四种溶液两两混合时,有一对溶液相互间能发生反应,写出该反应的离子
方程式 。
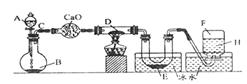 24.某一化学反应的实验装置如图所示:
24.某一化学反应的实验装置如图所示:
A—H属于下列物质中的六种物质:浓硫酸、浓盐酸、浓氨水、稀硫酸、稀盐酸、稀氯水、水、锌粒、铜片、氯化钙、氧化钙、四氧化三铁、氧化铜、氢气、二氧化碳、二氧化氮、氯气、氯化氢、氨气、氮气、氧气。
实验现象:①D物质由黑色变为红色;②无水硫酸铜粉末放入无色透明的E中得到蓝色深夜;③点燃的镁条伸入无色无味的F中,镁条继续燃烧,将生成的物质放入水中,有气体放出,并有白色浑浊物形成,该气体具有刺激性气味,并能使润湿的红色石蕊试纸变蓝。通过分析回答:
| |
A ;B ;D ;E ;F 。
(2)写出有关的化学方程式:
A与B ;
C与D ;
F与Mg的反应产物与水 。
25.如下图所示,温度不变时某容器分隔A、B两部分,A容积固定不变,B有可移动的活塞,现有A中充入2molSO2和1molO2,在B中充入![]() 和
和![]() ,在相同条件下发生可逆反应:2SO2+O2
,在相同条件下发生可逆反应:2SO2+O2 ![]() 2SO3(g)
2SO3(g)
| |
(1)若固定活塞位置在右侧的3处不动,达到平衡时,设A中压强pA,
B中压强为pB,则pB,与pB的关系是pA pB(填“大于”“小于”或“等于”)。
(2)若要使B中与A中平衡状态相同,可移动活塞的位置应在 处。(选“2”、“3”或“4”)(3)若活塞右移到5处,达到平衡后,A中SO3(g)为xmol,B中SO3(g)为ymol,则x和y的关系是x y(填“大于”“小于”或“等于”),理由是 。
26.在一定条件下,烯烃可发生臭氧化还原水解反应,生成羰基化合物,该反应可表示为:
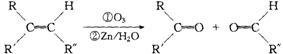
已知:①化合物A,其分子式为C9H10O,它既能使溴的四氯化碳溶液褪色,又能与FeCl3溶液发生显色反应,且能与金属钠或氢氧化钠溶液反应生成B;
②B发生臭氧化还原水解反应生成C,C能发生银镜反应;
③C催化加氢生成D,D在浓硫酸存在下加热生成E;
④E既能使溴的四氯化碳溶液褪色,又能与FeCl3溶液发生显色反应,且能与氢氧化钠溶液反应生成F;
⑤F发生臭氧化还原水解反应生成G,G能发生银镜反应,遇酸转化为H(C7H6O2)。
请根据上述信息,完成下列填空:
(1)写出下列化合物的结构简式(如有多组化合物符合题意,只要写出其中的一组)
A ,C ,E 。
(2)写出分子式为C7H6O2的含有苯环的所有同分异构体的结构简式:
答案
1B 2C 3D 4D 5A 6C 7C 8D 9C 10D 11B 12A 13A 14B 15A 16D 17D 18D 19B
20.(1)烧杯 漏斗
(2)除去铁等不溶于碱的杂质
(3)取上层清液,逐滴加入稀硫酸,若变浑浊则说明沉淀不完全,若不变浑浊则说明沉淀完全
(4)通入足量的CO2气体
21.(1)A、B、C、D
(2)①a、d、e、h、j ②容量瓶
③指示剂(填“甲基橙”或“酚酞” 给1分,填“石蕊”给0分) ④d
22. A.研钵 坩埚 ②③④ B.CuO C. HNO3 D.过滤 洗涤
E.![]() 或
或![]()
23.(1)④②①③⑤ (2)⑤ (3)①②
(4)HCO3-+AlO2-+H2O====Al(OH)3↓+CO32-
24.(1)A:浓氨水; B:氧化钙; D:氧化铜; E:水; F:氮气
(2)A与B:CaO+NH3·H2O=Ca(OH)2+NH3↑
C与D:3CuO+2NH3![]()
F与Mg的反应产物放入水中:Mg3N2+6H2O 3Mg(OH)2↓+2NH3↑
25.(1)小于 (2)3 (3)大于 相当于给B减压
26. (1)
A:HO-![]() -CH2CH=CH2 C:NaO-
-CH2CH=CH2 C:NaO-![]() -CH2CHO E:HO-
-CH2CHO E:HO-![]() -CH=CH2(或相应的间位、邻位)
-CH=CH2(或相应的间位、邻位)
(2)HO-![]() -CHO
-CHO ![]()
![]() HCOO-
HCOO-![]()
![]() -COOH
-COOH
