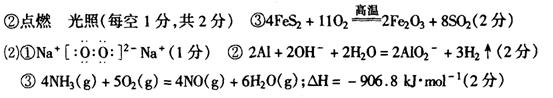高三联合体化学综合练习(五)
[ ]1.2008年夏季奥运会将在北京举行,届时要突出“绿色奥运、人文奥运、科技奥运”理念。绿色奥运是指
A.加大反恐力度,并注重各国运动员的营养搭配,使他们全身心投入比赛。
B.严禁使用兴奋剂,使运动员公平竞争。 C.把环境保护作为奥运设施规划和建设的首要条件
D.奥运场馆建设均使用天然材料,不使用合成材料
[ ]2.美国和墨西哥研究人员将普通纳米银微粒分散到纳米泡沫碳(碳的第五种单质形态)中,得到各种不向形状(正二十面体、正十面体等)的纳米银微粒,该纳米银微粒能有效杀死艾滋病病毒(HIV-1)。纳米泡沫碳与金刚石的关系是
A.同素异形体 B.同分异构体 C.同系物 D.同位素
[ ]3.意大利科学家最近合成了一种新型氧分子O4![]() ,专家认为它液化后的能量、密度均比普通氧分子高得多。下列关于该分子的叙述中不正确的是
,专家认为它液化后的能量、密度均比普通氧分子高得多。下列关于该分子的叙述中不正确的是
A.O4比O2稳定 B.O4与O3、O2是同素异形体
C.O4分子中只有非极性键 D.O4将成为一种新型强力火箭的推进助燃剂
[ ]4.运用元素周期表的知识分析下面推断,其中错误的是
A.已知Cs是第六周期ⅠA族元素,故CsOH的碱性比NaOH的碱性强
B.巳知Se是第四周期ⅥA族元素,故H2Se的稳定性比H2S的稳定性弱
C.巳知K的原子半径比Na的原子半径大,故K与水反应比Na与水反应更剧烈
D.巳知P的核电荷数比Na的核电荷数大,故P的原子半径比Na的原子半径大
[ ]5.亚硝酸盐中毒,又名乌嘴病、紫绀病、肠源性青紫病。亚硝酸盐可将正常的血红蛋白氧化成高铁血红蛋白,失去携氧能力,使组织出现缺氧现象。美蓝是亚硝酸盐中毒的有效解毒剂。下列说法不正确的是
A.在中毒过程中血红蛋白被氧化 B.中毒时亚硝酸盐发生氧化反应
C.药品美蓝应具有还原性 D.解毒时高铁血红蛋白被还原
[ ]6.下列物质发生变化时,所克服的粒子间相互作用属于同种类型的是
A.液溴和苯分别受热变为气体 B.干冰和氯化铵分别受热变为气体
C.二氧化硅和铁分别受热熔化 D.食盐和葡萄糖分别溶解在水中
[ ]7.利用相关数据作出的推理或判断不正确的是
A.用键能大小的数据,可判断分子的稳定性 B.用原子半径的数据,可推断元素的主要化合价
C.用沸点数据,可推测能否将一些液体混合物用分馏的方法分离开来
D.用溶解度数据,可判断煮沸Mg(HCO3)2溶液所得产物是Mg(OH)2还是MgCO3
[ ]8.下列叙述不正确的是
A.硝酸银溶液通常保存在棕色试剂瓶中,是因为硝酸银见光易分解
B.将Cl2和SO2分别通入到品红溶液中,均能使品红溶液退色
C.反应AgCl + NaBr![]() AgBr
+ NaCl能在水溶液中进行,是因为AgBr比AgCl更难溶于水
AgBr
+ NaCl能在水溶液中进行,是因为AgBr比AgCl更难溶于水
D.常温下浓硫酸可贮存在铁制或铝制容器中,说明常温下铁和铝与浓硫酸不反应
[ ]9.锂钒氧化物电池的能量密度远远超过其他材料电池,其成本低,便于大量推广,且对环境无污染。电池总反应式为;V2O5+ xLi→LixV2O5 , 下列说法不正确的是
A.向外供电时,锂离子在凝胶中向正极 B.正极材料是锂,负极材料为V2O5
C.正极的电极反应为:V2O5+xe—+ xLi+ →Lix V2O5 D. 负极的电极反应为:xLi-xe一→ xLi+
[ ]10.下列物质中不会因见光而分解的是
A.NaHCO3 B.HNO3 C.AgI D.HClO
[ ]11.韩国首尔大学科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成了“暖冰”。下列关于“暖冰”的说法不正确的
A.“暖冰”也是水分子间通过氢键结合而成的固体
B.水凝固形成20℃时的“暖冰”所发生的变化是化学变化
C.形成20℃时的“暖冰”的变化是物理变化
 D.在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”
D.在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”
[ ]12.下图是一种有机物的比例模型。该模型代表的有机物可能是
A.羟基羧酸 B.饱和一元醇 C.羧酸酯 D.饱和一元醛
[ ]13.碱性电池具有容量大、放电电流大的特点,因而得到广泛的应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O=Zn(OH)2(s)+Mn2O3(s)。下列说法正确的是
A.电池工作时,锌为正极 B.电池工作时,电子有正极通过外电路流向负极
C.电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e—=Mn2O3(s)+2OH—(aq)
D.外电路中每通过0.2mol电子,锌的质量理论上减小13g
[ ]14.己烯雌酚是一种激素类药物,结构如下。下列有关叙述中不正确的是
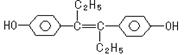 A.它易溶于有机溶剂 B.可与NaOH溶液反应
A.它易溶于有机溶剂 B.可与NaOH溶液反应
C.1mol该有机物可以与6mol Br2发生反应
D.该有机物分子中,一定有14个碳原子共平面
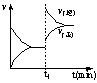 [ ]15.下图为某化学反应速率—时间图。在t1时刻升高温度或增大压强,都符合下图所示变化的反应是
[ ]15.下图为某化学反应速率—时间图。在t1时刻升高温度或增大压强,都符合下图所示变化的反应是
A.2SO2 (g)+O2 (g) ![]() 2SO3
(g) ;△H<0
2SO3
(g) ;△H<0
B.4NH3 (g)+O2 (g) ![]() 4NO(g)+6H2O
(g) ;△H<0
4NO(g)+6H2O
(g) ;△H<0
C.H2 (g)+I2 (g)
![]() 2HI
(g) ;△H>0
2HI
(g) ;△H>0
D.C
(s)+H2O (g) ![]() CO (g)+H2
(g) ;△H>0
CO (g)+H2
(g) ;△H>0
[ ]16.对于平衡体系:aA(g)+bB(g)![]() cC(g)+dD(g);正反应放热,有下列判断,其中正确的是
cC(g)+dD(g);正反应放热,有下列判断,其中正确的是
A.若温度不变,容器体积扩大一倍,此时A的浓度是原来的0.48倍,则a+b大于c+d
B.若从正反应开始,平衡时,A、B的转化率相等,则A、B的物质的量之比为a:b
C.若平衡体系中共有气体M mol,再向其中充入bmolB,达到平衡时气体总物质的量为M+bmol,则a+b>c+d D.若a+b=c+d ,则当容器内温度上升时,平衡向左移动,容器中气体的压强不变。
[ ]17.一定条件下,可逆反应X(g) + 3Y(g)![]() 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0,单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是
2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0,单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是
A.c1:c2 = 1:3 B.平衡时,Y和Z的生成速率之比为3:2
C.X、Y的转化率不相等 D.c1的取值范围为0 < c1 < 0.14mol/L
[ ]18.设NA代表阿佛加德罗常数,下列说法中正确的是
①常温常压下,17g甲基(—14CH3)所含的中子数为9NA ②常温常压22.4L NO气体的分子数小于NA ③64g的铜发生氧化还原反应,一定失去2NA个电子 ④7.8 g Na202中含有的阴离子数目约为6.02×1022 ⑤标况时,22.4L二氯甲烷所含有的分子数为4NA ⑥1 mol金刚石中含有c—c键的数目约为6.02×1023
A.①②⑥ B.②④⑤ C.②④ D.⑤⑥
[ ]19. a mol FeS与b mol FeO投入到V L、C mol•L-1的硝酸溶液中充分反应,产生NO气体,所得澄清溶液的成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为
A.(a+b)×63g B.(a+b)g C.(a+b)mol D.(CV-![]() )mol
)mol
[ ]20.用pH大小表示溶液的酸碱性相对强弱有许多不足之处。因此,荷兰科学家Henk Van Lubeck引入了酸度(AG)的概念,即把电解质溶液中的酸度定义为c(H+)与c(OH一)比值的对数,用公式表示为AG=lg [c(H+)/c(OH一)] 。常温下,在AG=10的溶液中能大量共存的离子是
A.Ca2+、K+、Cl- S2O32-、 B.NH4+、Fe2+、 I一、NO3-
C.Na+ 、K+、ClO-、S2- D.Na+、Cl-、SO42-、K+
[ ]21.一定温度下,在恒容密闭容器中发生如下反应:2A(g) + B(g)![]() 3C(g),若反应开始时充入2molA和2molB,达平衡后A的体积分数为a%。其它条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是
3C(g),若反应开始时充入2molA和2molB,达平衡后A的体积分数为a%。其它条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是
A.4molA、4molB B.2molA、1molB和1molHe(不参加反应)
C.1molB和1molC D.2molA、3molB和3molC
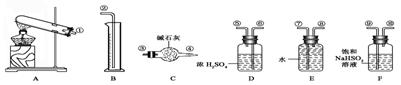 22.某化学课外活动小组,从化学手册上查得硫酸铜在500 ℃以上按下式分解:CuSO4
22.某化学课外活动小组,从化学手册上查得硫酸铜在500 ℃以上按下式分解:CuSO4![]() CuO+SO2↑+SO3↑+O2↑,便决定设计一验证性实验探索测定反应产生的SO2、SO3和O2的物质的量,并经计算以此确定该条件下CuSO4分解反应方程式中各物质的化学计量数。实验可能用到的仪器如下图所示:
CuO+SO2↑+SO3↑+O2↑,便决定设计一验证性实验探索测定反应产生的SO2、SO3和O2的物质的量,并经计算以此确定该条件下CuSO4分解反应方程式中各物质的化学计量数。实验可能用到的仪器如下图所示:
实验测得数据及有关结果如下:
①准确称取6.0 g无水CuSO4;②干燥管总质量在实验结束时增加了2.4 g;③测出量筒中水的体积后,折算成排水的气体,在标准状况下的体积为280 mL;④实验结束时,装置F中的溶液变为NaHSO4溶液(不含其他杂质,且O2在其中的损耗可忽略不计)。试回答下列问题:
(1)按装置从左至右的方向,各仪器连接顺序为 (填代号)。
(2)装置F的作用是 。
(3)装置D的作用是 。
(4)确定装置E的进、出口的原则是: 。
(5)首先应计算的是物质 的体积;通过计算,推断出该条件下反应的化学方程式:
(6)该实验设计中,可能给测定带来误差最大的装置是___________________(填代号)。
 23.在某一容积为VL的密闭容器内,加入等物质的量的X和Y,在一定的条件下发生如下反应:X(g)+Y(g)
23.在某一容积为VL的密闭容器内,加入等物质的量的X和Y,在一定的条件下发生如下反应:X(g)+Y(g)![]() 2Z
(g)。(正反应是放热反应)(1)反应达到平衡后,降低温度,化学反应速率
,Z的浓度
。(填“增大”、“减小”或“不变”)。
2Z
(g)。(正反应是放热反应)(1)反应达到平衡后,降低温度,化学反应速率
,Z的浓度
。(填“增大”、“减小”或“不变”)。
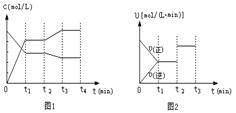
(2)图1、图2表示该反应在t1时达到平衡、在t2时因改变某个条件而发生变化的曲线:
由图1判断,反应进行至t2 min时,曲线发生变化的原因是
(用文字表达)。由图2判断,t2 min到t3 min 的曲线变化的原因可能是 (填编号)
![]() a.降低温度 b.加了催化剂 c.增加Z的量 d.缩小容器体积
a.降低温度 b.加了催化剂 c.增加Z的量 d.缩小容器体积
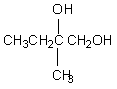
24.分子式为C13H16O2的惕各酸苯乙酯广泛用于香精的调香剂。已知:
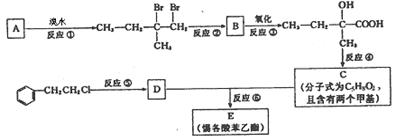 为了合成该物,某实验室的科技 人员设计了下列合成路线:试回答下列问题:
为了合成该物,某实验室的科技 人员设计了下列合成路线:试回答下列问题:
(1) 试写出:A的结构简式
B的结构简式
(2) 反应②中另加的试剂是 _______________;反应④的一般条件是 。
(3) 试写出反应生成E的化学方程式:
(4) 上述合成路线中属于取代反应的是 (填编号)。
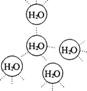 25.水是我们熟悉的物质。每个水分子都能被其他4个水分子包围形成如右图所示的四面体单元,由无数个这样的四面体再通过氢键可相互连接成一个庞大的分子晶体——冰。
25.水是我们熟悉的物质。每个水分子都能被其他4个水分子包围形成如右图所示的四面体单元,由无数个这样的四面体再通过氢键可相互连接成一个庞大的分子晶体——冰。
(1)氢键的形成使冰的密度比水 ,氢键有方向性和饱和性,故平均每个水分子最多形成 个氢键。
(2)实验测得冰中氢键的作用能为18.8 kJ/mol,而冰的熔化热为5.0 kJ/mol,说明
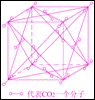 (3)干冰的外观和冰相像,可由二氧化碳气体压缩成液态后再急剧膨胀而制得。右图为干冰晶体结构示意图。通过分析,可知每个CO2分子周围与之相邻等距的CO2分子共
个。一定温度下,已测得干冰晶胞(即图示)的边长a=5.72×10-8cm,则该温度下干冰的密度为
g/cm3。
(3)干冰的外观和冰相像,可由二氧化碳气体压缩成液态后再急剧膨胀而制得。右图为干冰晶体结构示意图。通过分析,可知每个CO2分子周围与之相邻等距的CO2分子共
个。一定温度下,已测得干冰晶胞(即图示)的边长a=5.72×10-8cm,则该温度下干冰的密度为
g/cm3。
26.亚硝酸钠易溶于水,有碱味,有氧化性,也有还原性。NaNO2大量用于染料工业和有机合成工业中,也可用作水泥施工的抗冻剂。然而由于NaNO2有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
[ ]NaNO2 + [ ]KI + [ ] _____ ![]() [ ]NO +[ ] I2 +[ ] K2SO4 + [ ]Na2SO4 +[ ] _____
[ ]NO +[ ] I2 +[ ] K2SO4 + [ ]Na2SO4 +[ ] _____
⑴根据提示,写出上述反应的离子方程式
(2)在上述反应中,若要生成50.8 g I2,则电子转移了 个。
(3)用上述反应来处理NaNO2并不是最佳方法,其原因是________________________________________。从环保角度来讲,要处理NaNO2,所用的物质的 (填“氧化性”或“还原性”)应该比KI更____(填“强”或“弱”)。
(4)亚硝酸钠可以与酸反应生成亚硝酸,亚硝酸是不稳定的弱酸,它只存在于冷的稀溶液中,易发生如下分解反应:3HNO2=2NO↑+HNO3+H2O 请用两种简便的化学方法来鉴别亚硝酸钠和氯化钠。
方法一: 。
方法二:
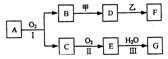 27物质的转化关系如下图所示(有的反应可能在水溶液中进行)。其中A为化合物,甲可由两种单质直接化合得到,乙为金属单质,G为酸,乙在C的浓溶液中发生钝化。
27物质的转化关系如下图所示(有的反应可能在水溶液中进行)。其中A为化合物,甲可由两种单质直接化合得到,乙为金属单质,G为酸,乙在C的浓溶液中发生钝化。
(1)若A为黄色固体,C能使品红试液褪色,D的水溶液中加入HNO3酸化的AgNO3溶液有白色沉淀生成。则 ①工业上反应I在 中进行,反应Ⅲ在 (均填设备名称)中进行。
②由两种单质直接化合得到甲的反应条件是 或 。
③反应I的化学方程式是 。
⑵若甲为淡黄色固体,D、F的溶液均呈碱性,用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近,有大量白烟生成。则
①甲的电子式是 。
②D的溶液与乙反应的离子方程式是 。
③若1.7gA与O2反应生成气态的B和C时放出22.67kJ热量,写出该反应的热化学方程式:
1C 2A 3A 4D 5B 6A 7B 8D 9B 10A 11B 12A 13C 14D 15B 16B 17C 18C 19D 20D 21B
22、(1)A、F、D、C、E、B (2)吸收三氧化硫并放出等物质的量的二氧化硫
(3)干燥二氧化硫和氧气;(4)短进出口长出
(5) O2 、 ![]()
(6) BE
23.减小,增大 t2 时对平衡体系降温 b d
24.
(1)![]() ,
, ; (2)NaOH;浓H2SO4/△
; (2)NaOH;浓H2SO4/△
(3)
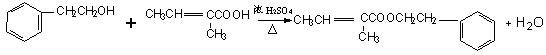 (4)② ⑤ ⑥
(4)② ⑤ ⑥
25.
(1)小 2 (2)液态水中仍然存在大量氢键
(3) 12 1.56
26.
(1) 2NO2 -+ 2I -+ 4H+ =2NO↑ +I2 +2H2O
(2) 2.408×1023 (或0.4NA)
(3)反应生成了NO ,该物质会造成大气污染 ,
还原性 , 强
(4)方法一:取适量样品于两支试管中,分别加入稀盐酸,有气体产生,气体在瓶口变为红棕色的为NaNO2,无明显现象的为NaCl
方法二:取适量样品于两支试管中,分别加入稀盐酸和碘化钾淀粉溶液,若溶液变蓝,证明该物质的是NaNO2;若无明显现象,该物质则是NaCl(其他合理答案也可)(2分)
27. (1)①沸腾炉 吸收塔