高三联合体化学综合练习(七)
( )1.市场上出现了各种各样的营养食盐,如:锌营养盐、钙营养盐、硒营养盐、低钠营养盐、加碘营养盐等十多种营养保健盐。下列说法正确的是:
A.加碘食盐是在食盐中加入了碘单质 B各类营养盐的主要成分都是氯化物
C.钙营养盐是在食盐中加入了氯化钙或碳酸钙等含钙化合物
D.低钠盐中的钠离子比氯离子少,所以低钠盐是一种带负电的物质
( )2.下列事实中,能说明氯元素原子得电子能力比硫元素原子强的是 ①HCl的溶解度比H2S大 ②盐酸的酸性比氢硫酸(H2S水溶液)酸性强 ③HCl的稳定性比H2S大 ④HCl的还原性比H2S强 ⑤HClO的酸性比H2S强 ⑥Cl2与铁反应生成FeCl3,而S与铁反应生成FeS ⑦Cl2能与H2S反应生成S ⑧在元素周期表中Cl处于S同周期的右侧 ⑨还原性:Cl-< S2-
A.③④⑤⑦⑧⑨ B.③⑥⑦⑧ C.③⑥⑦⑧⑨ D.①②③④⑤⑥⑦⑧⑨
( )3.下列现象或应用不能用胶体知识解释的是
A.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
B.向牛油和氢氧化钠溶液共煮后的溶液中加入食盐后有固体析出
C.水泥、冶金工厂常用高压电除去工厂烟尘,减少对空气的污染
D.氯化铝溶液中加入碳酸钠溶液会出现白色沉淀
( )4.X+、Y+、M2+、N2-均为含有一定数目电子的短周期元素的简单离子,离子半径大小关系:N2->Y+、Y+>X+、Y+>M2+,下列比较正确的是
A.原子半径:N可能比Y大,也可能比Y小 B.碱性:M(OH)2>YOH
C.M2+、N2-核外电子数:可能相等,也可能不等 D.原子序数:N>M>X>Y
( )5.在恒温恒容的密闭容器中,发生反应3A(g)+B(g) ![]() xC(g)。 Ⅰ.将3molA和2molB在一定条件下反应,达平衡时C的体积分数为a; Ⅱ.若A、B、C投入的物质的量分别为n(A)、n(B)、n(C),平衡时C的体积分数也为a。下列说法正确的是
xC(g)。 Ⅰ.将3molA和2molB在一定条件下反应,达平衡时C的体积分数为a; Ⅱ.若A、B、C投入的物质的量分别为n(A)、n(B)、n(C),平衡时C的体积分数也为a。下列说法正确的是
A.若Ⅰ达平衡时,A、B、C各增加1mol,则B的转化率将一定增大
B.若向Ⅰ平衡体系中再加入3molA和2molB,C的体积分数若大于a,可断定x>4
C.若x=2,则Ⅱ体系起始物质的量应当满足3 n(B) =n(A)+3
D.若Ⅱ体系起始物质的量当满足3 n(C) +8n(A)==12 n(B)时,可断定x=3
( )6.下列物质提纯、检验、保存的方法正确的是
A.液溴保存在橡皮塞的细口瓶中,并加水液封 B.SO2气体中的少量SO3气体,可用浓硫酸洗气除去
C.检验Na2SO4溶液中是否混有NaCl:加入AgNO3溶液,观察是否有白色沉淀
 D.除去乙酸中混有的乙醇:加入生石灰后蒸馏
D.除去乙酸中混有的乙醇:加入生石灰后蒸馏
( )7.常温下,向O.1mol·L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的质量与加入氢氧化钡溶液的体积关系如右图所示,下列有关说法中正确的是
A.溶液的导电能力:a>b>c>d B.溶液的pH:a<b<c<d
C. b溶液中的H+浓度和d溶液中的OH-浓度相等 D.c溶液和d溶液都呈碱性
( )8.已知25℃、10lkPa条件下:
![]() 由此得出的正确结论是
由此得出的正确结论是
A.等质量的02比O3能量低,由O2变O3为吸热反应 B.O3比02稳定,由02变O3为吸热反应
C.等质量的02比O3能量低,由02变O3为放热反应 D.02比O3稳定,由02变O3为放热反应
( )9.下列离子在溶液中能大量共存,加入(NH4)2Fe(SO4)2·6H2O晶体后,仍能大量共存的是
A.Na+ H+ Cl- NO3- B.K+ Ba+ OH- I- C.Na+ Mg2+ Cl- SO42- D.Cu2+ S2- Br- ClO-
( )10.在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质。下列实验现象和结论一致且正确的是
A.加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在
B.溶液呈黄绿色,且有刺激性气味,说明有Cl2分子存在
C.先加入盐酸酸化,再加入AgNO3溶液产生白色沉淀,说明有Cl-存在
D.加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在
( )11.醋酸钡[(CH3COO)2Ba·H2O]是一种媒染剂,有关0.1mol/L醋酸钡溶液中粒子浓度比较不正确的是
A.c(Ba2+) >c(CH3COO-)>c(OH-)>c(H+)
B.c(H+)+2c(Ba2+)= c(CH3COO-)+c(OH-)
C.c(H+) = c(OH-)-c(CH3COOH) D.2c(Ba2+)= c(CH3COO-)+ c(CH3COOH)
( )12.已知:2Fe2++Br2===2Fe3++2Br-。在100mL FeBr2溶液中通入标准状况下3.36LCl2,Cl2全部被还原,测得溶液中c(Br-)= c(Cl-),则原FeBr2溶液的物质的量浓度是
A.0.75 mol/L B.1.5 mol/L 或2 mol/L C.4 mol/L D.3 mol/L
( )13.下列离子方程式正确的是:
A.向NH4HSO4的稀溶液中逐滴加入Ba(OH)2溶液至刚好沉淀完全:NH4+ + H+ + SO42- + Ba2+ + 2OH- = NH3·H2O + BaSO4↓+ 2H2O
B.少量硝酸银溶液滴入稀氨水中:Ag+ + 2NH3·H2O ==Ag(NH3)2+ + 2H2O
C.向碳酸氢钙溶液中滴入少量澄清石灰水:Ca2+ + 2HCO3- + 2OH- = CaCO3 + 2H2O + CO32-
D. 向次氯酸钠溶液中通入少量的二氧化硫气体:3ClO-+H2O+SO2=2HClO+SO42-+Cl-
( )14.Cl2、SO2均能使品红溶液褪色。后者因为品红分子结构中的发色团遇到亚硫酸后结构发生改变,生成不稳定的无色化合物。其漂白原理可用下面的反应方程式表示:
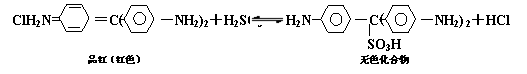 下列说法正确的是
下列说法正确的是
A. 品红溶液中同时通入Cl2、SO2,漂白效果会更好 B.加热不能判断品红褪色是通入SO2还是通入Cl2引起的
C.上述可逆反应中,正反应的△H>0 D.品红分子结构中,19个碳原子都可能在同一平面上
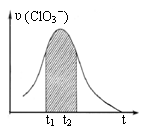 ( )15.KClO3和KHSO3能发生反应:ClO3-+HSO3-→SO42-+ Cl-+ H+(未配平)。已知该反应的速率随c(H+)的增大而加快。右图为用ClO3-在单位时间内物质的量浓度变化表示的该反应υ-t图。下列说法正确的
( )15.KClO3和KHSO3能发生反应:ClO3-+HSO3-→SO42-+ Cl-+ H+(未配平)。已知该反应的速率随c(H+)的增大而加快。右图为用ClO3-在单位时间内物质的量浓度变化表示的该反应υ-t图。下列说法正确的
A.反应开始时速率增大不可能是c(H+)所致
B.纵坐标为υ(Cl-)的υ-t曲线与图中曲线不能完全重合
C.后期速率υ下降的主要原因是反应向逆反应方向进行
D.图中阴影“面积”可以表示t1-t2时间内c(Cl-)增大
( )16.若pH = 3的酸溶液和pH = 11的碱溶液等体积混合后,溶液呈酸性,其原因可能是
A.生成了一种强碱弱酸盐 B.弱酸溶液和强碱溶液反应
| |
( )17.24mL H2S在30mL O2中燃烧,在同温同压下得到SO2的体积为
A.24mL B.30mL C.20mL D.18mL
( )18. 目前,人类已经发现的非金属元素除稀有气体元素外共16种,下列对16种非金属元素的表述正确的有:①都是主族元素,最外层电子数都大于3 ②单质形成的晶体都为分子晶体 ③氢化物常温下都是气态,所以又叫气态氢化物 ④氧化物常温下都可以与水反应生成酸
A.只有①②正确 B.只有①③正确 C.只有③④正确 D.①~④都不正确
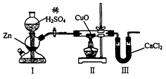 ( )19.用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U型管的质量差,实验测得m(H):m(O)>1:8。下列对导致这一结果的原因的分析中,一定错误的是
( )19.用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U型管的质量差,实验测得m(H):m(O)>1:8。下列对导致这一结果的原因的分析中,一定错误的是
A.I、Ⅱ装置之间缺少干燥装置 B.CuO没有全部被还原
C.Ⅱ装置中玻璃管内有水冷凝 D.Ⅲ装置后缺少干燥装置
( )20.下列各叙述中正确的是 ①元素的相对原子质量是该元素的原子质量与碳原子质量的比值;②质子数相同的微粒均属于同一种元素;③分子是保持物质性质的一种微粒;④原子是物质变化中的最小微粒;⑤同一种元素组成的物质是纯净物;⑥原电池是把化学能转变为电能的装置;⑦有新单质生成的化学反应通常是氧化还原反应
A.都不正确 B.只有①②⑤⑥⑦正确 C.只有①②③④⑤正确 D.只有⑥⑦正确
( )21.以下说法正确的是
A.原子间必须通过电子得失或形成共用电子对而形成化学键,而与原子核无关。
B.非金属元素的原子间只形成共价键,金属元素的原子非金属元素的原子间只形成离子键。
C.原子晶体的原子间只存在共价键,而形成分子晶体的原子间均存在范德瓦耳斯力。
D.原子是化学变化中的最小微粒,意即化学变化不产生新元素,核反应产生了新元素不为化学变化。
22.⑴实验室可利用下图1所示装置来制取气体 (写出两种常见气体的化学式);⑵已知草酸(乙二酸)在受热时发生如下分解反应:H2C2O4 CO+CO2+H2O 。某同学拟用图1的改进装置图2来验证上述反应中有CO2和H2O生成。已知:草酸晶体的化学式为:H2C2O4·2H2O,熔点为100.1℃,分解温度约为170℃~180℃。试结合所学知识,分析该实验设计中的不足之处(至少指出3处)
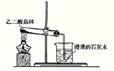
图1 图2
23.下图表示各物质之间的转化关系,其中A、B、C、G为单质。②为工业生产中常见反应,E是一种具有漂白作用的盐,Y易潮解,M是一种两性化合物,L是一种白色沉淀。
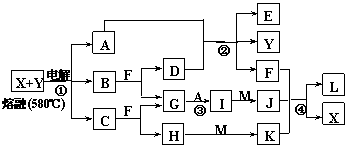 试回答有关问题:
试回答有关问题:
⑴M的化学式 ,Y在实验室中的用途 (列举一例) 。
⑵X的熔点为801℃,实际工业冶炼中常常加入一定量的Y共熔,猜想工业上这样做的目的:
工业生产中,还常常利用电解X和F的混合物制取 。
⑶反应②的化学方程式是
⑷反应④的离子反应方程式是 。
|
(1)第1小组同学认为Na2O2与SO2反应生成了 Na2SO3和O2,该反应的
化学方程式是:
(2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有
Na2SO3
(3)第2小组同学认为Na2O2与SO2反应除了生成Na2SO3与O2外,还有Na2O4生成。为检验是否有Na2O4生成,他们设计了如下方案:
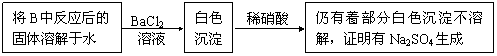
上述方案是否合理? 。请简要说明两点理由:① ;
② 。
25. I.课本中介绍了乙醇氧化的实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。注意闻生成物的气味,并观察铜丝表面的变化。
⑴实验室可用化学方法替代“闻生成物的气味”,写出该化学方法的化学反应方程式
。
⑵某同学在探究“闻生成物的气味”的替代方法时,偶然发现向溴水中加入乙醛溶液,溴水褪色。该同学为解释上述现象,提出两种猜想:①溴水将乙醛氧化为乙酸;②溴水与乙醛发生加成反应。请你设计一个简单的实验,探究哪一种猜想正确?
。
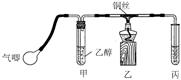 Ⅱ.某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去。实验时,先加热玻璃管中的铜丝,约lmin后鼓入空气。请填写下列空白:
Ⅱ.某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去。实验时,先加热玻璃管中的铜丝,约lmin后鼓入空气。请填写下列空白:
⑴乙醇发生催化氧化的化学反应方程式为
。
⑵实验时,常常将甲装置浸在70℃~80℃的水浴中,目的是 _ ;由于装置设计上的缺陷,实验进行时可能会 ____________
 ⑶反应发生后,移去酒精灯,利用反应自身放出的热量可维持反应继续进行。进一步研究表明,鼓气速度与反应体系的温度关系曲线如图所示。
⑶反应发生后,移去酒精灯,利用反应自身放出的热量可维持反应继续进行。进一步研究表明,鼓气速度与反应体系的温度关系曲线如图所示。
试解释鼓气速度过快,反应体系温度反而下降的原因:
;你认为该实验中“鼓气速度”这一变量可用 来计量。
26.已知![]() (注:R,R’为烃基)
(注:R,R’为烃基)
A为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品。A能发生如下图所示的变化。
 试回答(1)写出
试回答(1)写出
符合下述条件A的同分异构体结构简式(各任写一种):
a.具有酸性 b.能发生水解反应______________________
(2)A分子中的官能团是 ,D的结构简式是 。
(3)C→D的反应类型是___________,E→F的反应类型是___________
a.氧化反应 b.还原反应 c.加成反应 d.取代反应
(4)写出化学方程式:A→B 。
(5)写出E生成高聚物的化学方程式: 。
(6)C的同分异构体Cl与C有相同官能团,两分子Cl脱去两分子水形成含有六元环的C2,写出C2的结构简式:______________________________
27.许多反应在通常情况下不能自发进行,在特定条件下(如通电)就能发生。如以铜棒和石墨棒为电极材料,电解饱和食盐水即可实现下列反应:Cu+2H2O=Cu(OH)2+H2↑。
则铜棒是 极,两极发生反应的反应式分别为:
铜棒 ,石墨 。
28.25℃时,若体积为Va、pH = a某一元强酸与体积为Vb、pH = b某一元强碱混合,恰好中和,且已知Va < Vb和a = 0.5b。请填写下列空白:
(1)a值可否等于3(填“可”或“否”) ,其理由是 。
(2)a值可否等于5(填“可”或“否”) ,其理由是 。
参考答案
1B 2C 3D 4C 5C 6B 7B 8A 9C 10B 11C 12B 13B 14D 15D 16B 17D 18D 19B 20D 21D
22.⑴O2、NH3、CH4等
⑵试管口应向上倾斜大约45°,由于草酸晶体的熔点比其分解温度低,所以晶体在分解之前就已熔化流向试管口而无法继续实验;石灰水变浑浊不一定是草酸晶体受热分解产生的CO2,也可能是乙二酸蒸气溶于石灰水形成的草酸钙沉淀;不能证明草酸分解有水生成。因为使用的是草酸晶体,加热后,草酸晶体失去结晶水,即有水生成;分解产生的CO直接排放到大气中,污染环境。(其它合理答案亦可)
23.⑴Al2O3 用作干燥剂
⑵降低X、Y熔化时的温度, 节约能源 Cl2、H2和NaOH
⑶2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
⑷Al3++3AlO2-+6H2O=4Al(OH)3↓
24.(1)2Na2O2 + 2SO2 = 2Na2SO3 + O2
(2)取白色固体,加稀硫酸,产生能使品红溶液褪色的气体。
(3)不合理,稀硝酸能将亚硫酸钡氧化为硫酸钡
如果反应后的固体中还残留Na2O2,它溶于水后能将亚硫酸根氧化成硫酸根
25.Ⅰ.⑴![]()
![]()
或![]()
![]()
⑵用pH试纸检测褪色后溶液的酸碱性。若酸性,则猜想①正确;反之,猜想②正确(或其它合理方法) 疑点 原溴水中的氢溴酸、次溴酸有没有参与反应,若无反应,溶液呈酸性的原因难以确定。
![]()
Ⅱ.⑴2CH3CH2OH+O2 2CH3CHO+2H2O
⑵使生成乙醇蒸气的速率加快且较均匀 发生倒吸
⑶过量的气体将体系中的热量带走 单位时间内甲中的气泡数
26.(1)a、CH3CH2CH2COOH b、CH3CH2COOCH3
(2)羟基、醛基 CH3COCH2COOH
(3)a; b、c
(4)CH3CHOHCH2CHO → CH3CH=CHCHO+H2O
(5) nCH3CH=CHCH2OH → [-CH-CH]n
(6)CH3CH2CH
27.阳 铜棒:Cu-2e-=Cu2+, 石墨棒:2H++2e-=H2↑
28.(1)否;若a = 3,由a = 0.5b知b = 6,由题设知pH = 6的是一个强碱,与题意不符,故a≠3
(2)否; 若a = 5,c(H+)a = 10-5 mol·L-1,则b = 10, c (OH-)b = 10-4 mol·L-1,
![]() ,不符合题意,故a≠5
,不符合题意,故a≠5