高三联合体化学综合练习(九)
[ ]1.下列关于铜电极的叙述,正确的是
A.铜锌原电池中铜为负极,发生氧化反应 B.用电解法精炼粗铜时,粗铜作阴极
C.在镀件上电镀同时,可用精铜做阳极 D.电解稀硫酸制H2、O2时,可用铜作阳极
[ ]2.固体电解质又称离子导体,在一定温度范围内具有很强的导电性。固体电解质虽然是固体,但却像电解质溶液一样以离子为导电载体。下列物质能作为固体电解质的是
A.银 B.碳素钢 C.硝酸钾晶体 D.水晶
[ ]3. 下列排列顺序正确的一组是
A.半径:Fe(OH)3胶粒>I->K+>Na+ B.熔沸点:HF<HCl<HBr<HI
C.还原性:Fe3+>Cu2+>Fe2+>Zn2+ D.热稳定性:H3PO4<H2SO3<H2SiO3<H2SO4
[ ]4.下列除去括号内杂质的有关操作方法不正确的是:①苯(苯酚):加入NaOH溶液,分液;②乙醇(乙酸):加KOH溶液,分液;③苯(甲苯):加KMnO4/NaOH溶液,蒸馏;④乙烷(乙烯):酸性KMnO4
溶液,洗气;⑤乙酸乙酯(乙酸):加入乙醇和浓硫酸,使乙酸全部转化为乙酸乙酯;⑥淀粉溶液(葡
萄糖):渗析;⑦提取溶解在水中的少量碘:加入CCl4,分液,取出有机层再分离
A.①②④⑤ B.②③④⑤ C.②④⑤ D.④⑤⑥⑦
[ ]5教材是学习的重要材料,但不能迷信教材。下列是从中学化学教材中摘录的部分表述内容,根据你学的化学知识判断,其中不够科学严密的是
A.结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物。
B.离子方程式不仅可以表示一个具体的化学反应,而且还可以表示同一类型的离子反应。
C.元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果。
D.不同的化学反应,具有不同的反应速率,这说明,参加反应的物质的性质是决定化学反应速率的重要因素。
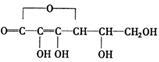
![]() [ ]6. 咖啡酸具有止血、镇咳、祛痰等疗效,其结构简式为
。下列有关咖啡酸的说法中,不正确的是
[ ]6. 咖啡酸具有止血、镇咳、祛痰等疗效,其结构简式为
。下列有关咖啡酸的说法中,不正确的是
A.咖啡酸可以发生还原、取代、加聚等反应 B.咖啡酸与FeCl3溶液可以发生显色反应
C.1 mol咖啡酸可与4 mol H2发生加成反应 D.1 mol咖啡酸最多能消耗3 mol的NaHCO3
[ ]7.信息、材料、能源被称为新科技革命的“三大支柱”。下列有关资讯错误的是
A.在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源
B.目前,中、美、日等国掌握的陶瓷发动机技术,能较大程度地降低能耗,节约能源
C.光缆在信息产业中有广泛应用,制造光缆的主要材料是单质硅
D.结构陶瓷碳化硼(B4C3)常用于制造切削工具,它是一种新型无机非金属材料,属于原子晶体
[ ]8.美国科学家用有机分子和球形笼状分子C60,首次制成了“纳米车”(如图),每辆“纳米车”是用一个有机分子和4个球形笼状分子“组装”而成。 “纳米车”可以用来运输单个的有机分子,生产复杂的材料和药物,成为“纳米生产”中的有用工具。下列说法正确的是
“纳米车”可以用来运输单个的有机分子,生产复杂的材料和药物,成为“纳米生产”中的有用工具。下列说法正确的是
A.我们可以直接用肉眼清晰地看到这种“纳米车”的运动
B.“纳米车”的诞生,说明人类操纵分子的技术进入一个新阶段
C.C60是一种新型化合物 D.C60熔点比金刚石熔点高
[ ]9.氕化锂、氘化锂、氚化锂可以作为长征2号火箭发射的重要燃料,下列说法正确的是
A.H、D、T之间互称同素异形体 B.氕化锂、氘化锂、氚化锂起催化剂作用
C.LiH、LiD、LiT的摩尔质量之比为1﹕2﹕3 D.它们都是强还原剂
[ ]10.在下列各组固体混合物中,等质量的分为两份,将其中一份隔绝空气加强热引发反应,然后分别将反应前与反应后的固体加入足量的稀硫酸中,在相同条件下所得气体的体积不相同的是 (不考虑生成气体在水中溶解)
A.Al和S B.Mg和S C. Al和Fe3O4 D. Al和FeO
[ ]11.下列反应的离子方程式书写错误的是
A.氨水中通入少量二氧化硫 2NH3•H2O + SO2 = 2NH4+ +SO32- +H2O
B.3mol的Cl2通入含2molFeI2的溶液中: 2Fe2++4I-+3Cl2=2Fe3++6Cl-+2I2
 C.次氯酸钙溶液中通入过量二氧化碳
ClO- +CO2 +H2O = HCO
C.次氯酸钙溶液中通入过量二氧化碳
ClO- +CO2 +H2O = HCO![]() -3+ HClO
-3+ HClO
D.A、NaHSO3溶液显酸性是因为:HSO3—==SO32—+H+
[ ]12.抗坏血酸(Vc)的化学式为C6H8O6,结构简式如右图所示。下列有关说法,正确的是 ①Vc能够发生加成、酯化等反应 ②Vc可看做某物质的一种自身酯化产物(内酯) ③Vc本身并不具有酸性,它显示酸性是因为发生了水解 ④Vc从形式上看,可在一定条件下转化为葡萄糖酸
A.①②③ B.①②④ C.②③④ D.全部
[ ]13.0.1mol/LKHSO4和0.1mol/LNa2S溶液等体积混合后,溶液能使pH试纸变蓝,则离子浓度关系正确的是
A.c(SO42-) >c (HS-)>c (OH-) >c (H+) B.c (Na+) > c(K+) > c (H+)> c (OH-)
C.2c (Na+) =c (S2-)+c (H2S)+c (HS-)+c(SO42-)
D.c (Na+)+c(K+)+c (H+)=c(SO42-)+c (S2-)+c (HS-)+c (OH-)
[ ]14.将一定体积的某NaOH溶液分成两等份,一份用pH=3的一元酸HA溶液中和,消耗酸溶液的体积为V1;另一份用pH=3的一元酸HB溶液中和,消耗酸溶液体积为V2,则下列叙述正确的是
A.若V1>V2,则说明HA的酸性比HB的酸性强 B.若V1>V2,则说明HA的酸性比HB的酸性弱
C.因为两种酸溶液的pH相等,故V1一定等于V2
D.若将两种酸溶液等体积混合,混合溶液的pH一定等于2
[ ] 15.我国镍氢电池居世界先进水平,我军潜艇将装备国产大功率镍氢动力电池,常见镍氢电池的某极是储氢合金LaNi5H6(LaNi5H6中各元素化合价均为零),电池反应通常表示为
LaNi5H6+6NiO(OH) ![]() LaNi5+6Ni(OH)2下列说法正确的是
LaNi5+6Ni(OH)2下列说法正确的是
A.放电时储氢合金作正极 B.放电时负极反应:LaNi5H6+6OH--6e- = LaNi5+6H2O
C.充电时阳极周围c(OH-)增大 D.充电时储氢合金作负极
![]() [ ]16.美国科学家设想“绿化”火星并使其成为第二个地球:火星上造超级温室气体。美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”全氟丙烷(C3F8),并提出用其“温室化火星”使其成为第二个地球的计划。有关全氟丙烷的说法正确的是
[ ]16.美国科学家设想“绿化”火星并使其成为第二个地球:火星上造超级温室气体。美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”全氟丙烷(C3F8),并提出用其“温室化火星”使其成为第二个地球的计划。有关全氟丙烷的说法正确的是
A.分子中三个碳原子可能处于同一直线上 B.全氟丙烷的电子式为:
C.相同压强下,沸点:C3F8<C3H8 D.全氟丙烷难溶于水
[ ]17.某混合气体G可能含有CO、CO2、SO2、H2O等气体,用a.无水CuSO4、b.澄清石灰水、c.灼热CuO、d.碱石灰、e.酸性品红溶液、f.酸性高锰酸钾溶液等药品可将其一一检出,检出的正确顺序是
A.G→a→e→b→f→d→c B.G→c→d→b→e→f→a C.G→a→e→f→b→d→c D.G→b→e→f→a→d→c
[ ]18.下列说法中正确的是
A.不可能有非金属单质置换出金属单质的置换反应
B.仅由非金属元素组成的化合物一定是共价化合物C.能用同一通式表示的几种物质一定互为同系物
D.电能与化学能的相互转化过程中一定有新物质产生
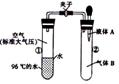 [ ]19.如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了。则液体A和气体B的组合不可能是下列的
[ ]19.如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了。则液体A和气体B的组合不可能是下列的
A.氢氧化钠溶液、二氧化碳
B.水、氨气
C.氢氧化钠溶液、一氧化氮
D.水、二氧化氮
[ ]20.下列离子方程式书写正确的是 ( )
A.二氧化氮溶于水:2NO2+H2O=2H++NO3-+NO
B.将标准状况下112mL氯气通入10mL浓度为1mol·L-1的溴化亚铁溶液中:2Fe 2++4Br-+3Cl2=3Fe3++6Cl-+2Br2
C.次氯酸钙溶液中通入过量二氧化碳:Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO
D.氯化亚铁溶液中加入硝酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑
[ ]21. 溴化碘(IBr)可发生下列反应:①2IBr+2Mg = MgI2+MgBr2 ②IBr+H2O= HBr+HIO,
对上述两个反应的有关说法正确的是
A.①②两个反应都是氧化还原反应 B.在②中IBr既是氧化剂又是还原剂
C.反应①中的MgI2既是氧化产物,又是还原产物 D.在反应①里IBr中的I失电子被氧化
22.某一体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。已知水是生成物之一。
⑴该反应中的还原剂是__________________;⑵该反应中的还原产物是_______________;
⑶写出该反应的化学方程式并标出电子转移方向和数目
⑷若反应过程中转移了0.3 mol电子,则生成水的质量是 。
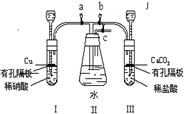 23.为了研究铜与硝酸反应,化学兴趣小组设计了如下实验装置,其中a、b、c是活塞。
23.为了研究铜与硝酸反应,化学兴趣小组设计了如下实验装置,其中a、b、c是活塞。
(1)装药品前,按图装置连接后,如何检验气密性?
______________________________________________________________
(2)按图装药品后,如果开启a和c,关闭b,则II中的现象是
______________________________________________________________
(3)如果将I管中的稀硝酸换成浓硝酸,开启a和c,关闭b,过一会观察,可以看到II里没入水中的导管有气泡冒出,导管内气体呈红棕色,液面上气体为无色,试用文字及方程式解释这一现象:______________ 。
(4)在实验(2)中,要使II里的气体始终保持无色,应该怎样操作?
__ 。
(5)在实验(2)中,如果装置I、II里液面上空间的总体积为VmL,空气中氧气的体积分数为21%,实验在标准状况下进行,全部氧气通过反应转化为硝酸;实验开始时加入的铜为mg,实验完毕后剩余的铜为ng,II中所得溶液的体积也是VmL(不考虑装置外空气的可能进入)。则II中所得溶液的物质的量浓度是_
24.Ⅰ某学生往一支试管中按一定的顺序分别加入下列几种物质(一种物质只加一次):A.KI溶液 B.淀粉溶液 C.NaOH溶液 D.稀H2SO4 E.氯水。发现溶液颜色按如下顺序变化:①无色→②棕黄→③蓝→④无色→⑤蓝。依据溶液颜色的变化,回答下列问题:
(1)加入以上药品的顺序是(写序号) 。
(2)①→②反应的化学方程式为 。
(3)溶液由棕黄色变为蓝色的原因是 。
(4)③→④反应的化学方程式为 。
Ⅱ、金属镁是银白色、有金属光泽的活泼金属,但镁带表面呈现灰黑色。用砂纸磨下镁带表面固体粉末,在空气中强热,有水气生成;另取粉末,加入稀酸,产生气体导入澄清石灰水中,产生混浊。如果将灰黑色灰黑色的镁条在纯氧中点燃,燃烧产物中有黑色物质生成。
(1).预测:镁条表面的灰黑色物质的组成是(填名称.下同) ;黑色燃烧产物是 。
(2).设计实验确定灰黑色物质的具体组成
(3).说明产生黑色燃烧产物的原因,并设计实验确认该产物成分 。
_
25.H是一种香料,可用下图的设计方案合成。
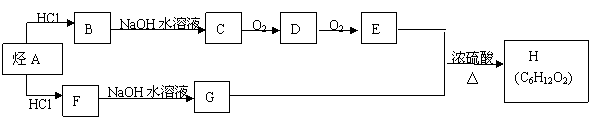
已知:①在一定条件下,有机物有下列转化关系:
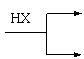 R—CH2—CH2X
R—CH2—CH2X
R—CH=CH2 (X为卤素原子)
R—CHX—CH3
②在不同的条件下,烃A和等物质的量HCl在不同的条件下发生加成反应,既可以生成只含有一个甲基的B,也可以生成含有两个甲基的F。
(1)D的结构简式为 。
(2)烃A→B的化学反应方程式为 。
(3)F→G的化学反应类型是 。
(4)E+G→H的化学反应方程式为 。
(5)H有多种同分异构体,其中含有一个羟基,且其一氯化物有两种的结构简式是:
26.2004年美国火星探测车在火星大气层中检测到了A气体。资料显示,A气体分子是一种三原子分子,其相对分子质量为60.0,在地球环境下A不太稳定,易分解得到一种单质和一种化合物。粉末状的KSCN与浓硫酸在一定条件下可得到气体A和两种硫酸氢盐,生成物的物质的量之比为1∶1∶1
(1)试推测火星大气层的温度,简述你的理由。
(2)试确定A的化学式 。
(3)写出KSCN与浓硫酸反应的化学反应方程式 。
(4)A分解得到一种单质和一种氧化物,写出A分解的化学反应方程式 。
(5)B与SO3反应得到A与一种淡黄色的固体单质。已知B由两种元素组成,A和B分子中原子的最外层电子总数相等,B中两元素的质量比为3∶16。试写出B与SO3反应制备A的化学反应方程式:
。
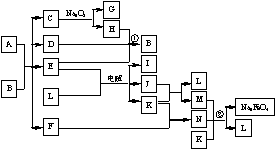 27.A通常存在于钢铁中,它是由甲、乙两种化合物组成的混合物,甲和乙的含量、形状、分布对钢性能影响很大,使钢硬而脆,不宜进行机械加工。已知:(1)甲和乙的组成元素相同,均是由两种常见元素的原子以最简整数比构成的化合物,其相对分子质量分别为124、180。(2)C、D、H、I、J常温下为气体,H、I、J为单质,D是一种红棕色气体。(3)反应②为制备理想的绿色水处理剂Na2FeO4(高铁酸钠)的一种方法。(图中部分生成物没有列出。)请填写以下空白:
27.A通常存在于钢铁中,它是由甲、乙两种化合物组成的混合物,甲和乙的含量、形状、分布对钢性能影响很大,使钢硬而脆,不宜进行机械加工。已知:(1)甲和乙的组成元素相同,均是由两种常见元素的原子以最简整数比构成的化合物,其相对分子质量分别为124、180。(2)C、D、H、I、J常温下为气体,H、I、J为单质,D是一种红棕色气体。(3)反应②为制备理想的绿色水处理剂Na2FeO4(高铁酸钠)的一种方法。(图中部分生成物没有列出。)请填写以下空白:
⑴写出C的电子式 。
⑵写出反应①的化学方程式 。反应②的离子方程式 。
⑶甲和乙的化学式分别为 、 ,若A中组成元素的物质的量之比为4∶9,则乙在A中的物质的量分数为 。
28.在一个体积为2L的密闭容器中,高温下发生下列反应:C(s) + H2O(g) ![]() CO(g) + H2(g)
CO(g) + H2(g)
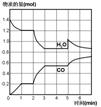 其中,H2O、CO的物质的量(mol)随时间(min)的变化曲线如下图所示。
其中,H2O、CO的物质的量(mol)随时间(min)的变化曲线如下图所示。
(1)写出上述反应的平衡常数表达式: 。
(2)计算第1min内v(H2O)= 。
(3)反应处于平衡状态的时间是 。
(4)若反应进行至2min时,改变了温度,使曲线发生了如右图所示的变化,则温度是 (填“升高”、“降低”或“不变”),正反应是 (填“吸”或“放”)热反应。
(5)反应至5min时,若也只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是下述中的 (填写编号)。①增加了CO ②增加了水蒸气 ③加了催化剂 ④扩大了容器体积
参考答案
1C 2C 3A 4C 5A 6D 7C 8B 9D 10C 11D 12D 13C 14A 15B 16A 17C 18D 19C 20D 21C
22. (1)H2S (2)NO (3)(共3分,方程式2分,电子转移方向数目1分) (4)3.6 g (无单位不给分)
23.(1)方法一:开a、b、c,在两边的长颈漏斗中加水浸没端口,然后关c,继续加水,在长颈漏斗的颈部保留一段水柱,观察水柱液面,如果液面不下降,则气密性好。
方法二:开a、c,关b,在I中加水浸没长颈漏斗的端口,然后关c,继续加水,在长颈漏斗的颈部保留一段水柱,观察水柱液面,如果液面不下降,则气密性好;开b、c关a,同以上操作检查装置III的气密性。
(2)导管口有气泡冒出,液面上气体转化为红棕色。
(3)红棕色的NO2与水反应生成无色的NO气体。3NO2+H2O=2HNO3+NO
(4)关a开b、c,经过一定的时间,待II中的空气全部排出后,关b开a、c。
(5)0.0125mol/L
24.Ⅰ、(1)A→E→B→C→D (2)2KI+Cl2==2KCl+I2
(3)淀粉遇碘变蓝色 (4)I2+2NaOH=NaI+NaIO+H2O
Ⅱ、1.碱式碳酸镁 碳
2.将镁带表面固体粉末在空气中强热,产物先用浓硫酸吸收,再用碱石灰吸收,确定增重质量的比值。
3.镁与热分解产生的CO2反应
黑色燃烧产物难溶于稀硫酸中,在浓硫酸中加热溶解,产生刺极性气味气体
![]() 25.(1)CH3CH2CHO
25.(1)CH3CH2CHO
(2)CH3CH=CH2+HCl CH3CH2CH2Cl。
 (3)取代反应(或“水解反应”
(3)取代反应(或“水解反应”
(4)CH3CH2COOH+CH3CHOHCH3 CH3CH2COOCH(CH3)2+H2O。
CH3
(5)CH3—C—CH2—COOH
CH3
26.(1)火星表面温度低。理由:若较高,COS会分解。
(2)COS 或SOC 或CSO等(只要元素及原子个数正确即可 )
(3)KSCN+2H2SO4(浓)+H2O=KHSO4+NH4HSO4+COS↑
(4)COS =S +CO
(5)3CS2+SO3=3COS+4S
27.⑴![]()
⑵4NO2+O2+2H2O=4HNO3 2Fe(OH)3 +3ClO- + 4OH- = 2FeO42- +2Cl-+5H2O
⑶Fe2C Fe3C 25%
28.(1)K=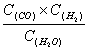 (2)0.1mol·L—1·min—1
(2)0.1mol·L—1·min—1
(3)1min—2min,3min—5min (4)升高,吸 (5)②