高中三年级化学下学期教学质量监测(二)
化 学 试 卷
命题:孟祥英 邵明升 马明阳
主审:黄 南
一、选择题
6.生活中碰到的某些问题常常涉及到化学知识,下列叙述中错误的是
A.凡含有食品添加剂的食物对人体健康均有害,不宜食用
B.废弃的塑料,金属、纸制品及玻璃都是可回收再利用的资源
C.造成大气污染的SO2、CO和NO,主要来源于煤的燃烧和汽车排放的尾气
D.变质的油脂有难闻的特殊气味,是由于油脂发生了氧化反应
7.黄曲霉素AFTB(右图所示)是污染粮食的真菌霉素。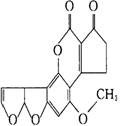 人类的
人类的
特殊基因在黄曲霉素作用下会发生突变,有引发肝癌的可能性。
O
![]()
(已知R-C-R′可以在一定条件下可与H2加成)关于黄曲霉素
的说法正确的是
A.该化合物的分子式为C16H11O6
B.该化合物水解可生成醇类化合物
C.一定条件下,1mol该化合物最多可与6molH2发生反应
D.该化合物易溶于水,不能被酸性高锰酸钾氧化
8.已知阴离子A2-的原子核内有x个中子,A原子的质量数为m,则Wg A2-含有电子的物质的量为
A.![]() B.
B.![]()
C.![]() D.
D.![]()
9.下列实验操作正确的是
A.测定中和热实验中,读取混合溶液的最高温度为终止温度
B.中和滴定时,应用待测液润洗滴定管和锥形瓶
C.做焰色反应实验时,将铂丝用蒸馏水洗净后直接蘸取药品
D.配制银氨溶液时,应将硝酸银溶液滴到稀氨水中
10.下列离子方程式正确的是
A. NaHCO3溶液和NaOH溶液混合 HCO3-+OH-=CO2↑+H2O
B.将少量的二氧化硫气体通入次氯酸钠溶液中 SO2 + H2O +2ClO- = SO32- + 2HClO
C.氯化铝溶液中加入过量氨水:Al3+ + 4NH3•H2O = AlO2- + 4NH4+ + 2H2O
D.苯酚钠溶液中通入CO2 C6H5O-+CO2+H2O = C6H5OH + HCO3-
11.右表为元素周期表前四周期的一部分,下列有关A、B、C、D、E、F六种元素的叙述正确的是
|
B.晶体E中不存在化学键
C.D元素的非金属性比B元素的非金属性强
D.单质A、C均没有同素异形体
12.反应2SO2(g)+O2(g)≒2SO3(g);⊿H<0为工业制备硫酸的关键步骤。下列对于该反应的反应条件解释错误的是
A.该反应需使用催化剂,使用催化剂有利于加快反应速率
B.实际生产中该反应在常压下进行,因为高压不利于SO3生成
C.该反应温度控制在400℃~500℃,因为反应速率和SO2的平衡转化率比较理想
 D.该反应采用过量的空气,有利于提高SO2的转化率
D.该反应采用过量的空气,有利于提高SO2的转化率
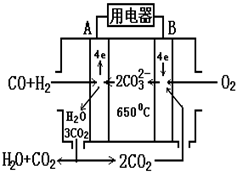
13.熔融碳酸盐燃料电池(MCFS),发明于1889年。现有一个碳酸盐
燃料电池,以一定比例Li2CO3和Na2CO3低熔混合物为电解质。操
作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2)直
接作燃料,其工作原理如图所示。下列判断错误的是
A.燃料电池是一种高效、环境友好的发电装置
B.B极为正极,发生还原反应,该电极反应为2CO2 + O2 + 4e―= 2CO32―
C.B极为正极,发生还原反应,该电极反应为2H2O + O2 + 4e―= 4OH―
D.燃料电池与干电池不同,不需要将反应物储存在电池内部
26.(15分)下列所述各微粒都是由短周期元素组成的。
(1)由两种短周期元素组成的A、B两种分子,分子中电子总数均为18个且相对分子质量相同。若A、B能发生氧化还原反应,生成黄色的固体单质。请写出该反应的化学方程式______________________________;反应中若生成1 mol该单质,则转移电子的个数约为_____。
(2)己知肼(H2N—NH2)和甲胺(CH3—NH2)都是18个电子的分子,根据肼和甲胺的结构特点,写出两种具有18个电子的有机化合物的结构简式 ___________,
(3)有X、Y、Z、W四种短周期元素,原子序数依次增大,其核电荷数总和为38。W与Z为同周期;W和Y不属同一主族;Y元素原子最外层电子数占核外总电子数的3/4; W元素原子最外层电子比Z元素多5个电子。请写出由Z、W两元素组成的化合物的电子式_________________
(4)由X和Y两元素可形成C+、D-、E三种微粒(分子或离子),它们都分别含有10个电子,巳知它们有如下转化关系D-+C+ =2E;请写出与微粒D-组成完全相同但不带电的另一种微粒的电子式
27.(15分)下图各物质是中学化学中常见的物质,甲、乙、丙、丁均是离子晶体,其中甲、乙晶体分别含有四种元素,且阴阳离子个数比为1:1。B、D常温下是气体,反应①是工业生产中很重要的反应,戊是一种弱碱。E是一种弱酸,且是白色胶状沉淀。请回答下列问题
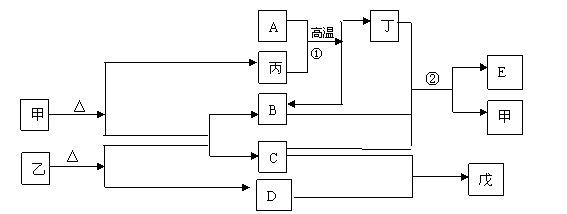

(1) 甲的俗名是 上述物质中属于原子晶体的是(填化学式)
(2) 写出戊的电离方程式
(3) 反应①、②中有一个反应能说明A、B的水化物的酸性强弱关系,请写出该反应的方程式(若是离子反应则写离子方程式) ________________
(4) 相同条件下,等物质的量浓度的甲、乙、丙溶液中所含二价阴离子物质的量浓度从大到小依次是 _________
28.(15分)某课外活动小组利用下图装置进行乙醇(沸点78.5℃)的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去。实验时,先加热玻璃管中的铜丝,约lmin后鼓入空气。请回答下列问题
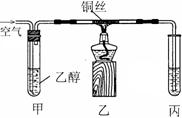 (1)实验时,常常将甲装置浸在70℃~80℃的水浴中加热,甲装置的作用是
______________; __________ ____________
(1)实验时,常常将甲装置浸在70℃~80℃的水浴中加热,甲装置的作用是
______________; __________ ____________
(2)由于装置丙设计上的缺陷,实验进行时可能会 ____________
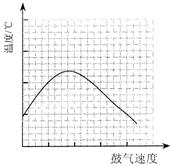 (3)反应发生后,移去酒精灯,利用反应自身放出的热量可维持反应继续进行。进一步研究表明,鼓气速度与反应体系的温度关系曲线如图所示。试解释鼓气速度过快,反应体系温度反而下降的原因
(3)反应发生后,移去酒精灯,利用反应自身放出的热量可维持反应继续进行。进一步研究表明,鼓气速度与反应体系的温度关系曲线如图所示。试解释鼓气速度过快,反应体系温度反而下降的原因
(4)某同学偶然发现向溴水中加入乙醛溶液,溴水褪色。该同学为解释上述现象,提出两种猜想:①溴水将乙醛氧化为乙酸;②溴水与乙醛发生加成反应。请你设计一个简单的实验,探究哪一种猜想正确?(不考虑溴与水的反应)
29.(15分)已知:① ![]()
② CH3COOCH2CH2OH的名称为乙酸羟乙酯。
软性隐形眼镜可由聚甲基丙烯酸羟乙酯(HEMA)制成超薄镜片,其合成路线如下
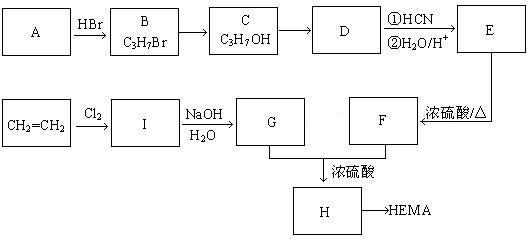
 请回答下列问题
请回答下列问题
(1)写出I、E的结构简式 I 、E
(2)写出E→F反应的反应类型
(3)写出A→B反应的化学方程式 ;
(4)写出满足a.能发生银镜反应;b.能与碱发生中和反应;c.分子结构中无甲基;上述三个条件的H的同分异构体的结构简式____________________
化学参考答案
| 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| A | C | D | A | D | B | B | C |
26.(15分)
(1)H2S+H2O2=2H2O+S↓;(3分) 2×6.02×1023;(3分)
|
|
|
(3)[:Cl:]-Mg2+[:Cl:]-;(3分) (4)·O:H; (3分)
27.(15分)
(1) 小苏打;(2分) SiO2;(3分)
(2) NH3•H2O ≒NH4++OH- (3分)
(3) SiO32-+CO2+H2O=H2SiO3+HCO3-; (3分)
(4) 丙>甲>乙 (3分)
28.(15分)
(1)生成乙醇蒸气;控制空气的流速;让空气与乙醇蒸气充分混合(其它合理答案也给分)
(答对一个给3分,答对两个给6分)
(2)发生倒吸; (3分)
(3)过量的气体将体系中的热量带走;(3分)
(4)用pH试纸检测褪色后溶液的酸碱性。若酸性则①正确;反之则②正确。(3分)
(其它合理答案也给分)
![]() 29.(15分)
OH
29.(15分)
OH
(1)I:CH2ClCH2Cl;(3分) E:CH3 CH3;(3分)
(2)消去;(3分) COOH
(3)CH2=CHCH3+HBr → CH3CHBrCH3;(3分)
(4)OHCCH2CH2CH2 CH2COOH;(3分)