高中毕业班化学第一次质量预测
说明:本试卷分为第Ⅰ卷和第Ⅱ卷,考试时间90分钟,满分100分。请将第Ⅰ卷试题的正确答案用ⅡB铅笔填涂在答题卡上,将第Ⅱ卷试题的正确答案写在试卷对应的空白处,考试结束时只交答题卡和第Ⅱ卷试卷。
可能用到的相对原子质量: O-16 S-32 Na-23 Mg-24 Al-27
第Ⅰ卷(选择题,共45分)
(本题包括15小题,每小题3分,每小题只有一个选项符合题意)
1.物质发生化学反应时:①电子总数 ②原子总数 ③分子总数 ④物质的种类 ⑤物质的总质量 ⑥物质的总能量,反应前后肯定不发生变化的是 ( )
A.①②⑤ B.②③⑥ C.①②③ D.④⑤⑥
2.根据下列事实所列出的相应结论正确的是
| 实 验 事 实 | 结 论 | |
| A | NH3的水溶液可以导电 | NH3是电解质 |
| B | SO2通入硝酸钡溶液出现白色沉淀 | BaSO3不溶于强酸 |
| C | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 酸性:>Al(OH)3 |
| D | 常温下白磷可自燃而氮气须在放电时才与氧气反应 | 非金属性:P>N |
3.类推的思维方法在化学学习和研究中是一种常用的思维方法,但有时会产生错误的结论,因此类推出的结论最终要经过实践检验才能决定其正确与否。下列几种类推结论中正确的是
A.晶体中有阴离子,必有阳离子;则晶体中有阳离子,也必有阴离子
B.Fe3O4可写成FeO·Fe2O3;Pb3O4也可写成PbO·Pb2O3
C.由于HF分子间存在氢键,其沸点反而高于HCl;NH3间也存在氢键,其沸点也应高于PH3
D. 1molNaCl在水溶液中可电离产生1mol Na+;则1mol FeCl3在水溶液中也能电离产生1molFe3+
4.向NaBr、NaI、Na2SO3混合液中,通入—定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是
A NaCl NaI Na2SO4 B NaCl Br2 Na2SO4
C NaCl Na2SO4 I2 D NaCl Na2SO4
5.下列各组离子在溶液中可以大量共存,当溶液呈强酸性时,有气体产生;而当溶液呈强碱性时,又能生成沉淀。该组离子可能是
A.Na+、Cu2+、NO3-、CO32- B.NH4+、K+、SO42-、HCO3-
C.Mg2+、NH4+、SO42-、Cl- D.Fe2+、Na+、SO42-、NO3-
6.下列说法正确的是
A.100mL、2 mol·L-1的Na2SO4溶液和400 mL 、4 mol·L-1的NaCl溶液中c(Na+)不同
B.标准状况下,2.24LNO与N2的混合气中所含分子数为0.1NA
C. 常温常压下, 1 molD3O+中所含中子数为10NA
D.一定条件下使200mL 1mol/L Al2(SO4)3溶液中的Al3+全部水解,产生Al(OH)3胶粒的个数约6.02×1023
7、有关下列各装置图的叙述,不正确的是
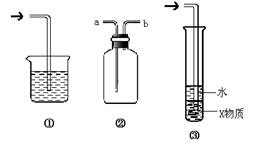
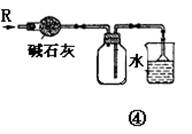
A.装置①可用于吸收实验中多余的Cl2
B.装置②可用于收集H2、NH3、Cl2、HCl、NO2等
C.装置③中X为苯,可用于吸收氨气或氯化氢
D.装置④可用于收集氨气,并吸收多余的氨气
8.下图为含同一元素的a、b、c、d、e五种物质的转化关系。其中a是单质,b是气态氢化物,c、d是氧化物,e是该元素最高价氧化物对应的水化物,则a可能是①C ②N2 ③S ④F2中的
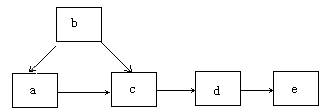
A.只有①和③ B.只有④ C.①②③ D.①②③④
9. 已知酸性条件下有如下反应:2Cu+ == Cu2+ + Cu 。用氢气还原氧化铜时由于反应温度不同,可能产生Cu或Cu2O,两者都是红色固体。一同学对某次用氢气还原氧化铜实验所得红色固体产物作了验证,实验操作和实验现象记录如下:
| 加入试剂 | 稀硫酸 | 浓硫酸、加热 | 稀硝酸 | 浓硝酸 |
| 实验现象 | 红色固体 和蓝色溶液 | 无色气体 | 无色气体 和蓝色溶液 | 红棕色气体 和绿色溶液 |
由此推出本次氢气还原氧化铜实验的产物是
A. Cu B.Cu2O
C.一定有Cu,可能有Cu2O D.一定有Cu2O,可能有Cu
10.将下列5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上______+______→______+______+______+H2O组成一个未配平的化学方程式,正确的顺序是
A. FeSO4、Fe(NO3)3;Fe2(SO4)3、HNO3 、N2O
B. HNO3、FeSO4;Fe2(SO4)3、Fe(NO3)3、N2O
C. HNO3、Fe2(SO4)3;FeSO4、Fe(NO3)3、N2O
D. Fe2(SO4)3、N2O;FeSO4、HNO3 、Fe(NO3)3、
11.始祖鸟烯(Pterodactyladiene),形状宛如一只展翅飞翔的鸟,其键线式如右图,其中R1、R2为烷 烃基。则下列有关始祖鸟烯的说法中正确的是
烃基。则下列有关始祖鸟烯的说法中正确的是
A.始祖鸟烯与乙烯互为同系物
B.若R1=R2=甲基,则其化学式为C12H16
C.若R1=R2=甲基,则始祖鸟烯的一氯代物有3种
D.始祖鸟烯既能使酸性高锰酸钾褪色,也能使溴水褪色,则两反应的反应类型是相同的
12.下列用来表示物质变化的化学用语中,正确的是:
A.表示氢气燃烧的热化学方程式:2 H2(g)+ O2(g)==2 H2O(1);△H= +571.6 kJ/mol
B.钢铁腐蚀时可能发生的正极反应:2H2O+O2+4e-===4OH-
C.明矾水解的离子方程式:Al3++3 H2O===Al(OH)3+3H+
D.碳酸氢钙溶液与过量氢氧化钠溶液混合的离子方程式: Ca2++HCO3- +OH-== CaCO3↓+H2O
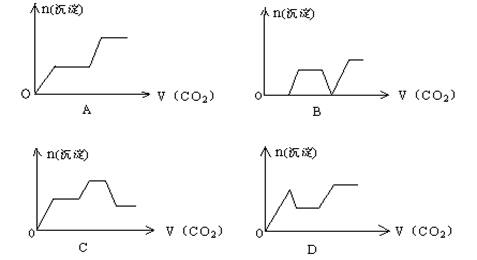
13.将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为
14.下图是某同学设计的验证原电池和电解池的实验装置,下列有关说法不正确的是
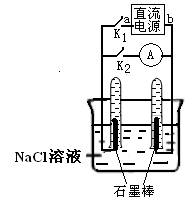
A.关闭K2、打开K1,试管内两极都有气泡产生
B.关闭K2、打开K1,一段时间后,发现左侧试管收集到的气体比右侧略多,则a为负极,b为正极
C.关闭K2、打开K1,一段时间后,用拇指堵住试管移出烧杯,向试管内滴入酚酞,发现左侧试管内溶液变红色,则a为负极,b为正极
D.关闭K2、打开K1,一段时间后,再关闭K1、打开K2,电流计指针不会偏转
15.已知t℃时,盐M(不含结晶水,式量为126)的溶解度为S g。在一定量的M的水溶液中加入a g M后,恰好为t℃时的饱和溶液。若用M·7H2O代替M,欲使原溶液在t℃时恰好饱和,则需加入M·7H2O的质量(g)为
A、2a
B、(2+![]() )a C、
)a C、![]() D、(1+
D、(1+![]() )a
)a
2007年高中毕业班第一次质量预测
化学
| 题号 | 16 | 17 | 18 | 19 | 20 | 21 | 总分 |
| 得分 |
|
|
|
|
|
|
|
第Ⅱ卷(非选择题,共55分)
(本卷包括6小题)
16.(7分)A~G是几种烃的分子球棍模型,据此回答下列问题
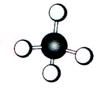
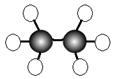
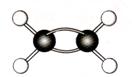
![]()
A B C D
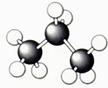
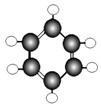
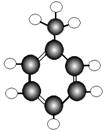
E F G
(1)常温下含碳量最高的气态烃是 ;
(2)能够发生加成反应的烃有 种;
(3)一卤代物种类最多的是(填对应字母) ;
(4)写出实验室制取C的化学方程式 ;
(5)写出F发生溴代反应的化学方程式 。
17 (9分)A、B、C和D代表原子序数依次增大的四种短周期元素,它们满足以下条件:①C的原子序数是A、B的原子序数之和,A、C、D的最外层电子数之和为13;②D的原子序数是C的2倍,D的最高价氧化物对应的水化物是二元强酸。请填空:
(1)A是 元素, D单质形成的晶体属于 (填晶体类型);
(2)B单质的电子式为 ,画出C元素的原子结构示意图 ;
(3)写出一个由B单质转化为其化合物的化学方程式: ;
(4)已知:由A、B、C、D 四种元素组成的两种化合物在水溶液中反应可生成一种无色有刺激性气味的气体,则这两种化合物都是由 键构成,试写出该反应的离子方程式: 。
18(8分).如下图,甲、乙、丙分别表示在不同条件下可逆反应
A(g)+B(g)![]() x C(g) 的生成物C在反应混合物中的百分含量(C%)和反应时间(t)的关系。
x C(g) 的生成物C在反应混合物中的百分含量(C%)和反应时间(t)的关系。
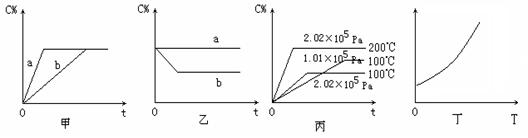

(1)若甲图中两条曲线分别表示有催化剂和无催化剂的情况,则 曲线表示无催化剂时的情况,原因是 ;
(2)若乙图表示反应达到平衡后分别在恒温恒压条件下和恒温恒容条件下向平衡混合气体中充入He气后的情况,则 表示恒温恒容的情况,原因是
;![]()
(3)根据丙图可以判断该可逆反应的正反应是 热反应,计量数x的值 ;
(4)丁图表示在某固定容积的密闭容器中上述可逆反应达到平衡后某物理量随着温度(T)的变化情况,根据你的理解,丁图的纵坐标可以是 ,原因为
。
| 座号 |
19(6分).
(1)常温下,0.1mol·L-1的醋酸和0.1mol·L-1的盐酸各100mL分别与足量的锌粒反应,产生的气体前者比后者
(2)常温下,0.1mol·L-1的醋酸和PH=1的醋酸各100mL分别与足量的锌粒反应,产生的气体前者比后者
(3)在25℃条件下将pH=5的氯化铵溶液稀释100倍,稀释后溶液的pH为(填序号字母,下同)______。 A.5 B.7 C.3~5之间 D.5~7之间
(4)25℃时,向![]() 的醋酸溶液中加入少量醋酸钠晶体,当晶体溶解后测得溶液pH将
。 A、增大 B、减小 C、不变 D、无法确定
的醋酸溶液中加入少量醋酸钠晶体,当晶体溶解后测得溶液pH将
。 A、增大 B、减小 C、不变 D、无法确定
(5)室温下,向0.1mol·L-1的H2SO4中加入足量的锌粒,若想减慢制取H2的速率,但又不影响H2的体积,可以向硫酸溶液中加入 试剂
A、碳酸钠晶体 B、醋酸钠晶体 C、滴加少量硫酸铜溶液 D、水
20(10分).甲、乙、丙是前18号元素形成的常见单质,A、B、C、D是前18号元素形成的不同化合物,甲、乙、丙和A、B、C、D有如下图所示的转化关系,丙是生命活动须臾不可缺少的气态单质,请回答下列问题:
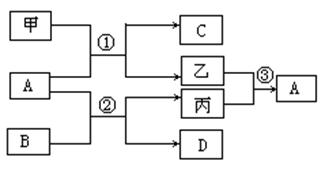
(1)若甲为金属单质,A常温下为气体,则A的化学式为 ,写出反应①的化学方程式: ;
标出反应②电子转移的方向和数目:
。
(2)若甲为非金属单质,A常温下为液态,则A的电子式为 , C的化学式为 ,
指出B的一种用途 ,写出反应②的离子方程式:
21(15分).用如图1所示装置进行相关实验(夹持仪器省略),回答下列问题:
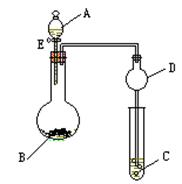
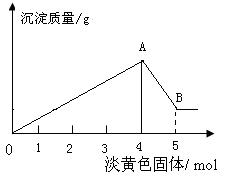
图1 图2
(1)图1中D装置在实验中的作用是 ,实验前检查该装置气
密性的方法是 ;
(2)如图1,将液体A逐滴加入到固体B中即产生气体,该气体可以是(填化学式,少于3种不得分) ;
(3)如图1,若A为浓盐酸,B为MnO2,C容器中盛KI淀粉溶液,旋开E后,给烧瓶加热,一段时间后C中的现象是 ,写出烧瓶中发生反应的化学方程式 ;
(4)如图1,溶液A中可能含有Mg2+ 、Cu2+ 、Al3+ 、Fe 3+四种阳离子,B为淡黄色固体,旋开E后,有气体放出和白色沉淀产生,淡黄色固体的物质的量与产生沉淀的物质的量的关系如图2所示,则溶液中含有的阳离子有 ; 写出 图中曲线A~B 段反应的离子方程式 ;求A溶液中存在的阳离子的物质的量浓度之比,并写出计算过程。
高中毕业班第一次质量预测(化学)
参考答案及评分细则
第I卷
1.A 2.C 3.B 4.D 5.D 6.B 7.C 8.C 9.D 10.B
11.C 12.B 13.C 14.D 15.B
第II卷
![]() 16(7分).(1)D(1分)(2)4种(1分)(3)G(1分)
16(7分).(1)D(1分)(2)4种(1分)(3)G(1分)
(4)CH3CH2OH CH2=CH2↑+H2O (2分)
![]() (5)
(5)![]() +Br2
+ HBr (2分)
+Br2
+ HBr (2分)
![]()
![]()
![]() 17 (9分)(1)氢或H(1分),分子晶体(1分) (2) (1分) (1分)
17 (9分)(1)氢或H(1分),分子晶体(1分) (2) (1分) (1分)
(3)N2+3H2![]() 2NH3 或 N2+O2
2NO或3Mg+ N2
Mg3N2
2NH3 或 N2+O2
2NO或3Mg+ N2
Mg3N2
或其它合理答案 (2分)
(4) 离子键(或离子键和共价键,或离子键、共价键和配位键)(1分)
SO32-+2H+=SO2↑+H2O 或HSO3-+ H+=SO2↑+H2O (2分)
或写SO32-+2HSO4-= SO42-+SO2↑+H2O 或 HSO3-+ HSO4- = SO42-+SO2↑+H2O 也可
18(8分).(1)b (1分) b达到平衡所用时间长,说明b的反应速率小于a (1分)
(2)a (1分) ,a中充入He气,C%不变,平衡不移动(1分)
(3)吸 (1分) 大于2 (>2)或大于等于3(≥3)(1分)
(4)C%或转化率或产率或压强等 (1分)
温度升高,平衡向吸热方向即正反应方向移动 (1分)
![]() 19(6分).(1)相等(1分)(2)少(1分)(3)D(1分)(4)A(1分)(5)B、D(2分)
19(6分).(1)相等(1分)(2)少(1分)(3)D(1分)(4)A(1分)(5)B、D(2分)
20(10分). (1)CO2(1分),2Mg + CO2
2MgO + C (2分)
(1)CO2(1分),2Mg + CO2
2MgO + C (2分)
(2分)
![]() (2) (1分) , CO(1分), 供氧剂、漂白剂、氧化剂任答一种 (1分)
(2) (1分) , CO(1分), 供氧剂、漂白剂、氧化剂任答一种 (1分)
2Na2O2+ 2H2O == 4Na+ +4OH-+O2↑(2分)
21(15分).(1)防止溶液倒吸(1分);关闭E,用手捂热(或微热)烧瓶,若导管口有气泡放出,松开手后,导管内有一段水柱回升,则说明装置气密性良好 (1分)。
(2)CO2、H2、O2、NO2、H2S、SO2、C2H2等中的任意三种即得分 (1分)
(3)溶液变蓝色(答溶液变蓝色后又褪色不扣分)(1分),
![]() MnO2
+ 4HCl
MnCl2+ Cl2↑+ 2H2O (2分)
MnO2
+ 4HCl
MnCl2+ Cl2↑+ 2H2O (2分)
(4)Mg2+、Al3+ (2分),Al(OH)3+ OH-=AlO2-+2H2O (2分)
或 2Na2O2+2H2O=4Na++4OH- + O2↑, Al(OH)3+ OH-=AlO2-+2H2O
解:由图可知A~B段溶解Al(OH)3消耗的Na2O2为1mol,则NaOH为2mol,
根据反应方程式 Al(OH)3+ NaOH=NaAlO2+2H2O
知Al(OH)3的物质的量为2mol,Al3+也为2mol。 (2分)
OA段生成沉淀所消耗Na2O2为4mol,需NaOH为8mol,
而2mol Al3+生成Al(OH)3沉淀消耗NaOH 6mol,
则Mg2+消耗NaOH 2mol, Mg2+的物质的量为1mol (2分)
故Mg2+与Al3+的物质的量之比为1:2,
即Mg2+和Al3+的物质的量浓度之比为1:2 。 (1分)
(其它合理格式可酌情给分)