(化学部分)
高三化学三诊能力测试试题
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Al 27 Fe 56 Cl 35.5
第I卷答题栏(选择题,共48分)
| 题号 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 |
|
|
|
|
|
|
|
|
一、选择题(本题包括13小题。每小题只有一个选项符合题意。)
6.生活中的某些问题常常涉及化学知识。下列有关叙述不正确的是
A.甲醛是某些劣质装饰板材释放的常见污染物之一
B.棉花和蚕丝的主要成分都是蛋白质
C.臭氧是饮用水的理想消毒剂之一,因为它杀菌能力强且又不影响水质
D.“水滴石穿”主要是溶解了CO2的雨水与CaCO3长期作用,生成了可溶性的Ca(HCO3)2
7. 下列离子方程式中正确的是
A.少量CO2通入苯酚钠溶液中:![]()
B.向NaHSO4溶液中逐滴加入Ba(OH)2溶液,至![]() 沉淀完全:
沉淀完全:
2H++![]() +Ba2++2OH-=BaSO4↓+2H2O
+Ba2++2OH-=BaSO4↓+2H2O
C.Fe(OH)3溶解于氢碘酸(HI)溶液中:Fe(OH)3+3H+=Fe3++3H2O
D.钢铁吸氧腐蚀的正极反应:4OH—-4e—=O2↑+2 H2O
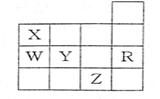
8.右表为元素周期表前四周期的一部分,下列有关R、W、
|
A.常压下五种元素的单质中,Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子相同
C.Y元素的非金属性比W元素的非金属性强
D.W的氢化物的沸点X的氢化物的沸点高
9.NA为阿伏加德罗常数,下列叙述正确的是 ( )
A.标准状况下11.2L臭氧中含NA个氧原子
B.1.8g重水(D2O)中含NA个中子
C.1 mol FeCl3转化成Fe(OH)3胶体时,有NA个Fe(OH)3胶粒生成
D.a mol Cl2与足量烧碱溶液完全反应转移的电子数为a NA
10. ![]() 时,某物质的水溶液中由水电离出来的
时,某物质的水溶液中由水电离出来的![]() 为
为![]() ,下列说法正确的是
,下列说法正确的是
A.![]() < 7时,水的电离被抑制 B.
< 7时,水的电离被抑制 B.![]() > 7时,水的电离被抑制
> 7时,水的电离被抑制
C.![]() > 7时,溶液的
> 7时,溶液的![]() 一定为
一定为![]() D.
D.![]() < 7时,溶液的
< 7时,溶液的![]() 一定为
一定为![]()
11.维生素C是具有抗衰老作用,在空气中容易被氧化。在新鲜水果,蔬菜,乳制品中含丰富的维生素C,某课外小组的同学利用碘滴定法测定某橙汁中维生素C的含量,反应的化学方程式为:
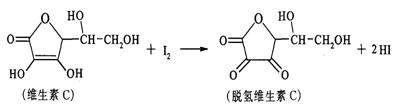
下列说法正确的是( )
A.上述反应为取代反应。 B.维生素C不能发生水解
C. 滴定时可用淀粉做指示剂 D.维生素C遇FeCl3溶液发生显色反应。
12.关于下列各装置图的叙述中,不正确的是( )
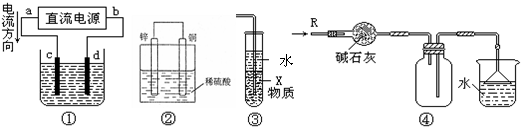 A.若采用装置①精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液。
A.若采用装置①精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液。
B.装置②是原电池,能将化学能转化为电能,锌电极发生氧化反应
C.装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸
D.装置④可用于干燥、收集氨气,并吸收多余的氨气
13.有下列五个化学方程式(X、Y、Z均为正值):
![]() ①C2H2(g)+H2(g) C2H4(g)
①C2H2(g)+H2(g) C2H4(g)
| |
![]() ③C(s)+2H2(g) CH4(g);△H=-X kJ·mol—1
③C(s)+2H2(g) CH4(g);△H=-X kJ·mol—1
![]() ④C(s)+
④C(s)+![]() H2(g)
H2(g) ![]() C2H2(g);△H=-Y kJ·mol—1
C2H2(g);△H=-Y kJ·mol—1
![]() ⑤C(s)+H2(g)
⑤C(s)+H2(g) ![]() C2H4(g);△H=-Z kJ·mol—1
C2H4(g);△H=-Z kJ·mol—1
当温度下降时①式平衡向右移动,②式平衡向左移动。据此判定③—⑤式中关于X、Y、Z的大小顺序排列正确的是 ( )
A.X>y>Z B.X>Z>Y C.Y>X>Z D.Z>X>Y
第Ⅱ卷(非选择题)
26(18分)某同学用下列装置制备并检验Cl2的性质。
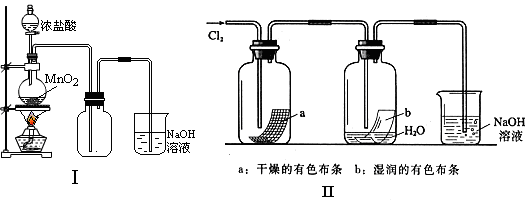 |
(1)I图圆底烧瓶中反应的化学方程式是 ;
(2)II图中褪色的是 (填a或b),烧杯中反应的离子方程式是
;
(3)①将Cu丝换成Fe丝,做III实验,结果也能点燃,你认为Fe丝也可点燃的理由
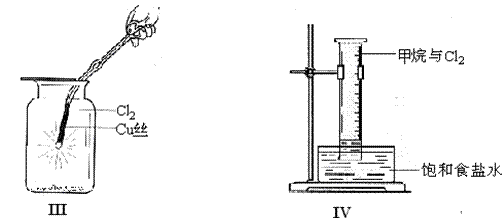 是
。
是
。
a.Fe与Cu都是金属元素 b.Fe的熔点比Cu高
c.Fe的密度比Cu小 d.Fe的金属性比Cu强
②通常由燃烧产物(FeCl3)配制其溶液的方法
。
(4)将IV装置放置在光亮的地方(日光没有直接照射),一会儿后,观察到量筒壁上有油状液滴生成,饱和食盐水中有少量固体析出,量筒内黄绿色气体颜色变浅 ,量筒内液面上升等。
1油状液滴的成分可能是(写分子式) ,
2水槽用饱和食盐水而不用水的原因是_________________________________。
3饱和食盐水中有少量固体析出,其原因是_____________________________。
(5)将硫酸溶液滴入II图烧杯中,至溶液显酸性,结果也有Cl2生成,该反应的离子方程式
是 。
27(13分)A~N均为中学化学中的常见物质,其中A是日常生活中不可缺少的物质,也是化工生产上的重要原料,单质M是目前使用量最大的金属,常温下B、E、F为气体,G为无色液体,这些物质在一定条件下存在如下转化关系,其中有些反应物或生成物已经略去。回答下列问题:
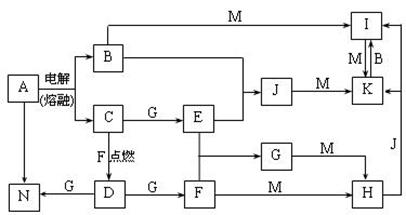
⑴H的化学式为________。
⑵工业上用A制取N的化学反应方程式为________________________________。
⑶D与G反应的离子方程式为_______________________________________。
⑷I可用于净化水,其原因是______________________________________________。
⑸用电子式表示J的形成过程:____________________________________________
28.(16分)双酚-A的二甲基丙烯酸酯是一种能使人及动物的内分泌系统发生紊乱,导致生育及繁殖异常的环境激素,其结构简式为:

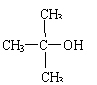 它在一定条件下水解可生成双酚-A和羧酸H两种物质。
它在一定条件下水解可生成双酚-A和羧酸H两种物质。
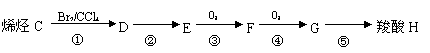
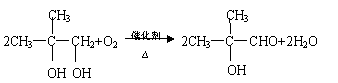
已知与 结构相似的醇不能被氧化为醛或酸。羧酸H可以由以下途径制得:
 |
(1)双酚-A的分子式为 ;下列关于它的叙述中正确的是 (填写字母)。
A.与苯酚互为同系物
B.可以和Na2CO3溶液反应,放出CO2气体
C.分子中所有碳原子可能在同一平面上
D.与浓溴水反应,最多可消耗4mol Br2
(2)下列物质中与双酚-A互为同分异构体的是 (填写字母)。
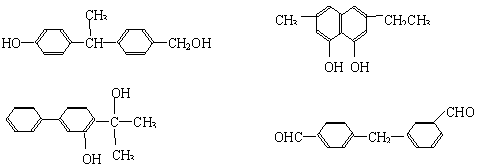 |
A. B.
C. D.
(3)C的结构简式 ,其名称为 。
(4)G中所含官能团为 (填名称),⑤的反应类型为 。
(5)反应③的化学方程式为 。
(6)羧酸H与甲醇反应后得到的酯,能形成一种高分子化合物,可用于制造高级光学仪器透镜,请写出该酯在一定条件下生成此高分子化合物的化学反应方程式:
。
29.(13分)
![]() t℃ 时,将2 mol SO2和1 mol O2通入体积为2 L的恒温恒容密闭容器中,发生如下反应:2SO2 (
g ) +O2 ( g )
2 SO3 (g ),ΔH = -196.6 kJ/mol。2min时反应达到化学平衡,此时测得反应物O2 还剩余0.8 mo1。请填写下列空白:
t℃ 时,将2 mol SO2和1 mol O2通入体积为2 L的恒温恒容密闭容器中,发生如下反应:2SO2 (
g ) +O2 ( g )
2 SO3 (g ),ΔH = -196.6 kJ/mol。2min时反应达到化学平衡,此时测得反应物O2 还剩余0.8 mo1。请填写下列空白:
(1)从反应开始至达到化学平衡,生成SO3平均反应速率为_____________;平衡时SO2转化率为__________________。
(2)下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)_______
A.容器内压强不再发生变化
B.SO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2n mol SO2的同时消耗n mol O2
E.相同时间内消耗2n molSO2的同时生成n mol O2
(3)反应达到化学平衡后,以下操作将引起平衡向正反应方向移动并能提高SO2转化率的是_________________
A.向容器中通人少量O2 B.向容器中通入少量SO2
C.使用催化剂 D.降低温度
E.向容器中通入少量氦气(已知氦气和SO2、O2、SO3都不发生反应)
(4)t℃时,若将物质的量之比n(SO2):n(O2)= 1:1的混合气体通入一个恒温恒压的密闭容器中,反应达到化学平衡时,混合气体体积减少了20 %。SO2的转化率为________。
(化学部分答题卷)
26.(18分)(1) ;
(2)II图中褪色的是 (填a或b),
烧杯中反应的离子方程式是 ;
(3)①也可点燃的理由是 。
②(FeCl3)配制其溶液的方法
。
(4)1(写分子式) ,
2原因是________________________________________________。
3饱和食盐水中有少量固体析出,其原因是_________________,
。
(5)离子方程式是 。
27(13分)
⑴H的化学式为________。
⑵________________________________。
⑶______________________________________。
⑷I可用于净化水,其原因是_______________________________________
______________________________________________。
⑸用电子式表示J的形成过程:_______________________________。
28.(16分)
(1)双酚-A的分子式为 ______ ;
____ (填写字母)。
(2) (填写字母)。
(3)C的结构简式 ,
其名称为 。
(4)G中所含官能团为 (填名称),
⑤的反应类型为 。
(5)反应③的化学方程式为 。
(6)
。
29.(13分)
(1)生成SO3平均反应速率为_____________;
平衡时SO2转化率为__________________。
(2))______ 。_
(3)是_________________
(4)SO2的转化率为________。
高三年级 理科综合检测试题(化学部分)答案
6-13 B A C D B C A B
![]() 26.(共18分)
26.(共18分)
(1)MnO2+4HCl(浓)====MnCl2+Cl2↑+2H2O (2分)
(2) b Cl2+2OH—=Cl—+ClO—+H2O (2×2分)
(3)① d (2分)
② 将FeCl3溶解在较浓的盐酸中,然后再用水稀释到所需浓度 (2分)
(4)(3×2分=6分)
1CH2Cl2、CHCl3、CCl4 (2分,不全对不得分)
2降低Cl2在水中的溶解度 (1分),抑制Cl2和水的反应 (1分)
3反应中有HCl生成 (1分),使溶液中的Cl-浓度增大,促使NaCl的溶解平衡向生成NaCI固体的方向移动 (1分)
(5) Cl—+ClO—+ 2H+= Cl2 ↑+H2O (2分)
27.(共13分)(1) Fe3O4 (2分)
(2) 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑ (3分)
2NaOH+H2↑+Cl2↑ (3分)
(3) 2Na2O2+2H2O=4Na++4OH-+O2↑ (3分)
(4) Fe3++3H2O![]() Fe(OH)3(胶体)+3H+;Fe(OH)3(胶体) 具有较大的表面积,能吸附水中悬浮物质,使水净化。
(3分)
Fe(OH)3(胶体)+3H+;Fe(OH)3(胶体) 具有较大的表面积,能吸附水中悬浮物质,使水净化。
(3分)
(5) 氯化氢J的形成过程:![]()
(2分)
28.(共16分,每空2分) (1)C15H16O2; D (2)A、C
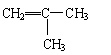 |
(3) 2-甲基丙烯 (4)羟基、羧基;消去反应
 |
(5)
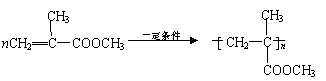 (6)
(6)
29、(13分)(1)0.1 mol / L·min (2分) 20 %(2分)
(2)ABE(3分) (3)AD(3分) (4)80 % (3分)
2007-5-19