6.食品卫生与身体健康密切相关,下列做法不会危害人体健康的是
A.使鱼干的颜色更白,用过氧化氢溶液浸泡处理
B.降低生产成本,减少婴儿奶粉中的蛋白质的含量
C.预防甲状腺肿大,在食盐中添加适量的碘元素
D.保持肉制品味道鲜美,在香肠中加入过量的亚硝酸纳
7.肼(N2H4)是一种常用的火箭燃料,对应的氧化剂通常用过氧化氢,如果火箭推进器中盛有液态的肼和液态过氧化氢,当它们混合反应时立即产生大量的氮气和水蒸气,同时放出大量的热。已知0.4 mol液态肼与足量液态过氧化氢发生反应,可放出256.6 kJ的热量,下列热化学方程式正确的是
A.N2H4(l) + 2H2O2(l) = N2(g) + 4H2O(l) △H=-256.6kJ/mol
B.N2H4(l) + 2H2O2(l) = N2(g) + 4H2O(g) △H=-641.5kJ/mol
C.N2H4(l) + 2H2O2(g) = N2(g) + 4H2O(g) △H=-641.5kJ/mol
B.N2H4(l) + 2H2O2(l) = N2(g) + 4H2O(g) △H= + 641.5kJ/mol
8.下列离子方程式正确的是
A.用Cu作电极电解NaCl溶液的阳极反应:2Cl--2e-= Cl2↑
B.向硫酸氢钠溶液中滴入氢氧化钡溶液至中性:
H+ + SO42- + Ba2+ + OH- === BaSO4↓+ H2O
C.钢铁在弱碱性条件下受腐蚀的正极反应式为:O2 + 4e- + 2H2O = 4OH-
D.向苯酚钠溶液中通入少量的CO2:
![]()
![]() 9.在2L的密闭容器中,充有2 mol SO2和一定量的O2,发生下列反应2SO2+O2 2SO3,当反应进行到4 min时,测得SO2为0.4 mol。若反应进行到2 min时,容器中SO2的物质的量为
9.在2L的密闭容器中,充有2 mol SO2和一定量的O2,发生下列反应2SO2+O2 2SO3,当反应进行到4 min时,测得SO2为0.4 mol。若反应进行到2 min时,容器中SO2的物质的量为
A.1.6mol B.1.2mol C.大于1.6mol D.小于1.2mol
10. 茉莉醛具有浓郁的茉莉花香,其结构简式为: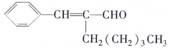 ,关于茉莉醛的下列叙述错误的是
,关于茉莉醛的下列叙述错误的是
A.茉莉醛属于芳香族化合物
B.能与新制的银氨溶液发生银镜反应
C.在加热和催化剂作用下,能被氢气还原
D.不能与氢溴酸发生加成反应
11.在1L K2SO4和CuSO4的混合溶液中c(SO42-) = 2.0mol/L,用石墨电极电解此溶液,当通电一段时间后,两极均收到22.4L(标准状况)气体,则原溶液中c(K+)为
A.2.0 mol/L B.1.5 mol/L C.1.0 mol/L D.0.50 mol/L
12.在周期表主族元素中,甲元素与乙、丙、丁三元素相邻,甲、乙的原子序数之和等于丙的原子序数;这四种元素原子的最外层电子数之和为20。下列判断中正确的是
A.原子半径:丙>乙>甲>丁
B.气态氢化物的稳定性:甲>丙
C.最高价氧化物对应的水化物的酸性:丁>甲
D.乙和甲或乙和丁所能形成的化合物都是有毒物质
13.下列说法正确的是
A.物质的量浓度均为0.1mol·L-1的(NH4)2SO4、(NH4)2Fe(SO4)2两种溶液中,c(NH4+)相同
B.25℃时,在0.1mol·L-1的CH3COOH溶液中加入CH3COONa固体,溶液的pH一定小与7
C.25℃时,将0.1mol·L-1的NaOH溶液与pH=1的稀硫酸等体积混合,混合后的溶液pH=7
D.将同浓度的NaAlO2溶液与Na2CO3溶液混合后,可以生成白色沉淀,并产生气泡
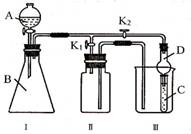 26.(16分)某兴趣小组的同学共同设置了如图所示的实验装置,即可用于制取气体,又可用于验证物质的性质。
26.(16分)某兴趣小组的同学共同设置了如图所示的实验装置,即可用于制取气体,又可用于验证物质的性质。
(1)利用Ⅰ、Ⅱ装置制取气体(K2关闭,K1打开),甲同学认为:利用Ⅱ装置可以收集H2、NH3等气体,但不能收集O2和NO等气体,其理由是
。
乙同学认为:将Ⅱ装置作简单改进(不改变装置),也可以集O2和NO等气体,但不能收集NO2气体,则改进的方法是 。
(2)利用Ⅰ、Ⅱ装置验证物质的性质(K2打开,K1关闭),如证明氧化性:KMnO4>Cl2>Br2,则在A中加浓盐酸,B中加 ,C中加 ,观察到C中的现象是 ;
(3)请利用Ⅰ、Ⅲ装置自行设计实验(K2打开,K1关闭),证明乙炔为不饱和的化合物,写出各仪器所加试剂:B中加 , C中加 ,实验时证明乙炔为不饱和化合物的现象是 ;
(4)装置Ⅲ中仪器D的名称是__________,用于此外的作用是_______________________
______________________________________________。
27.(15分)X、Y、Z三种短周期元素,他们的原子序数之和为16。X、Y、Z三种元素的常见单质在常温下都是气体,在适当的条件下他们两两化合可以分别生成化合物A、B、C,其转化关系如下:
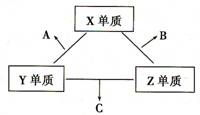
一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10。其回答下列问题:
(1)位于第四周期与X元素同族的元素M,原子核外的电子数为______;该元素最高价氧化物的水化物的化学式为______________;
(2)C在一定条件下,能与X单质反应生成的一种化合物A和B,写出该反应的化学方程式:___________________________________________________________________;
(3)X、Y、Z三种元素可组成一种强酸W,C在适当条件下被W吸收生成一种盐。该盐的水溶液pH 7(填“大于”、“小于”、“等于”),其原因是(用离子方程式表示) ;
(4)已知Y单质与Z单质生成C的反应是可逆反应,△H<0。将等物质的量的Y、Z两种单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。下列说法正确的有 。
①达到化学平衡时,正反应速率与逆反应速率相等
②反应过程中,Y单质的体积分数始终为50%
③达到化学平衡时,Y、Z两种单质在混合气体的物质的量之比为1∶1
④达到化学平衡的过程中气体平均相对分子质量减小
⑤达到化学平衡后,升高温度,C的体积分数增大
(5)X与Y形成的化合物中,当X与Y的质量比与化合物分子中X原子所含的质子数与Y原子所含的质子数之比相同时,其化合物的分子式为___________________。
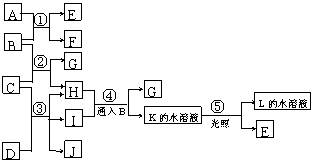 28.(13分)根据下列反应框图填空,已知B、D、E、L常温下为密度比空气大的气体,D、E为单质,其它为化合物,A是一种淡黄色固体,C在水中的溶解度随温度的升高而减小,F、G均能与L的水溶液反应放出B。
28.(13分)根据下列反应框图填空,已知B、D、E、L常温下为密度比空气大的气体,D、E为单质,其它为化合物,A是一种淡黄色固体,C在水中的溶解度随温度的升高而减小,F、G均能与L的水溶液反应放出B。
(1)F的俗名是 ,工业上利用反应③生产 ;
(2)写出F与FeCl3溶液反应的离子方程式
;
(3)某气体M具有漂白作用,将M和D等物质的量通入水中,所得溶液没有漂白作用,发生反应的离子方程式是 ;
(4)同时有B、H和M生成的反应的化学方程式是:
(5)假设各步转化率均为100%,则当收集到E在标准状况下的体积为V L时,计算所消耗的D的物质的量______________(用含V的式子表示)。
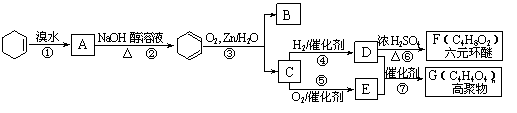 |
29.(16分)环己烯常用于有机合成。以环己烯为原料合成环醚、聚酯,现采用如下设计。其中D可作内燃机的抗冻剂。
已知: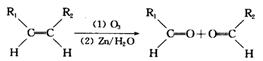
请回答以下问题:
(1)A的分子式为________________,F的结构简式为______________________;
(2)属于加成反应的是(填反应序号)___________;
(3)分别写出②、⑦反应的化学方程式
________________________________________________________________________
(4)F的同分异构体很多,其中属于酯类的有4个,现已知两个,请写出另外两个:
HCOOCH2CH2CH3 CH3COOCH2CH3 ___________________ __________________
答 案
6、C 7、B 8、C 9、D 10、D 11、A 12、B 13、C
26.(共13分)
(1)O2的密度大于空气,NO易与空气中的O2反应;在装置Ⅱ中盛满水;(各2分,共4分)
(2)KMnO4; NaBr溶液; 溶液由无色变成橙色或橙红色;(各1分,共3分)
(3)CaC2(或电石); 溴水; C中溴水的颜色变浅甚至退色; (各1分,共3分)
(4)干燥管(1分); 防止液体倒吸现象发生(2分)
27.(共16分)
|
(2)4NH3 + 5O2 = 4NO + 6H2O;(3分)
![]() (3)小于(1分); NH4+ + H2O NH3•H2O
+ H+(3分)
(3)小于(1分); NH4+ + H2O NH3•H2O
+ H+(3分)
(4)①②(2分)
(5)NO2、N2O4(只答对一个得1分,答对两个得3分)
28.(共15分)
(1)纯碱; 漂白粉;(各2分,共4分)
![]() (2)2Fe3+
+ 3CO32- + 3H2O = 2Fe(OH)3 + 3CO2↑
(2)2Fe3+
+ 3CO32- + 3H2O = 2Fe(OH)3 + 3CO2↑
|
(4)C + 2H2SO4(浓) = CO2↑ + 2SO2↑ + 2H2O
(5)![]() mol(2分)
mol(2分)
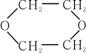 9.(共16分)
9.(共16分)
(1)C6H10Br2 (2分) (2分)
(2)①④;(2分)
(3)
![]()
(3分)
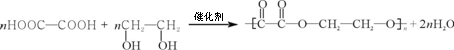 |
(3分)
(4)HCOOCH(CH3)2 CH3CH2COOCH3 (各2分,共4分)