高三理科综合化学部分教学测试(一)
理科综合试卷
6.下列有固定的熔点,且熔点逐渐降低的一组物质是
A.H2S、H2Se、H2Te B.石英、干冰、钾
C.柴油、煤油、汽油 D.KI、I2、O2
7.钢铁发生电化学腐蚀时,负极发生的反应是
A.Fe-2e-=Fe2+ B.2H++2e=H2↑
C.2H2O+O2+4e-=4OH- D.4OH--4e-=2H2O+O2↑
8.以NA 表示阿伏加德罗常数,下列说法正确的是
A.15.6g Na2O2 与过量CO2反应时,转移的电子数为0.2NA
B.如果5.6L N2含有n个氮分子,则阿伏加德罗常数一定约为4n
C.1L 1mol/L 的FeCl3溶液中含有简单铁离子的数目为NA
D.某温度时,pH=6纯水中,含10-6NA个OH-
9.下列反应的离子方程式书写正确的是
A.小苏打溶液中加入少量澄清石灰水:HCO3-+Ca2++OH-=CaCO3↓+H2O
B.铜片溶于稀硝酸:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
![]()
![]() C.苯酚钠溶液中通入少量CO2气体:2 O-+CO2+H2O→2 OH+CO32-
C.苯酚钠溶液中通入少量CO2气体:2 O-+CO2+H2O→2 OH+CO32-
D.电解饱和食盐水2NaCl +2H2O 2Na++2OH-+Cl2↑+H2↑
10.盐酸乙哌立松片(Eperisone Hydrochloride Tablets)是一种骨骼肌松弛剂,能改善由肩周炎、腰痛症等引起的肌紧张状况,其结构简式如下:
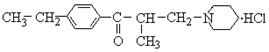
关于盐酸乙哌立松片的下列说法错误的是
A.是芳香族化合物
B.含有N原子的六元环上所有原子均处于同一平面
C.能发生还原反应的原子团有两种
D.是一种有机盐
11.在一个1L的密闭容器中,加入2molA和1molB ,发生下述反应:
2A(g) + B(g) ![]() 3C(g) + D(s),达到平衡时,C的浓度为1.2mol/L,维持容器的体积和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度还是1.2mol/L的是
3C(g) + D(s),达到平衡时,C的浓度为1.2mol/L,维持容器的体积和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度还是1.2mol/L的是
A.1mol A+0.5mol B+1.5mol C+0.1mol D B.3mol C+ 1mol D
C.4mol A+2mol B D.0.5mol A+0.25mol B+2.25mol C
12.中学化学教材中提供了不少数据(图表)。下列为某同学利用相关数据作出推理和判断的依据,其中不正确的是
A.依据中和热的数据,推算一定量的H2SO4和NaOH的稀溶液反应时的反应热
B.依据沸点的数据判断将两种互溶的液态混合物用蒸馏的方法分离开来的可能性
C.依据燃烧热的数据,推算5mol甲烷完全燃烧生成CO2气体和水蒸气所释放出的热量
D.根据酸碱指示剂的变色范围,选择甲基橙作为盐酸滴定氨水时的指示剂
13.常温下pH=3的二元弱酸H2R溶液与V升pH=11的NaOH溶液混合后,混合液的pH=7。下列判断正确的是
A.溶液总体积为2V升
B.溶液中c(R2-)>c(Na+)>c(H+)=c(OH-)
C.溶液中c(R2-)+c(OH-)=c(Na+)+c(H+)
D.溶液中2c(R2-)+c(HR-)=c(Na+)
26.(8分)为防止碘缺乏病,通常在食盐中加入KIO3。
(1)要检验食盐中是否含有IO3-,可以在食盐溶液中加入淀粉碘化钾溶液和稀硫酸,如果溶液变蓝色即可证明。该反应的离子方程式是 ▲ ,若要确认食盐中还含有K+,方法是 ▲ 。
(2)工业上以石墨和铁为电极电解酸性KI溶液制取KIO3。电解时,石墨作 ▲ (填“阳极”或“阴极”),石墨电极上的电极反应式是 ▲ ,电解过程中铁电极附近溶液pH ▲ (填“变大”、“变小”或“不变”)。
27.(16分)下图是元素周期表中的一部分,表中所列字母分别代表一种化学元素,其中j单质能被磁铁吸引,请回答下列问题:
| a |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| b |
|
| c |
|
|
|
|
|
|
|
|
|
|
| d | e |
|
|
|
| f |
|
|
|
|
|
|
|
|
|
|
| g |
|
| h | i |
|
|
|
|
|
|
|
|
| j |
|
|
|
|
|
|
|
|
|
|
| k |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)上述所列元素的原子中,最外层电子层上只有两个电子的是 ▲ (填“元素符号”)。
(2)下列叙述正确的是 ▲ 。
A.i单质的水溶液能使石蕊试液褪色
B.k的碳酸正盐受热容易分解
C.e的最高价氧化物对应水化物可以使氯化亚铁溶液变黄色
 D.常温下纯净的单质j在干燥空气中可以稳定存在
D.常温下纯净的单质j在干燥空气中可以稳定存在
(3)d元素的某种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔融的f单质相互作用,形成某种青铜色的物质(其中的元素f用“●”表示),原子分布如图所示,该物质的化学式为 ▲ 。
(4)液态时e的氢化物类似H2O,也能微弱电离且产生电子数相同的两种离子,则电离方程式为 ▲ 。其中阳离子空间构型为 ▲ 。
(5)d和h均能与氧气反应形成RO2型的氧化物,若要鉴别这两种氧化物可以选择
▲ 溶液,观察到的现象是 ▲ 。
(6)将等物质的量的f、g单质投入足量水中,反应后向溶液中逐滴加入浓度为1 mol·L-1的盐酸溶液,至100 mL时沉淀达到最大值,则投入f的物质的量为 ▲ mol。
28.(18分)按照下图所示装置进行有关实验,拔掉分液漏斗玻璃塞,将A逐滴加入B中。
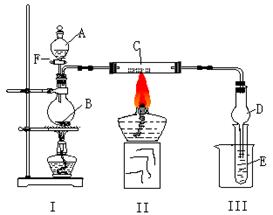
(1)若A是乙醇,B是生石灰,实验中观察到C中黑色固体逐渐变红。当C中黑色固体大部分变红时,关闭F,然后往烧杯中加入热水,静止一会,观察到III中试管壁出现了光亮的银镜。则C是 ▲ ,在反应作 ▲ 剂(填“氧化”或“还原”),写出硬质玻璃管C中所发生的反应方程式 ▲ 。试管E中所发生反应的离子方程式 ▲ 。
(2)若A是能发生银镜反应且只含一个碳的一种液态有机物,B为浓硫酸,E为苯酚钠溶液,C不变。实验中同样能观察到C中黑色固体逐渐变红,同时可观察到试管E中溶液变浑浊,则A是(写名称) ▲ 。然后往烧杯中加入沸水,则试管E中的现象是 ▲ 。此实验中浓硫酸的作用是 ▲ 。写出硬质玻璃管C中所发生的反应方程式 ▲ 。写出乙醇和⑵题中A这二种物质在浓硫酸存在时所发生的反应方程式 ▲ 。
29.(18分)2005年诺贝尔化学奖授予在发现有机物合成转换方面做出杰出贡献的三名科学家。他们获奖的原因是对有机化学烯烃复分解反应的研究做出贡献:弄清了如何指挥烯烃分子“交换舞伴”,将分子部件重新组合成新的物质。对于烯烃复分解反应的研究是通往“绿色化学”的重要一步。烯烃的复分解反应也称之为烯烃的歧化反应,反应机理可表示为:
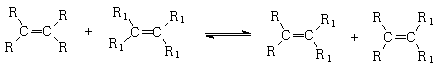
已知同温同压时,C相对于氢气的密度为14,I的分子式为C8H14O4,试根据下图关系,回答问题:
|
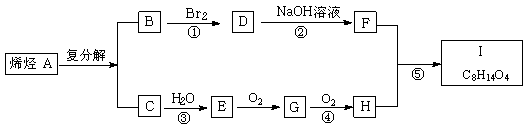
(1)已知C的燃烧热为Q kJ/mol,写出C完全燃烧的热化学方程式: ▲ 。
(2)化合物D、E、G、F中,具有羟基的是 ▲ 。
(3)反应①、②、③、④、⑤中,属于加成反应的是 ▲ 。
(4)写出下列化合物的结构简式:A ▲ 、 I ▲ 。
(5)写出反应②的化学方程式: ▲ 。
(6)F有多种属于二元醇的同分异构体,除下列三种外,
![]() ,
,
写出其它同分异构体(一个碳原子上不能连接两个羟基)的结构简式: ▲ 。
高三教学测试(一)
理科综合评分标准
一、6D;7A;8 A; 9B 10B 11B 12C 13D
26.⑴IO3-+5I-+6H+=3I2+3H2O (2分)
取食盐做焰色反应实验,若透过蓝色钴玻璃观察焰色呈紫色,说明有K+ (2分)
⑵阳极 (1分) I-+3H2O-6e-=IO3-+6H+ (2分) 变大 (1分)
27.⑴He、Be(2分) ⑵ ACD (2分) ⑶ NaC8 (2分)
⑷2NH3![]() NH4++NH2- (2分) 正四面体 (2分)
NH4++NH2- (2分) 正四面体 (2分)
⑸品红 (2分) 褪色 (2分) (其他合理答案均可:酸性高锰酸钾溶液,溴水等)
|
28.(1)CuO (2分) 氧化剂 (2分) CuO+CH3CH2OH → CH3CHO+Cu+H2O (2分)
CH3CHO + 2[Ag(NH3)2]+ + 2OH- → CH3COO- + NH4+ + 2Ag↓+ 3NH3 + H2O (2分)
|
CO+CuO =Cu+CO2(2分)
HCOOH+C2H5OH → HCOOC2H5+H2O (2分)
29.(1)C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) ;ΔH=-Q kJ/mol (3分)
(2)E F(2分) (3)①③(2分)
(4)A.CH3CH=CH2 , I.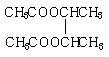 。(4分)
。(4分)
(5) 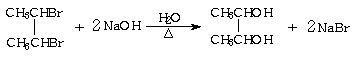 (3分)
(3分)
(6) 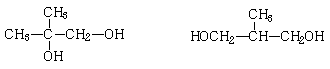 (4分)
(4分)