高三理综化学一模测试题
5.3月22日是世界水日,水是人类重要的资源,下列有关水的说法正确的是
A.水(H2O)与重水(D2O)互为同位素
B.推广使用无磷洗衣粉主要是为了防止水体富营养化
C.向水中加入明矾可以起到净化和杀菌的作用
D.水分子间存在氢键,所以水的化学性质很稳定
6.下列叙述中,正确的是
A.标准状况下,2.24LCO2和SO2混合物中所含有的原子数为0.3![]() 6.02
6.02![]() 1023
1023
 B.1molSiO2中共价键的数目为2
B.1molSiO2中共价键的数目为2![]() 6.02
6.02![]() 1023
1023
C.20gH218O中含有的中子数为8![]() 6.02
6.02![]() 1023
1023
D.7.8gNa2O2与足量的水反应,转移的电子数为0.2![]() 6.02
6.02![]() 1023
1023
7.下列说法正确的
A.金属钠、钾起火可用泡沫灭火器灭火
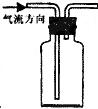
B.右图装置可用于收集H2、NH3、CO2、Cl2、HCl、NO等气体
C.为测定硫酸铜晶体的结晶水含量,加热坩埚中的硫酸铜晶体,失水后须在干燥器中冷却,再称量
D.固体氢氧化钠存放在玻璃塞的试剂瓶中,防止与水蒸气、二氧化碳接触而变质
8.下列五种有色溶液与SO2作用,均能褪 色,其实质相同的是
①品红溶液 ②酸性KMnO4溶液 ③滴有酚酞的NaOH溶液 ④ 溴水 ⑤淀粉碘溶液
A.①④ B.①②④ C.②③⑤ D.②④⑤
9.下列各项中的两个量,其比值一定为2:1的是
A.在反应2H2S+SO2=3S↓+2H2O中还原产物与氧化产物的质量
![]() B.100mL1mol/LNa2CO3溶液中c(Na+)与c(CO32-)
B.100mL1mol/LNa2CO3溶液中c(Na+)与c(CO32-)
C.在密闭容器中,2SO2+O2 2SO3 达平衡时,c(SO2)与c(O2)
D.Ba(OH)2溶液与明矾溶液完全反应,当铝元素全部以AlO2-形式存在时,参加反应的Ba(OH)2与明矾的物质的量
10.在一密闭容器中,进行mX(g)+nY(s) ![]() (g);△H<0的反应,下列说法正确的是
(g);△H<0的反应,下列说法正确的是
A.加入催化剂可以提高X的转化率
B.缩小容器的体积,混合体系中X的含量增加,则m一定小于3
C.降低温度,正反应速率增大,逆反应速率减小,混合体系中Z的含量增大
D.加入一些Y,平衡向右称动,可以提高X的转化率
11.X、Y、Z、W为四种短周期主族元素,其中X、Z同族,Y、Z同周期,W与X、Y既不同族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6。下列说法正确的是
A.Y、Z两元素形成的简单阴离子的还原性Z>Y
B.原子半径大小的顺序为W>X>Y>Z
C.X与W形成的化合物W2X2中含有离子键和共价键
D.Y、Z两种元素最高价氧化物的水化物的酸性Z>Y
12.25℃时有三瓶溶液:pH=3的盐酸、pH=3的醋酸溶液和pH=11的氢氧化钠溶液。下列说法正确的是
A.中和等体积pH=11的氢氧化钠溶液,所需pH=3醋酸溶液的体积大于pH=3的盐酸体积
B.在等体积pH=3的盐酸和pH=3的醋酸溶液中分别加入少量相同的锌粒,盐酸中的锌粒先反应完
C.当pH=3的醋酸溶液和pH=11的氢氧化钠溶液混合得到pH=7的溶液时,该溶液中c(Na+)大于c(CH3COO-)
D.25℃时pH=3的盐酸、pH=3的醋酸溶液中水电离出的c(H+)均为10-11mol/L
25.(16分)有机化合物A(C2H8O2)不溶于水,并可以发生如下图所示的变化:
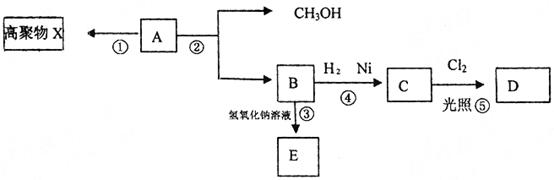
已知:C的一氯代物D只有两种
请回答:
(1)A分子中含有的官能团的名称 ;
(2)①②③④⑤反应中属于取代反应的有 (填序号)。
(3)C的结构简式 ,X的结构简式 ;
(4)写出②的反应方程式 ;
(5)C的同分异构体中属于酯类的有 种,写出其中两种的结构简式
;
(6)简述检验D中含有氯元素的方法
;
(7)17.2gB与足量的碳酸氢钠溶液反应,标准状总况下生成二氧化碳的体积为 L。
答案:(1)碳碳双键、酯基 (2)②⑤
(3)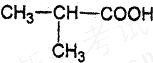 ,
,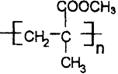 ;
;
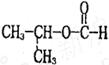 (4)
(4)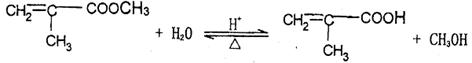
(5)4、CH3CH2COOCH3 CH3COOCH2CH3 HCOOCH2CH2CH3
(可选择其中两个)
(6)取少量的D向其中加入氢氧化钠溶液煮沸,再加入稀硝酸至中性,滴加硝酸银溶液,若有白色沉淀生成,证明D中含有氯元素。
(7)4.48。
26.(16分)实验室可采用下列装置制取纯净的氯气(可含水蒸气),并用氯气和氢氧化钙反应制取少量漂白粉。已知氯气和氢氧化钙制取漂白粉的反应是放热反应,温度稍高即发和副反应。
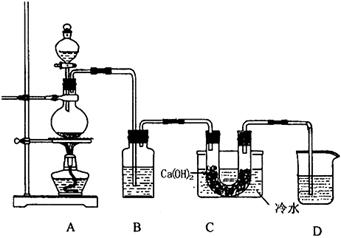
(1)B中盛放的试剂是 ;D装置的作用是 ;
(2)写出实验室制取氯气的离子方程式 ;
(3)已知氯气和氢氧化钙温度稍高发生副反应,生成两种含氯元素的盐和水,每0.3mol氯气参加反应,转移电子0.5mol,写出该副反应发生的化学方程式
;
(4)若将装置D改为收集装置,也可以采用以上装置中的一些仪器,在实验室制备其它纯净、干燥的气体。在下表中填入最合适的试剂(如有需要,装置A中的加热仪器和C中的冷水可以撤去,可添加温度计,装置B可重复使用)。
| 要制取的气体 | A装置中药品 | 除杂装置B中的试剂 | 干燥装置B中C中的试剂 |
| CO2 | 石灰石、稀盐酸 | ||
| C2H4 | 碱石灰 |
答案:(1)水(饱和食盐水),除去多余氯气;
(2)MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
(3)6Cl2+6Ca(OH)2= Ca(ClO3)2+5CaCl2+6H2O
| 要制取的气体 | A装置中药品 | 除杂装置B中的试剂 | 干燥装置B中C中的试剂 |
| CO2 | 石灰石、稀盐酸 | 饱和碳酸氢溶液 | 浓硫酸 |
| C2H4 | 乙醇、浓硫酸 | 氢氧化钠溶液 | 碱石灰 |
(其它合理答案也给分)
27.(14分)中学化学中常见的几种物质存在如下关系,其中甲是黑色非金属单质,乙是生活中常见的金属单质,D是红棕色气体。(图中部分产物和反应条件已略去)
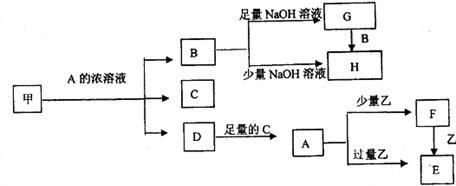
回答下列问题:
(1)写出甲与A的浓溶液反应的化学方程式 ;
(2)C的电子式是 ;
(3)除去G固体中含有H杂质采用的方法是 ;
(4)A溶液与一种能使湿润的红色石蕊试纸变蓝色的气体反应,生成一种盐,该盐的溶液呈酸性,其原因是(用离子方程式表示) ;
(5)写出由F转化为E的离子方程式 ;将溶液F加热蒸干、灼烧到质量不再减少时所得固体物质的化学式为 ;
(6)4g单质甲燃烧能放出131.17KJ的热量,写出单质甲燃烧热的热化学方程式
。
答案:C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O(2)
CO2↑+4NO2↑+2H2O(2)![]()
 (3)加热
(4)NH4++H2O
(3)加热
(4)NH4++H2O![]() NH3•H2O(5)Fe2O3
NH3•H2O(5)Fe2O3
(6)C(s)+O2(g)=CO2(g) ,△H=-393.51KJ/mol
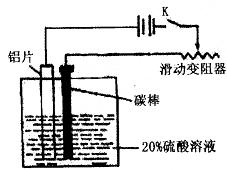
28.(14分)铝的阳极氧化,是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化膜,该氧化膜不溶于稀硫酸。某化学研究小组在实验室中按下列步骤模拟该生产过程。填写下列空白:
(1)配制溶液。需要配制200mL密度1.2g/cm3的溶质质量分数为16%的NaOH溶液,该NaOH溶液的物质的量浓度为 mol/L;
(2)把铝片浸入热的16%NaOH溶液中约半分钟左右洗去油污,除去表面的氧化膜,取出用水冲洗。写出除去氧化膜的离子方程式 ;
(3)如图组装好仪器,接通开关K,通电约25min。在阳极生成氧化铝,阴极产生气体。写出该过程中的阴极电极反应式 ;
(4)断开电路,取出铝片,用1%稀氨水中和表面的酸液,再用水冲洗干净,即完成。
(5)如果去掉装置图中的电源和滑动变阻器,用导线直接把除去氧化膜后的铝片与碳棒连接,则该装置中铝片端是 极,电子流动的方向由 极到 到 极,每转移1.5mol电子,溶液质量增加 g,假设一段时间后,硫酸全部消耗完,所得溶液离子浓度由大到小的顺序为 。
答案:(1)4.8mol/L ;(2)Al2O3+2OH-=2AlO2-+H2O ;(3)2H++2e-=H2↑
(4)负 铝(负)、碳(正) 12 (5)c(SO42-)> c(Al3+)> c(H+)> c(OH-)