高三第二次统测化学试卷
第Ⅰ卷(选择题 共74分)
可能用到的相对原子质量:H-1 Li-7 C-12 N-14 O-16 F-19 Al―27
P-31 S―32 Cl-35.5 Fe―56 Cu―64 Ag―108
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1.2004年诺贝尔化学奖授予美国和以色列的三位科学家,以表彰他们在蛋白质降解的研究中取得的成果。下列关于蛋白质的说法中不正确的是
A.蛋白质属于天然有机高分子化合物,没有蛋白质就没有生命
B.HCHO溶液或(NH4)2SO4溶液均能使蛋白质变性
C.某些蛋白质跟浓硝酸作用会变黄
D.可以采用多次盐析或多次渗析的方法分离、提纯蛋白质
2.下列说法或表示方法正确的是
A.反应物总能量低于生成物总能量时,该反应不能发生
B.中和热一定是强酸跟强碱反应放出的热量
C.由金刚石比石墨稳定,可知C(石墨)→ C(金刚石);ΔH<0
D.在101 kPa、25℃时,2g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热
化学方程式表示为:2H2(g) + O2(g) == 2H2O(l);ΔH=-285.8 kJ/ mol
3.下列物质提纯的方法正确的是
A.除去混在CO2中的SO2:将气体依次通过足量酸性KMnO4溶液和浓硫酸
B.除去混在NO2中的NO:将气体与过量O2混合
C.除去KCl溶液中的K2CO3:加入过量BaCl2溶液后过滤
D.除去乙酸中混有的乙醇:向混合液中加入生石灰后蒸馏
4.下列对实验仪器名称的标注或实验操作,正确的是
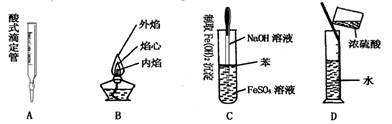
5.下列各选项中两种粒子所含电子数不相等的是
A.羟甲基(-CH2OH)和甲氧基(CH3O-)
B.亚硝酸(HNO2)和亚硝酸根(NO![]() )
)
C.硝基(-NO2)和二氧化氮(NO2)
D.羟基(-OH)和氢氧根(OH-)
6.下列物质有固定的熔点,且熔点逐渐降低的一组物质是
A.HI、HBr、HCl、HF B.石英、食盐、干冰、钾
C.重油、柴油、煤油、汽油 D.KI、I2、Hg、O2
7.简单原子的原子结构可用下图形象地表示:
![]()
其中●表示质子或电子,○表示中子,则下列有关①②③的叙述正确的是
A.①②③互为同素异形体 B.①②③互为同位素
C.①②③是三种化学性质不同的粒子 D.①②③具有相同的质量数
8.常温下,下列各组物质不能用一种试剂通过化学反应区别的是
A.MnO2 CuO FeO
B.Na2CO3 NaHCO3 K2CO3
C. AgNO3 KNO3 Na2CO3
D.HCOOH CH3COOH CH3CHO CH2OH(CHOH)4CHO
二、选择题(本题包括10小题,第9~16题每小题4分,第17、18题每小题5分,共42分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
9.下列反应必须用稀硫酸,而不能用浓硫酸的是
A.跟锌反应制氢气 B.跟苯、浓硝酸作用制硝基苯
C.溶解金属铜 D.作乙酸乙酯水解的催化剂
10.在由5种基团-CH3、-OH、-CHO、-C6H5、-COOH两两组成的物质中,能与NaOH反应的有机物有
A.4种 B.5种 C.6种 D.7种
11.按反应特征与产物的结构关系,有机反应大致可分为:取代反应、消去反应、加成反应三种,下列反应中属于加成反应的是
A.C6H5CH2Cl+NaCN —→ C6H5CH2CN+NaCl
B.C6H5Li+CO2 —→ C6H5COOLi
C.CH3CH2CHO+HCN —→ CH3CH2CH(CN)OH
D.CH3COOH+C2H5OH —→ CH3COOC2H5+H2O
12.下列离子方程式不正确的是
A.三氯化铁水溶液中加入过量氨水![]()
B.4mol/L的NaAlO2溶液和7mol/LHCl等体积互相混合均匀
![]()
C.在Mn2+的溶液中加入HNO3再加入PbO2,得紫红色溶液,
![]()
D.将0.1mol/L盐酸数滴缓缓滴入0.1mol/L 25mlNa2CO3溶液中,并不断搅拌
![]()
13.在含有I-离子且滴加酚酞显红色的溶液中,能大量共存的离子组是
A. Cl-、SO32-、Na+、K+ B.Na+、Ba2+、Cl-、AlO2-
C. SO42-、NO3-、Fe2+、Al3+ D.Na+、K+、ClO-、Cl-
14.设阿伏加德罗常数为NA,则下列说法正确的是
A.常温常压下,11.2L甲烷中含有的氢原子数为2NA
B.标准状况下,0.3mol 二氧化硫中含有氧原子数为0.3NA
C.常温下,2.7g铝与足量的盐酸反应,失去电子数为0.3NA
 D.常温下,1L0.1mol/LMgCl2溶液中含Mg2+数为0.2NA
D.常温下,1L0.1mol/LMgCl2溶液中含Mg2+数为0.2NA
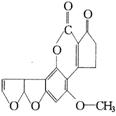
15.最近,媒体报道不法商贩销售“致癌大米”,已验证这种大米中含有黄曲霉毒素(AFTB),其分子结构式为如右图所示,人体的特殊基因在黄曲霉素的作用下会发生突变,有转变为肝癌的可能。一般条件下跟1mol AFTB起反应的![]() 或NaOH的最大量分别是
或NaOH的最大量分别是
A.6mol;1mol B.5mol;1mol
C.6mol;2mol D.5mol;2mol
16.关于某无色溶液中所含离子的鉴别,下列判断正确的是
A.通入Cl2后,溶液变为黄色,加入淀粉溶液后溶液变蓝,可确定有I-存在
B.加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有SO42-存在
C. 加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有Cl-存在
D.加入盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定有大量CO32-
17.用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U型管的质量差,实验测得m(H)∶m(O)>1∶8。下列对导致这一结果的原因的分析中,一定错误的是
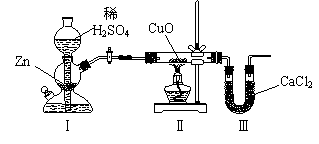
A.Ⅰ、Ⅱ装置之间缺少干燥装置 B.Ⅲ装置后缺少干燥装置
C.Ⅱ装置中玻璃管内有水冷凝 D.CuO没有全部被还原
18.a mol FeS与b mol FeO投入到V L c mol•L—1的硝酸溶液中充分反应,产生NO气体,所得
澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为
A.(a+b)×63g B.(a+b)×189g
C.(a+b)mol D.(Vc⺷![]() )mol
)mol
第Ⅱ卷(非选择题 共76分)
三、(本题包括2小题,共22分)
19.(8分)“套管实验”具有装置简洁便利等有优点,结合图示回答有关问题。
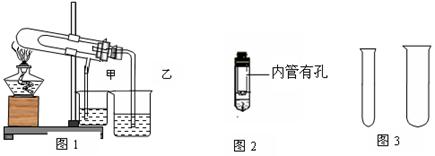
(1)欲利用图1比较碳酸氢钠和碳酸钠的热稳定性,并检验分解产物。最好应在大试管底
部加入 (填化学式) ,石灰水变浑浊的烧杯有______(填:甲、乙)
(2)欲利用图2验证铜与浓硝酸的反应产物,该装置除简洁外,还有一个明显的优点是:
。
(3)用锌粒和稀硫酸用图3制取氢气,并收集一试管,锌粒和稀硫酸应放在 试管中
(填:大、小)组成发生装置,理由是: 。该反应的离子方程式为:
20.(14分)常温下甲醛是一种无色、有特殊刺激性气味的气体,易溶于水,是世界卫生组织(WHO)确定的致癌物和致畸形物之一。我国规定:居室空气中甲醛的最高容许浓度为0.08mg/m3。某研究性学习小组设计用如下方法测定某居室空气中甲醛的含量(假设空气中无其它还原性气体):
⑴ 测定原理: KMnO4(H+)溶液为强氧化剂,可氧化甲醛和草酸,
化学反应离子方程式为: 4MnO4—+ 5HCHO + 12H+ == 4Mn2+ + 5CO2↑+ 11H2O
2MnO4—+ 5H2C2O4 + 6H+ == 2Mn2++10CO2↑+ 8H2O
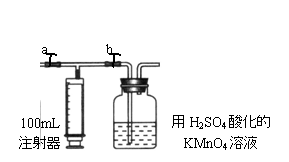 ⑵ 测定装置:部分装置如图所示(a、b为止水夹)
⑵ 测定装置:部分装置如图所示(a、b为止水夹)
⑶ 实验步骤:
① 检查装置气密性(气密性良好)。
② 用 (填仪器名称)准确移取25.00 mL 1.00×10-3mol·L—1的高锰酸钾溶液(过量)于广口瓶中并滴入3滴6mol·L—1H2SO4
溶液备用。
③ 将2.00×10—3mol·L—1的草酸标准溶液置于
(填仪器名称)中备用。
④ 打开a,关闭b,用注射器抽取100mL新装修的
室内空气。关闭a,打开b,再缓缓推动注射器,将气体全部推入酸性高锰酸钾溶液中,使其充分反应。再如此重复4次(共5次)。如果压送气体时速度过快,可能会产生什么不利后果?
_________________________________________________________;
⑤ 将广口瓶中的溶液转入锥形瓶中(润洗广口瓶2~3次,并将洗涤液全部转入锥形瓶)。
如果没有润洗,所测甲醛的含量将 (填“偏高”、“偏低”、“无影响”);
⑥ 用标准草酸溶液滴定锥形瓶中的溶液;记录滴定所消耗的草酸溶液体积。本实验是否需
要指示剂?(如果需要,请写出指示剂的名称;如果不需要,试说明终点时的实验现象)。 。
⑦ 再重复实验2次。
⑷ 数据处理:分别于装修完工后的第1天、第7天、第30天(室内始终保持通风换气状况)
对室内空气进行取样,通过实验测得以下三组数据(每次实验所取的KMnO4溶液均为 25.00mL):
| 装修后 第n天 | 草酸溶液(mL) | 甲醛的浓度 mg/m3 | |||
| 1 | 2 | 3 | 平均值 | ||
| 1 | 15.86 | 15.72 | 15.67 | 15.75 | |
| 7 | 26.17 | 26.36 | 26.38 | 26.27 | |
| 30 | 30.90 | 30.67 | 30.81 | 30.79 | |
设 KMnO4溶液的物质的量浓度为c1,KMnO4溶液的体积为V1(mL);草酸溶液的物质的量浓度为c2,草酸溶液的平均体积为V2(mL)则:计算室内空气中甲醛浓度(mg/m3)的代数式为 (用c1、c2 、V1、 V2表示),计算第30天室内空气中甲醛浓度为_____________(精确到小数点后二位),并判断此时主人________(填“能”或“否”)入住。
四、(本题包括2小题,共16分)
21.(10分)有机物A与乙酸无论以何种比例混合,只要质量一定,完全燃烧后产生的水的质量也一定,试回答:
⑴若A与乙酸相对分子质量相等,且既能发生银镜反应又能发生酯化反应,则A的结构简式为_____________。
⑵若A有四种元素形成的两种官能团组成,相对分子质量与乙酸相等,且分子中氢原子都不与碳原子相连,则A的结构简式为_____________。
⑶若A分子中C、H元素质量分数之和为86.67%,其余为O,且A的相对分子质量小于200,则A的分子式为___________。如果A分子每个碳原子都达到饱和,且能与金属钠反应产生氢气,则A的结构简式为________________________。
22.(6分)(1)某饱和一元链状醇既不能发生消去反应,又不能
发生催化氧化反应,则该饱和一元醇中至少有 个碳原子(不
考虑碳原子与碳原子之间的断裂)。
(2)若某饱和一元醇分子中有15个碳原子,且既不能发生消
去反应,又不能发生催化氧化反应,则该醇可能有的同分异构体
有 种。
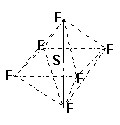
(3)SF6是一种无色气体,具有很强的稳定性,可用于灭火。
SF6的分子结构为正八面体,如果F有两种同位素,则SF6分子种类有 种。
五、(本题包括2小题,共20分)
23.(10分)以石油裂解得到的乙烯和1,3-丁二烯为原料,经过下列反应合成高分子化合物H,该物质可用于制造以玻璃纤维为填料的增强塑料(俗称玻璃钢)。
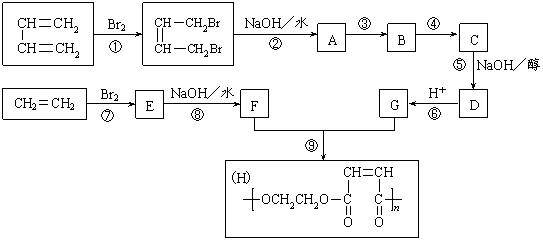
请按要求填空:
⑴写出下列反应的反应类型:
反应①________________,反应⑤________________,反应⑧________________。
⑵反应②的化学方程式是______________________________________________。
⑶反应③、④中有一反应是与HCl加成,该反应是________(填反应编号),设计这一步反应的目的是__________________________________________________,物质C的结构简式是__ _ 。
24.(10分)我国第二代身份证采用的是具有绿色环保性能的PETG新材料,PETG新材料
可以回收再利用,而且对周边环境不构成任何污染。这一材料是由江苏华信塑业发展有限公司最新研发成功的新材料,并成为公安部定点产地。PETG的结构简式为:
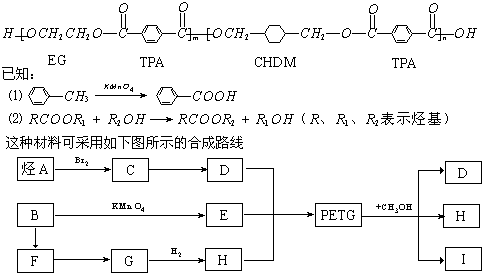
试回答下列问题:
⑴ 反应②⑥加入的试剂X是______________________
⑵ ⑤的反应类型是______________________
⑶ 写出结构简式:B ____________________、I ____________________
⑷ 合成时应控制的单体的物质的量
n(D)∶n(E)∶n(H)= _____∶______∶______(用m、n表示)
⑸ 写出化学方程式:
反应③: ;
反应⑥: 。
六、(本题包括2小题,共18分)
25. (6分)在稀硫酸溶液中,4.48g Cu2S和CuS的混合物与100mL 0.75mol·L-1的MnO4-反
应生成了SO42-、Cu2+和Mn2+。剩余的MnO4-恰好与35.0mL 1.00mol·L-1 FeSO4溶液反应。
(1)配平下列反应化学方程式:
____Cu2S+____ MnO4-+____H+===____ Cu2++____SO42-+____ Mn2++____H2O
(2)试计算原始混合物中Cu2S的质量分数。
26.(12分)硫酸是极其重要的化工原料,在工业、农业、医药、军事等领域应用广泛。工业上通常用接触法制硫酸,主要原料是硫铁矿和空气。接触法制硫酸的生产过程大致可分为三个阶段:二氧化硫的制取和净化;二氧化硫转化为三氧化硫;三氧化硫的吸收和硫酸的生成。
问题1:设空气中N2、O2的含量分别为0.80和0.20(体积分数),则110 L空气和足量的FeS2完全反应后,气体体积(同温同压)变为___________L。
问题2:为了防止环境污染并对尾气进行综合利用,硫酸厂常用氨水吸收尾气的SO2、SO3等气体,再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH4HSO4固体。
为了测定测定上述(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液50.00 mL,加热至120℃左右,使氨气全部逸出[(NH4)2SO4和NH4HSO4的分解温度均高于200℃],测得有关实验数据如下(标准状况):
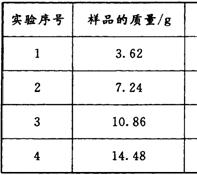
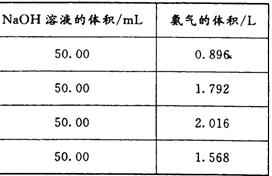
⑴由1组数据直接推测:1. 81 g样品进行同样实验时,生成氨气的体积(标准状况)为__________L。
⑵试计算该混合物中(NH4)2SO4和NH4HSO4的物质的量之比为___________。
⑶求所用NaOH溶液的物质的量浓度。(写出计算过程)
高三第二次统测
化学试卷参考答案
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1.B 2.C 3.A 4.C 5.D 6.D 7.B 8.B
二、选择题(本题包括10小题,第9~16题每小题4分,第17、18题每小题5分,共42分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
9.AD 10.B 11.BC 12.A 13.BC 14.C 15.C 16.A 17.D 18.BD
三、(本题包括2小题,共22分)
19.(8分)
(1)Na2CO3 (1分) 乙 (1分)
(2)有毒气体不会排放到空气中(2分)
(3)小试管(1分) 大试管倒套有利用于空气排出(1分)Zn +2H+ = Zn2+ + H2↑(2分)
20.(14分)
⑶ ②酸式滴定管或移液管,(1分) ③酸式滴定管;(1分)
④甲醛吸收不充分,影响测定结果;(1分)
⑤偏高;(2分)
⑥不需要,(1分)加入最后一滴草酸溶液时溶液褪色且半分钟内不重新变红(2分)
⑷ (75clVl—30c2V2) ×103;(3分) 27.60 (2分) 不能 (1分)
四、(本题包括2小题,共16分)
21.(共10分)
⑴HO-CH2CHO (2分)
⑵ CO(NH2)2 (2分)
![]() ⑶ C8H8O -OH(各3分)
⑶ C8H8O -OH(各3分)
22.(6分)
(1) 13
(2) 4
(3) 10 (本题每空2分)
五、(本题包括2小题,共20分)
23.
⑴加成反应
消去反应 取代反应
(3分)
⑵![]() +2NaOH→
+2NaOH→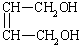 +2NaBr
(2分)
+2NaBr
(2分)
⑶ ③ 保护A分子中C=C不被氧化 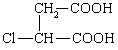 (5分)
(5分)
24.
⑴NaOH溶液(1分)
⑵取代(或醇解);(1分)
⑶![]() (2分)
(2分)
⑷ m∶(m+n)∶n(2分)
![]()
![]()
![]() ⑸ ③
⑸ ③ ![]() +3H2
+3H2![]()
![]() (2分)
(2分)
⑥CH2Br-CH2Br +2H2O ![]() CH2OH -CH 2OH +2HBr (2分)
CH2OH -CH 2OH +2HBr (2分)
六、(本题包括2小题,共18分)
25.(6分)(1)Cu2S+2 MnO4-+8H+==2Cu2++SO42-+2Mn2++4H2O(2分)
(2)35.7%(4分)
26.问题1:104(3分)
问题2:(1)0.448(2分)(2) 1:2(3分) (3) 3mol/L-1(3分)