绝密★启用前
高三级化学第一学期期末质检试题
高三级化学科试题
本试卷分选择题和非选择题两部分,满分150分。考试用时120分钟。
注意事项:
1、答卷前,考生务必用黑色字迹的钢笔或签字笔将学校名称、自己的姓名和考生号填写在答题卷的密封线内。
2、选择题每小题选出答案后,用2B铅笔把答题卷上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案,答案不能答在试卷上。
3、非选择题必须用黑色字迹钢笔或签字笔作答,答案必须写在答题卷各题目指定区域内相应位置上,不准使用铅笔和涂改液,不按以上要求作答的答案无效。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Mg 24 Al 27 S 32 Cl 35.5 Cu 64 第一部分选择题(共70分)
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意)
1、下列有关说法不正确的是 ( )
A、装饰材料中的甲醛、芳香烃及氡等会造成居室污染
B、苯甲醛中混有苯甲酸,加入生石灰,再加热蒸馏
C、SO2、NO2或CO2都会导致酸雨的形成
D、丙烯分子(CH3—CH =CH2)有8个δ键,1个∏键
2、类推的思维方法在化学学习和研究中常会产生错误的结论,因此类推出的结论最终要经过实践的检验才能决定其正确与否。下列几种类推结论中正确的是 ( )
A、第二周期元素氢化物稳定性顺序是HF>H2O>NH3;则第三周期元素氢化物稳定性顺序也是HCl>H2S>PH3
B、Fe3O4可写成FeO·Fe2O3;Pb3O4也可写成PbO·Pb2O3
C、可电解熔融MgCl2来制取金属镁;也能电解熔融AlCl3来制取金属铝
D、晶体中有阴离子,必有阳离子;则晶体中有阳离子,也必有阴离子
3、t℃时,将一定量A(不含结晶水)的不饱和溶液均分为三份,分别加热蒸发,然后冷却为t℃,已知三份溶液分别蒸发水10g,20g,30g,析出A晶体的质量依次为ag,bg,cg.则a,b,c三者的关系是( )
A、c=a+b B、c=2b-a C、c=2b+a D、c=2a-b
4、“神舟”五号载人飞船发射成功后,我国又在启动“嫦娥工程”,在3~4年内中国人将登上月球。人类探测月球发现,其土壤中存在较丰富的质量数为3的氦,它可以作为核聚变的原料。以下叙述正确的是 ( )
A、由质量数为3的氦原子构成的分子是双原子分子 B、3 2He与4 2He的性质均相同
C、3 2He、4 2He形成的分子中存在共价键 D、3 2He中的质子数与4 2He的中子数相等
5、在测定液态BrF3导电性时发现,20℃时导电性很强,其他实验证实存在一系列有明显离子化合物倾向的盐类,如KBrF4,(BrF2)2SnF6等,由此推测液态BrF3电离时的阳、阴离子是( )
A、Br3+,F- B、BrF2+,F- C、BrF2+,BrF4- D、BrF2+,BrF32-
6、在锌与某浓度的盐酸起反应的实验中,一个学生得到下面的结果:
| 序号 | 锌的质量(g) | 锌的形状 | 温度(℃) | 完全溶解于酸的时间(s) |
| A | 2 | 薄片 | 5 | 400 |
| B | 2 | 薄片 | 15 | 200 |
| C | 2 | 薄片 | 25 | 100 |
| D | 2 | 薄片 | 30 | t1 |
| E | 2 | 薄片 | 35 | 50 |
| F | 2 | 颗粒 | 15 | t2 |
| G | 2 | 粉末 | 15 | t3 |
则下列说法正确的是 ( )
①t1==75 s ②t2>200>t3 ③单位时间内消耗的锌的质量m(C)>m(F)>m(B)
 A.① B.①② C.只有② D.全部正确
A.① B.①② C.只有② D.全部正确
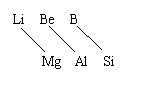
7、第二周期中从Li到F的七种元素,在它们各自对应主族中的表现仍有明显
的“反常”’现象,而由此建立的“对角线法则”充分地证明了这一差异性的存在。
如图,即锂与镁的相似性超过了它和钠的相似性,如:LiOH为中强碱,Li2CO3
难溶于水等等。又如:Be、Al的单质、氧化物、氢氧化物均表现出明显的“两性”;同理,B和Si也存在这种对角线关系,如晶体硼与晶体硅一样,属于坚硬难熔的原子晶体。则下列性质叙述不正确的是 ( )
A、Li在N2中燃烧生成Li3N B、Li在空气中燃烧生成Li2O2
C、Be(OH)2既能溶于强酸又能溶于强碱溶液 D、硼酸溶液不能使石蕊试液变红
8、某种胶体在电泳时,它的胶粒向阴极移动,在这种胶体中分别滴加下列物质,不会发生凝聚的是①蔗糖溶液 ②硫酸镁溶液 ③硅酸胶体 ④氢氧化铁胶体 ( )
A、①② B、①④ C、②③ D、③④
| a | ||||
| b | c | |||
| d | e | |||
| f |
9、右图中a、b、c、d、e、f为元素周期表中前4周期的相邻的一部分元素,下列有关叙述正确的是 ( )
A、b、c、d 三种元素的原子半径大小关系: d>b>c
B、六种元素中,d元素的性质最稳定
C、相同条件下b和c气态氢化物溶于水,液体的酸性:b>c
D、e元素的最高价氧化物的水化物是二元酸
10、向pH=2的某酸溶液和pH=12的氢氧化钠溶液中,加入足量的铝片,放出H2的物质的量之比为2:1其原因可能是 ( )
A、两溶液的体积相同,酸是二元强酸
B、两溶液的体积相同,酸是弱酸
C、若酸为一元弱酸,酸溶液的体积是碱溶液体积的2倍
D、酸是强酸,且酸溶液的浓度比NaOH溶液浓度大
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分)
11、下列离子方程式书写正确的是 ( )
A、小苏打中加入过量的石灰水:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O
B、氧化铁可溶于氢碘酸:Fe2O3+6H+=2Fe3++3H2O
C、过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
D、明矾溶液加入Ba(OH)2溶液至Ba2+恰好完全沉淀: Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O
12、下列有关的叙述正确的是 ( )
A、常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B、将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C、用pH=3和pH=2的醋酸溶液中和含等量NaOH的溶液所消耗的醋酸溶液的体积分别为Va和Vb,则Va>10Vb
D、Na2BeO2溶液的pH>7,BeCl2溶液的pH<7,分别将它们蒸干并灼烧后,都可能生成BeO
![]() 13、下列表达方式正确的是 ( )
13、下列表达方式正确的是 ( )
![]() A、二氧化碳
A、二氧化碳 ![]() B、N原子的轨道表示式写成
B、N原子的轨道表示式写成
C、Fe2+离子的核外电子排布式1s22s22p63s23p6 3d6 或[Ar]3d6 D、NH4H的电子式是NH4 H
14、已知常温下:Ksp[Mg(OH)2]=1.2×10-11mol3•L-3 Ksp(AgCl)=1.8×10-10mol2•L-2
Ksp(Ag2CrO4)=1.9×10-12mol3•L-3 Ksp(CH3COOAg)=2.3×10-3mol2•L-2 下列叙述正确的是( )
A、等体积混合浓度均为0.2mol/L的AgNO3溶液和CH3COONa溶液一定产生CH3COOAg沉淀
B、将0.001mol/L的AgNO3溶液滴入0.001mol/L的KCl和0.001mol/L的K2CrO4溶液中先产生Ag2CrO4沉淀
C、在Mg2+为0.121mol/L的溶液中要产生Mg(OH)2沉淀,溶液的pH至少要控制在9以上
D、向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)变大
15、已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。下列判断正确的是 ( )A、上述实验证明氧化性:MnO4->Cl2>Fe3+>I2 B、上述实验中,共有两个氧化还原反应
C、实验①生成的气体不能使湿润的淀粉KI试纸变蓝 D实验②证明Fe2+既有氧化性又有还原性
16、已知反应:①101kPa时,2C(s) + O2(g)=2CO(g);△H=-221kJ/mol
②稀溶液中,H+(aq) + OH-(aq)=H2O(1);△H=-57.3kJ/mol
下列结论正确的是 ( )
A、碳的燃烧热的数值大于110.5kJ/mol
B、①的反应热为221kJ/mol
C、浓硫酸与稀NaOH溶液反应的中和热为-57.3kJ/mol
D、稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量.
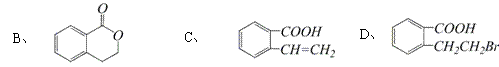
17、利尿酸在奥运会上被禁用,其结构简式如下图所示.下列叙述正确的是 ( )
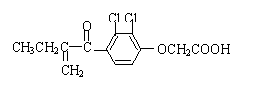 A、利尿酸衍生物利尿酸甲酯的分子式是C14H14Cl2O4
A、利尿酸衍生物利尿酸甲酯的分子式是C14H14Cl2O4
B、利尿酸分子内处于同一平面的原子不超过10个
C、1 mol利尿酸能与7 mol H2发生加成反应
D、利尿酸能与FeCl3溶液发生显色反应
18、被誉为"太空金属"的钛,在室温下,不跟水、稀盐酸、稀硫酸和稀硝酸等作用,但易溶于氢氟酸,你认为其原因可能是 ( )
A、氢氟酸的酸性比其他酸强 B、氢氟酸的氧化性比其他酸强
C、氢氟酸的还原性比其他酸强 D、钛离子易与氟离子形成可溶性难电离物质
19、NA代表阿伏加德罗常数的值,下列说法正确的是 ( )
 A、在2升2mol/L的(NH4)2SO4溶液中所含的NH4 +的数目是8NA
A、在2升2mol/L的(NH4)2SO4溶液中所含的NH4 +的数目是8NA
B、常温常压下,2molCaC2晶体中含有的阴离子数为 2NA
C、在Cu与S的反应中,1molCu失去的电子数为NA
D、标准状况下,22.4L三氧化硫中含有NA个三氧化硫分子
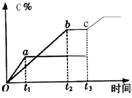
20、密闭容器中,有反应:A +2 B ![]() 2C,产物C的生成情况如右图所示,a为40 MPa ,b为20 MPa时的情况,c为20MPa时从时间
2C,产物C的生成情况如右图所示,a为40 MPa ,b为20 MPa时的情况,c为20MPa时从时间![]() 开始降低容器的温度情况,下列情况能满足图像变化,叙述正确的是
( )A、A、B、C均为气体,正反应吸热
开始降低容器的温度情况,下列情况能满足图像变化,叙述正确的是
( )A、A、B、C均为气体,正反应吸热
B、A、B、C均为气体,正反应放热
C、A和C为气体,为B非气体,正反应放热
D、C为气体,A、B中最少有一种为非气体,正反应放热
第二部分非选择题(共80分)
三、(本题包括3小题,共30分)
21(4分)用电石和水反应,产生的乙炔中含有H2S等杂质。某学生拟选用①NaOH溶液、②KMnO4溶液、③CuSO4溶液、④浓HNO3、⑤浓H2SO4中的一种除去H2S杂质,经研究最后他确定选用的溶液是 (填序号),如果没有该试剂,请你用其它试剂代替(写一种化学式) 。
22(10分)海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:

请填写下列空白:
⑴步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是 (从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
⑵步骤③的实验操作名称是 ;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是 。
⑶步骤④反应的离子方程式是 。
⑷步骤⑤中,某学生选择用苯来提取碘的理由是 。
⑸请设计一种检验提取碘后的水溶液中是否还有单质碘的简单方法:
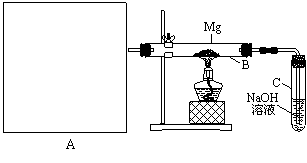 23(16分)已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定的相似性。
23(16分)已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定的相似性。
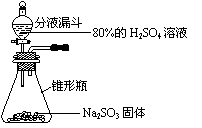
Ⅰ.用如上图所示装置进行Mg和SO2的实验,其中A是制备SO2的发生装置。
⑴ 选择制取SO2的合适试剂____________。(填序号)
①10%的H2SO4溶液 ②80%的H2SO4溶液 ③Na2SO3固体 ④CaSO3固体
⑵ 写出装置B中发生的主要反应的化学方程式_______________________________。装置C中NaOH溶液的作用是 。
⑶请画出制备SO2的发生装置并注明主要仪器的名称,固定仪器省略不画。
⑷你认为该装置不足之处是什么?
。
Ⅱ.某研究性学习小组进行了“实验室制Si”的研究,它们以课本为基础,查阅资料得到以下可供参考的信息:
①工业上在高温时用C还原SiO2可制得Si ②Mg在点燃的条件下即可与SiO2反应
③金属硅化物与稀H2SO4反应生成硫酸盐与SiH4 ④Si和SiO2均不与稀H2SO4反应
⑤SiH4在空气中自燃
他们在研究报告中记载着“……选用合适的物质在适宜的条件下充分反应;再用足量稀硫酸溶解固体产物;然后过滤、洗涤、干燥;最后称量……在用稀硫酸溶解固体产物时,发现有爆鸣声和火花,其产率也只有预期值的63%左右”。
⑸该小组“实验室制Si”的化学方程式是_____________________ ______________ 。
⑹你估计“用稀硫酸溶解固体产物时,发现有爆鸣声和火花”的原因是____ ______
四、(本题包括3小题,共30分)
24(12分)蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成。由蛇纹石制取碱式碳酸镁的实验步骤如下
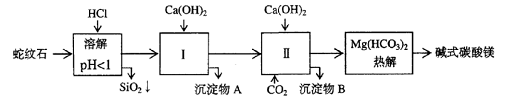
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
⑴蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是
⑵进行Ⅰ操作时,控制溶液pH=7-8(有关氢氧化物沉淀的pH见右表),Ca(OH)2不能过量,若Ca(OH)2过量可能会导致 溶解、 沉淀。
⑶从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入_________ (填入物质的化学式),然后__________________________________ (依次填写实验操作名称)。
⑷物质循环使用,能节约资源。上述实验中,可以循环使用的物质是_________ (填写物质化学式)。
⑸现设计一个实验,确定产品aMgCO3·bMg(OH)2·cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
①样品称量 ②高温分解 ③ ④ ⑤MgO称量
⑹18.2g产品完全分解后,产生6.6gCO2和8.0g MgO,由此可知,产品的化学式中:a=_________ b =_________ C =_________
25(10分)
⑴肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是
。
 ⑵肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼—空气燃料电池放电时:正极的电极反应式是
⑵肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼—空气燃料电池放电时:正极的电极反应式是
。
负极的电极反应式是
。
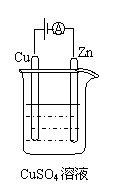
⑶右图是一个电化学过程示意图。
①锌片上发生的电极反应是 。
②假设使用肼—空气燃料电池作为本过程中的电源,铜片的质量变化128g,
则肼一空气燃料电池理论上消耗标准状况下的空气 L(假设
空气中氧气体积含量为20%)
⑷传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的离子方程式
26(8分)已知氯化铝的熔点为190℃(2.5×105Pa),但它在180℃时即开始升华。
(1)氯化铝是 。(填序号 ①离子化合物 ②共价化合物)
(2)在500K和1.01×105Pa时,它的蒸气密度(换算为标准状况时)为11.92g·L—1,试确定氯化铝在蒸气状态时的化学式为____________。
(3)无水氯化铝在空气中强烈地“发烟”,其原因是
(4)设计一个可靠的实验,判断氧化铝是离子化合物还是共价化合物。你设计的实验是
五、(本题包括2小题,共20分)
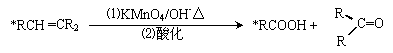 27(12分)碳碳双键有如下的断裂方式:
27(12分)碳碳双键有如下的断裂方式:
高分子单体A(C6H10O3)可进行如下反应(反应框图):
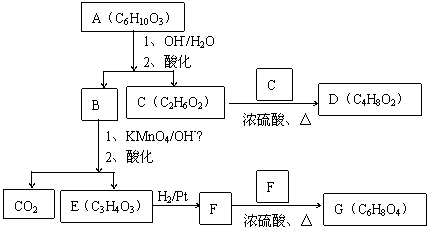
对框图中某些化合物性质说明:室温下A不与NaHCO3溶液反应,但可与Na反应放出H2;B可与NaHCO3溶液反应放出CO2;C可与Na作用放出H2而D不能;G在室温下既不与NaHCO3溶液反应,也不与Na作用放出H2。
⑴写出A、C、D、E的结构简式。
A: C: D: E:
⑵写出与B所含官能团相同的B的同分异构体:
⑶B在浓H2SO4存在下与甲醇反应的产物在一定条件下聚合,写出这个聚合物的结构简式:
。
⑷写出F→G的化学反应方程式: 。
 28(8分)有机物A的结构简式是
28(8分)有机物A的结构简式是![]() ,它可以通过不同的反应得到下列物质:
,它可以通过不同的反应得到下列物质:
(1)A中官能团的名称是: 、
(2)写出由A制取B的化学方程式: 。
(3)写出A制取C、D两种物质的有机反应类型:C: D:
(4)写出两种既可以看做酯类又可以看做酚类,且分子中苯环上连有三种取代基的A的同分异构体的结构简式(要求这两种同分异构体中苯环上的取代基至少有一种不同)
; 。
第一学期期末质检
高三级化学科参考答案及评分标准
一、二(70分)
| 题序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | C | D | B | D | C | C | D | B | A | B |
| 题序 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | CD | C | C | AC | A | A | A | D | BC | C |
三、(本题包括3小题,共30分)
21(4分)③ (CH3COO)2Pb
22(10分)⑴(全对给2分,错一个0分,漏一个扣1分)BDE ⑵(2分)过滤;
蒸馏
⑶(2分)2I-+MnO2+4H+=Mn2++I2+2H2O
⑷(2分)苯与水互不相溶;碘在苯中的溶解度比在水中大
⑸(2分)取少量提取碘后的水溶液于试管中,加入几滴淀粉试液;观察是否出现蓝色(如果变蓝,说明还有单质碘)
![]()
 23(16分)⑴ ②③(2分)
23(16分)⑴ ②③(2分)
![]()
![]() ⑵ 3Mg+SO2 2MgO+MgS(2分)
⑵ 3Mg+SO2 2MgO+MgS(2分)
或写成 2Mg+SO2 2MgO+S Mg+S MgS
吸收多余的SO2,防止污染环境(1分)
⑶(5分,仪器名称1分,科学性2分,作图技术2分)
⑷在A和B之间没有连接一干燥装置;C装置未与大气相通;在镁下方未垫一不锈钢片,镁与玻璃管反应;未设计一防倒吸装置(只要答出两点即给2分)
![]() ⑸(2分)2Mg+SiO2 2MgO+Si
⑸(2分)2Mg+SiO2 2MgO+Si
![]() ⑹(2分)金属镁与生成的硅继续反应生成硅化镁,硅化镁与稀硫酸反应生成的SiH4可自燃或用化学方程式表示:2Mg+Si Mg2Si Mg2Si+2H2SO4=MgSO4+SiH4↑ SiH4+2O2=SiO2+2H2O
⑹(2分)金属镁与生成的硅继续反应生成硅化镁,硅化镁与稀硫酸反应生成的SiH4可自燃或用化学方程式表示:2Mg+Si Mg2Si Mg2Si+2H2SO4=MgSO4+SiH4↑ SiH4+2O2=SiO2+2H2O
四、(本题包括3小题,共30分)
24.(12分)
⑴Fe3+ Al3+ ⑵Al(OH) 3、Mg(OH)2 ⑶NaOH 过滤、洗涤、灼烧
⑷CO2 ⑸③测出CO2的质量 ④测出水蒸气的质量 ⑹3、1、3
25(10分)
⑴N2H4(1)+O2(g)=N2(g)+2H2O(1);△H=-624kJ/mol(2分)
⑵O2+2H2O+4e-=4OH- (1分) N2H4+4OH--4e-=4H2O+N2↑(1分)
⑶①Cu2++2e-=Cu (2分) ②112(2分)
⑷ClO-+2NH3=N2H4+Cl-+ H2O(2分)
26(每空2分,共8分)
(1)② (2)Al2Cl6 (3)氯化铝与空气中的水发生水解反应产生HCl气体,HCl在空气中形成酸雾而"发烟"(4)在其熔融状态下,试验其是否导电,若不导电是共价化合物,若能导电是离子化合物。
五、(本题包括2小题,共20分)
27(12分)
 ⑴(6分)
⑴(6分)
![]() ⑵(2分)
⑵(2分)
 |
⑶(2分)
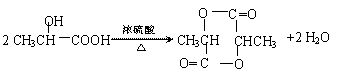 |
⑷(2分)
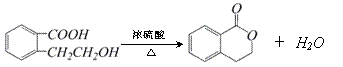 28(8分)⑴羟基、羧基(2分)
28(8分)⑴羟基、羧基(2分)
⑵ (2分)
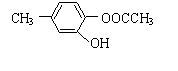 ⑶消去、取代(2分)
⑶消去、取代(2分)
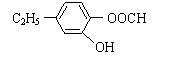 ⑷ (2分)
⑷ (2分)
(其它合理答案均给分)

高三级化学科答题卷
| 题序 | 一 | 二 | 三 | 四 | 五 | 总分 |
| 得分 |
第一部分 选择题(共70分)
|
 第二部分 非选择题(共80分)
第二部分 非选择题(共80分)
三、(本题包括3小题,共30分)
21(4分) (填序号) (写一种化学式)
22(10分)
⑴
⑵③的实验操作名称是 ;⑥的实验操作名称是
⑶
⑷理由是
⑸方法:
23(16分)
⑴ ____________。(填序号)
⑵化学方程式_______________________________。NaOH溶液的作用是
⑶画装置图
⑷不足之处是
⑸化学方程式_____________________ ______________
⑹爆鸣声和火花”的原因是
 四、(本题包括3小题,共30分)
四、(本题包括3小题,共30分)
24(12分)⑴还含有的金属离子是
⑵若Ca(OH)2过量可能会导致 溶解、 沉淀。
⑶加入_________ (填化学式),然后__________________________________ (填写实验操作名称)。
⑷循环使用的物质是 (填写物质化学式)。
⑸ ③ ④
⑹a= b = C =
25(10分)
⑴热化学方程式
⑵正极的电极反应式是
负极的电极反应式是
⑶①锌片上发生的电极反应是 。② L
⑷离子方程式
26(8分)(1) (填序号) (2)化学式为
(3)原因是
(4)你设计的实验是
五、(本题包括2小题,共20分)
27(12分)
⑴
A: C: D: E:
⑵同分异构体: ⑶聚合物的结构简式:
⑷F→G:
28(8分)
⑴官能团的名称是: 、
⑵由A制取B的化学方程式:
⑶有机反应类型:C: D:
⑷ ; 。