高三年级化学第一学期月考试卷
化 学 试 题
可能用到的相对原子质量:H:1 C:12 O:16 Al:27 S:32 Fe:56 Cu:64
一、单项选择题(每小题2分,共10小题)
1.2005年4月22日是第36个“世界地球日”,我国国土资源部确定今年“世界地球日”的主题为“善待地球,科学发展,构建和谐”。你认为下列行为中不符合这一主题的是( )
A.开发太阳能、水能、风能、可燃冰等新能源、减少使用煤、石油等化石燃料
B.控制含磷剂的生产和使用,防止水体富营养化,保护水资源
C.研究采煤、采油新技术,尽量提高产量以满足工业生产的快速发展
D.实现资源的“3R”利用观,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、促进资源的循环再生(Recycle)
2.下列说法正确的是 ( )
A.丁达尔现象实验可鉴别蛋白质溶液和淀粉溶液
B.少量白磷需保存在水中溶液
C.肥皂去油污与汽油去油污原理相同
D.相同浓度的甘氨酸与乙酸的pH相同
3.在下列物质中,加入过量的盐酸后,最终不产生沉淀或浑浊的是 ( )
A.NaAlO2溶液 B.C6H5ONa溶液
C.Na2SiO3溶液 D.Na2S2O3溶液
|
|
|
![]()
![]()
![]()
![]() HO—CH2—CH2—OH
HO—CH2—CH2—O—CH2—CH2—OH
HO—CH2—CH2—OH
HO—CH2—CH2—O—CH2—CH2—OH
OH—CH2—CH2—O—CH2—CH2—O—CH2—CH2—OH……则该系列化合物中碳元素的质量
| |
C.66.67% D.85.71%
5.已知自然界中铱有两种质量数分别为191和193的核素,而铱的平均相对分子质量为192.22,这两种核素的原子个数比应为 ( )
A.39 :61 B. 61 :39 C.1 :1 D.39 :11
6.下列各组离子在溶液中既可以大量共存,且加入足量氨水后也不产生沉淀的是 ( )
A.Na+、Ba2+、Cl-、SO42- B.H+、NH4-、Al3+、SO42-
C.K+、AlO2-、NO3-、OH- D.H+、Cl-、CH3COO-、NO3-
7.两气态烃以任意比混合,在110℃时,1L该混合烃与7L氧气混合,充分燃烧后,恢复到原状况,所得水蒸气体积一定比CO2体积大。下列各组烃符合此条件的是 ( )
A.C3H4、C2H6 B.C2H2、C3H6
C.C2H6、C3H8 D.C2H2、C2H4
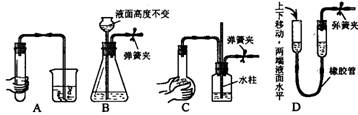
8.下列各图所示装置的气密性检查中,漏气的是 ( )
9.K35ClO3晶体与H37Cl浓溶液反应,生成氯气、氯化钾和水,此反应生成的这种氯气的摩尔质量为 ( )
A.74g·mol-1 B.73.3 g·mol-1
C.72 g·mol-1 D.70.6 g·mol-1
10.纳米材料的表面微粒数占微粒总数的比例极大,这是它有许多特殊性质的原因,假设某纳米颗粒中粒子分布类似于硼镁化合物,其结构如图所示,则这种纳米颗粒的表面微粒数占总微粒数的百分数为 ( )
A.22%
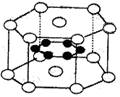 B. 70%
B. 70%
C.66.7%
D. 33.3% ○镁原子,位于顶点和上下两个面心
● 硼原子,位于六棱柱的内部
二、单项选择题(每小题3分,共10小题)
11.对于平衡体系mA(g)+nB(g)![]() pC(g)+qD(g);△H<0.下列结论中不正确的是( )
pC(g)+qD(g);△H<0.下列结论中不正确的是( )
A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q
B.若平衡时,A、B 的转化率相等,说明反应开始时,A、B的物质的量之比为m:n
C.若m+n=p+q,则往含有amol气体的平衡体系中再加入amol的B,达到新平衡时,气体的总物质的量等于2a
D.若温度不变时,压强增大到原来的2倍,达到新平衡时,总体积一定比原来的1/2要小
12.0.1mol/LKHSO4和0.1mol/LNa2S溶液等体积混合后,溶液能使pH试纸变蓝,则离子浓度关系正确的是 ( )
A.c(HS-)>c(SO42-)>c(OH-)>c(H+)
B.c(Na+)>c(K+)>c(H+)>c(OH-)
C.c(Na+)=c(S2-)+c(H2S)+c(HS-)+c(SO42-)
D.c(Na+)+c(K+)+c(H+)=c(SO42-)+c(S2-)+c(HS-)+c(OH-)
13.“类推”是常用的学习方法,但有时会产生错误结论。下列类推的结论中,正确的是( )
A.第二周期元素氢化物稳定性顺序是:HF>H2O>NH则第三周期元素氢化物稳定性顺序是:HCl>H2S>PH3
B.ⅣA族元素氢化物沸点顺序是:GeH4>SiH4>CH4则ⅤA族元素氢化物沸点顺序也是:AsH3>PH3>NH3
C.晶体中有阴离子,必有阳离子.则晶体中有阳离子,也必有阴离子
D.干冰(CO2)是分子晶体,则水晶(SiO2)也是分子晶体
14.25℃时,硫酸铜的溶解度为sg,把sg无水CuSO4粉末加入到(100+s)g饱和CuSO4溶液中,得到一定量的蓝色晶体,若将此晶体溶解制成饱和溶液,应加入水的质量是( )
A. 100g B.(100+s)g
C.(100+9/25)g D.(100-16/25)g
15.化学用语是学习化学的重要工具,下列离子方程式书写正确的是 ( )
A.将氯化铁溶液滴入沸水中形成胶体:
 Fe3++3H2O
Fe3++3H2O![]() Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
B.将少量二氧化碳通入偏铝酸钠溶液中:
CO2+2H2O+AlO2-==Al(OH)3↓+HCO3-
C.等物质的量的亚硫酸氢铵与氢氧化钠溶液混合
NH4-+HSO3-+2OH-==SO32-+NH3↑+2H2O
D.碳酸氢镁溶液中加入过量石灰水:
| |
16.如右图所示,A池用石墨电极电解氢氧化钠溶液,B池精炼粗铜,一段时间后停止通
电,A池D极产生的气体在标准状况下为2.24 L。下列说法正确的是 ( )
A.A池为电解池,B池为原电池
B. D电极与E电极都发生氧化反应
C.F极是以粗铜板为材料
D.B池中E极质量增加25.6 g
17.非典型性肺炎(SARS)病毒是一种RNA病毒,由三万多个碱基组成,分子直径达100nm,目前用于治疗的抗病毒药物之一是阿昔洛韦[化学名称为:9-(2-羟乙氧甲基)鸟嘌呤],已知这种药物的结构简式如下图,
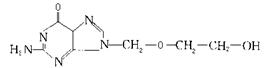
以下说法不正确的是 ( )
A.阿昔洛韦的化学式为:C8H11N5O3
B.该物质在一定条件下可发生消去反应
C.该物质在一定条件下可发生取代反应
D.五个氮原子一定在同一平面内
18.NA代表阿伏加德罗常数,以下说法正确的是 ( )
A.由2H和18O所组成的水11g,其中所含的中子数为5NA
B.标准状况下,1L庚烷完全燃烧后,所生成气态产物的分子数为7/22.4NA
C.在1L 0.1mol/L的HCOOH溶液中,所含HCOO-与HCOOH粒子数之和为0.1NA
D.SiO2晶体中,1个硅原子与2个氧原子形成共价键
19.某种混合气体,可能含有N2、HCl、CO中的一种或几种,把混合气体依次通过足量的KHCO3饱和溶液和灼热的CuO,气体的体积都没有发生变化;再通过足量的Na2O2固体,气体体积减小;最后通过灼热的铜网,经充分反应后气体体积又减小,但还有剩余气体。以下对混合气体组分的判断中,正确的是 ( )
A.一定有N2,CO和HCl中至少有一种
B.一定没有N2,CO和HCl中至少有一种
C.一定没有HCl,一定有N2、CO
D.三者一定都存在
20.Wg含有Fe2O3·x H2O杂质的Al2O3样品可完全溶解在100mL pH=1的稀H2SO4中,然后再向溶液中加入100mL氨水,恰好得到最大质量沉淀Ng,则所加氨水的浓度为( )
A.0.05mol/L B.0.1mol/L C.0.15mol/L D.0.2mol/L
三、(本题共2小题)
21.把H2S通入碘水中,过滤出生成的硫,可得一定浓度的氢碘酸,氢碘酸可被空气中的O2氧化为I2。I2在水溶液中易与红磷反应生成PI3,并水解生成HI和H3PO3(亚磷酸)
(1)写出氢碘酸氧化变质的离子方程式: ;
(2) (填“能”或“不能”)用浓硫酸与固体NaI共热制HI,原因是: 。
(3)在配制的氢碘酸溶液中,可加入少量的红磷。当该溶液置于空气中时,只要溶液的
| |
表示):
22.请按要求填空:
㈠下列实验操作或实验叙述正确的是 (填序号)。
①配制氯化亚铁溶液时,需加少量盐酸及铁粉;
②用10mL量筒量取5.80mL盐酸;
③用稀醋酸除去热水瓶内的水垢;
④检验卤代烃中卤素时,直接将卤代烃加入硝酸酸化的硝酸银溶液中
⑤金属钠着火可用干燥的细沙扑灭;
⑥用排水法收集氢气时,不需要检验纯度,可直接点燃;
⑦检验碳酸钠溶液中是否混有氢氧化钠可先加足量的氯化钙溶液,再滴入酚酞试液;
⑧可用过滤法除去氧氢化铁胶体中少量的氯化铁和盐酸。
㈡下列试剂和图中的仪器可用来制备氯气、溴单质、氧气和溴乙烷等。
试剂有:二氧化锰、氯酸钾、氯化钾、溴化钾、双氧水、浓硫酸、乙醇、NaOH、水等。
仪器见下图。
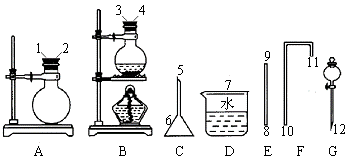
请填空:
(1)组装制O2的发生装置选用的仪器是 (填仪器A~G编号,下同),化学方程式为__________ 。
(2)利用 仪器可作为制溴单质的发生装置,制取反应的化学方程式为
。
(3)已知溴乙烷是一种难溶于水的无色液体,密度约为水的1.5倍,沸点为38.4℃;乙醇沸点为78.5℃;HBr的沸点为-67℃,Br2的沸点为58.8℃,密度为3.12g·cm-3。
①收集溴乙烷时,选C和D,而不选D和E的理由是______________________,橡皮塞孔4接10端而不接11端的理由是_____________________________。
②从棕黄色的粗溴乙烷中制取无色的溴乙烷,应加入的试剂是________________,必须使用的主要仪器是____________(填名称)。
四、(本题共3小题)
23.已知X、Y、Z、L、M、N是短周期中的六种元素,它们的原子序数依次增大。X和Y可形成常见化合物YX4,YX4分子中电子总数为10。Z的单质在通常状况下为无色无味气体。L原子的最外层电子数是核外电子总数的3/4。M的单质通入X和L形成的化合物中生成化合物W和L的单质。N是一种金属元素,在短周期的主族元素中原子半径最大。X的单质和Z的单质在一定条件下可生成化合物E。化合物W和化合物E可生成化合物G。试回答:
(1)Z的最高价氧化物的化学式________________;N的离子结构示意图__________;
(2)E中的化学键类型为(填“极性键”或“非极性键”)_____________;G电子式为___________。YL2分子的极性 (填“极性分子”或“非极性分子”)
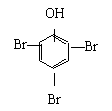
24.现有分子式为C8H8O3的化合物A,常温常压下为无色液体,难溶于水且具有特殊香味,苯环上的氢被硝基取代时生成的一元取代物有两种。从A出发可以发生下图所示的一系列变化,其中化合物G能发生银镜反应,H的分子式为C6H6O,K为白色固体且不溶于水。
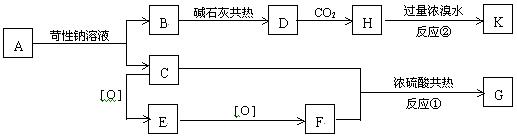
(1) 写出结构简式:A ,E ,K 。
(2) 指出化学反应类型:反应①为 ,反应②为 。
(3) 写出反应方程式C+F ® G: 。
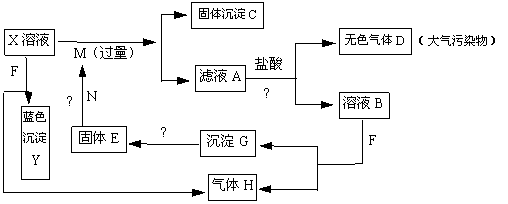 25.如下图,已知X为中学化学中的一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的最高价氧化物是耐火材料,它的晶体硬度很大,常做手表的轴承;H为单质。下图中部分反应产物已略去。
25.如下图,已知X为中学化学中的一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的最高价氧化物是耐火材料,它的晶体硬度很大,常做手表的轴承;H为单质。下图中部分反应产物已略去。
(1)X的化学式为 ;F的电子式为 。
(2)反应①的离子方程式为_______________________________________________。
反应②的化学方程式为_______________________________________________。
(3)若向100 mL 盐X的溶液中加入10 g金属单质M的粉末,充分搅拌后,过滤,烘干得10.16g固体C。则滤液A中溶质的物质的量浓度为_____________________。
五、计算题(本题共1小题)
26.现有浓度各为1 mol/L的FeCl3、FeCl2、CuCl2的混合溶液100mL,加入一定量的铁粉,按下列情况填空:
(1)反应完毕,铁粉有剩余:
反应完毕时,溶液中一定含有 阳离子,一定没有 阳离子。
(2)反应完毕,有铜生成,铁粉无剩余:
①反应后的溶液中一定含有 阳离子,该阳离子在溶液中的物质的量范围是 。
②溶液中可能含有 阳离子,该阳离子在溶液中物质的量的可能存在范围是 。
(3)反应完毕后,无固体沉淀物存在,反应后的溶液中一定含有 和
阳离子;它们的物质的量为一定数值范围,该范围分别是 和 。
参考答案
一、单项选择题(共10小题,每小题2分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| C | B | A | B | A | C | C | D | B | B |
二、单项选择题(共10小题,每小题3分)
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| D | C | A | A | A | C | D | C | A | B |
三、(共2小题)
21.(1)4H++4I-+O2=====2I2+2H2O(2分)
|
|
(3)2P + 3I2 2PI3 (1分);PI3 + 3H2O 3HI + 3H3PO3(1分)
22.㈠①③⑤⑦(1分)
㈡(1)AG(1分)
2H2O2![]() 2H2O+O2↑(2分)
2H2O+O2↑(2分)
(2)BG (1分) 2KBr+2H2SO4(浓)+MnO2![]() K2SO4+MnSO4+Br2+2H2O
K2SO4+MnSO4+Br2+2H2O
或2KBr+3H2SO4(浓)+MnO2![]() 2KHSO4+MnSO4+Br2+2H2O(2分)
2KHSO4+MnSO4+Br2+2H2O(2分)
(3)①倒置的漏斗可以防止HBr溶于水产生倒吸(1分);橡皮塞孔4接10端,是为了利用长导管起冷凝回流作用(1分);②NaOH溶液(或其他碱溶液)(1分);分液漏斗(多填其他合理仪器不扣分)(1分)。
三、(共3小题)
23.(每空各1分)(1)N2O5;
![]()
![]()
(2)极性键;
24.(每空各1分,第3小题2分)(1)
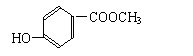 |
HCHO
 |
(2)酯化反应、取代反应
(3)CH3OH+HCOOH →HCOOCH3+H2O
25(1)![]() ,
,![]() (各1分)
(各1分)
(2)① 3Fe2+ + NO3-+ 4H+ == 3Fe3+ + NO↑+ 2H2O(2分)
|
(3)0.2 mol/L(1分)
五、(共1小题)
26.(1) Fe3+、Cu2+(各1分)
(2) ①Fe2+ (1分) 0.25mol <n(Fe2+)≤0.35mol (2分)
②Cu2+ (1分) 0≤n(Cu2+)<0.1mol(2分)
(3)Fe2+(1分) 、Cu2+ (1分)0.1mol <n(Fe2+)≤0.25mol (2分)
n(Cu2+)=0.1mol (2分)