高三年级化学第四次月考试题
化学试题
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分.共100分,考试时间100分钟.本卷可能用到的相对原子质量有:H 1 C 12 O 16 Na 23 Mg 24 Al 27 S 32 Cl 35.5 K 39 Ca 40 Cu 64 Fe 56 Ag 108 Ba 137 N 14
第I卷(选择题,共40分)
一、选择题:每题只有一个正确答案(1-16每小题2分,17-20每小题2分共44分)。
1、被称为“21世纪金属”的钛金属(Ti)有多种同位素,如![]() 等。这些同位素原子的中子数不可能为
等。这些同位素原子的中子数不可能为
A、30 B、28 C、26 D、24
2、市场上有一种加酶洗衣粉,即在洗衣粉中加入少量的碱性蛋白酶,它的催化活性很强,衣物的汗渍、血迹及人体排放的蛋白质、油渍遇到它,皆能水解而除去,下列衣料中不能用加酶洗衣粉洗涤的是
①棉织品 ②毛织品 ③腈纶织品 ④蚕丝织品 ⑤涤纶织品 ⑥绵纶织品
A、②④ B、①②③ C、③④⑤ D、③⑤⑥
3.在下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是
![]() A.CaC2+H2O→Ca(OH)2+CH≡CH↑ B. Na2O2+2H2O=4NaOH+O2
A.CaC2+H2O→Ca(OH)2+CH≡CH↑ B. Na2O2+2H2O=4NaOH+O2
C.Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑ D.NH4Cl+NaOH NaCl+H2O+NH3↑
4.2004年七月,德俄两国化学家共同宣布,在高压下,氮气会聚合生成高聚氮,这种高聚氮的晶体中每个氮原子都通过三个单键与其他氮原子结合并向空间发展构成立体网状结构。已知晶体中N-N键的键能为160kJ·mol-1,而N≡N键的键能为942 kJ·mol-1。则下列有关说法不正确的是
A.键能越大说明化学键越牢固,所构成的物质越稳定
B.高聚氮晶体属于原子晶体
C.高聚氮晶体中n(N):n(N-N)=1:3
D.用作炸药或高能材料可能是高聚氮潜在的应用
5.下列有关某些社会热点问题的说法中,错误的是
⑴禁止使用含铅汽油是为了提高汽油的燃烧效率;⑵臭氧空洞的形成与氟氯烃或氮氧化物泄漏到大气中有关;⑶光化学烟雾的产生与人为排放氮氧化物有关;⑷空气质量预报目前主要是预报可吸入颗粒、二氧化硫、二氧化碳三种物质;⑸甲醛是某些劣质装饰板材释放的常见污染物之一;⑹硅肺病是由于长期吸入含二氧化硅粉尘引起的;⑺硅可用来制造集成电路、晶体管、硅整流器等半导体器件,还可制成太阳能电池。
A.⑴⑶⑷⑸⑺
B. ⑷
C.⑴ ⑷⑹
D.⑴ ⑷
6.40℃时,等质量的两份饱和石灰水,一份冷却至10℃,另一份加少量CaO并保持温度仍为40℃,这两种情况都不改变的是
A.Ca(OH)2的溶解度 B.溶液的质量
C.溶质的质量分数 D.溶液中Ca2+数目
7、已知298K时,2SO2(g)+O2(g)
![]() 2SO3(g);△H=-197kJ·mol-1。现有同一温度下的三个体积相同的密闭容器,在第一个容器中通入2molSO2和1molO2,达到平衡时,反应放出的热量为Q1;向第二个密闭容器中通入1molSO2和0.5molO2,达到平衡时放出的热量为Q2;在第三个密闭容器中通入1molSO2、0.5molO2和1molSO3达到平衡时放出的热量为Q3。下列关系正确的是
2SO3(g);△H=-197kJ·mol-1。现有同一温度下的三个体积相同的密闭容器,在第一个容器中通入2molSO2和1molO2,达到平衡时,反应放出的热量为Q1;向第二个密闭容器中通入1molSO2和0.5molO2,达到平衡时放出的热量为Q2;在第三个密闭容器中通入1molSO2、0.5molO2和1molSO3达到平衡时放出的热量为Q3。下列关系正确的是
A、Q1=Q3=197kJ B、Q1=Q3<197kJ
C、Q1=2Q2 <197kJ D、Q2<Q1<197kJ
8.表示下列变化的化学用语正确的是
![]() A.NaHCO3的水解:HCO3-+H2O H3O++CO32-
A.NaHCO3的水解:HCO3-+H2O H3O++CO32-
B.碳酸氢钠与另一盐溶液混和的双水解:HCO3-+ AlO2-+H2O = Al(OH)3↓+CO32-
C.铝粉撒入溶解有烧碱的重水中:2Al +2OH-+2D2O![]() 2AlO2-+H2
2AlO2-+H2![]() +2D2
+2D2![]()
D.1L0.5mol·L-1稀硫酸与1L 1mol·L-1氢氧化钠溶液反应放出57.3kJ的热:
H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(1) ; △H=-114.6 kJ/mol
9.某种药物主要成分X的分子结构如下:
![]()
关于有机物X的说法中,错误的是
A.X难溶于水,易溶于有机溶剂 B.X能跟溴水反应
C. X能使酸性高锰酸钾溶液褪色 D.X的水解产物不能发生消去反应
10.下列各组离子能在指定环境中大量共存的是
A.在c(HCO![]() )=0.1mol/L的溶液中:NH
)=0.1mol/L的溶液中:NH![]() 、Al3+、Cl-、NO
、Al3+、Cl-、NO![]()
B.在由水电离出的c(H+)=1×10-12mol/L的溶液中:Fe2+、ClO-、Na+、SO![]()
C.pH=1的溶液中:Mg2+、Fe3+、NO3-、[Ag(NH3)2]+
D.在使红色石蕊试纸变蓝的溶液中:SO![]() 、CO
、CO![]() 、Na+、K+
、Na+、K+
11. 设 NA 为阿伏伽德罗常数,下列叙述正确的是
A 在标准状况下,22.4 L NO 与11.2 L O2 充分反应后,所得气体的分子数为 NA
B 一定条件下,52.0 g乙炔与苯蒸气的混合气体中含有的碳原子数约为4×6.02×1023
C 1 L 1 mol/L 的FeCl3 溶液中含有三价铁离子数目为 NA
D 标准状况下,1 L 辛烷完全燃烧所生成气态产物的分子数为 8/22.4 NA
12.下列物质所发生的化学反应中,由于反应物的用量不同而得到不同产物的是
①H2S+O2;②P+Cl2;③P2O5+H2O;④NaCl(固)+H2SO4(浓);⑤AlCl3+NaOH;⑥乙醇和浓硫酸;⑦SO2+H2S;⑧碳酸钠和稀盐酸;⑨硫和氧气;⑩H2S+NaOH
A.全部都是 B.①②⑤⑧⑩
C.①②⑤⑦⑧⑩ D.①②④⑤⑦⑧⑨⑩
13.叠氮酸(HN3)与醋酸的酸性相似,下列叙述中错误的是
A.HN3水溶液中粒子浓度大小顺序为:c(HN3)>c(H+)>c(N3-)>c(OH-)
B.HN3与NH3作用生成的叠氮酸铵是共价化合物
C.NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3-)>c(OH-)>c(H+)
D.若HN3比HCN酸性强,则相同体积相同物质的量浓度的NaN3与NaCN溶液中,离子总数NaN3比NaCN多。
14. 向100 mL FeBr2 溶液中通入标准状况下的 Cl2 3.36 L 全部被还原,测得溶液中
c(Br-) = c(Cl-) ,则原 FeBr2 溶液的物质的量浓度是
A 0.75 mol/L B 1.5 mol/L C 2 mol/L D 3 mol/
15. 常温下,有V L pH = 3的二元弱酸H2R溶液与V L pH = 11的 NaOH 溶液,若混合后溶液的pH = 7 ,下列判断正确的是
A 溶液的总体积为 2V L
B 溶液中 c(R2-) > c(Na+) > c(H+) = c(OH—)
C 溶液中 c(R2-) + c(OH—) + c(HR—) = c(Na+) + c(H+)
D 溶液中 2c(R2-) + c(HR—) = c(Na+)
16、一定条件下,将X和Y两种物质按不同比例放入密闭容器中,反应达到平衡后,测得X、Y转化率与起始时两种物质的量之比[n(X)/n(Y)]的关系如右图,则X和Y反应的方程式可表示为
|
|
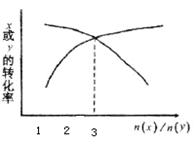
A、X+3Y ![]() 2Z
B、3X+Y
2Z
B、3X+Y![]() 2Z
2Z
C、3X+2Y![]() Z
D、2X+3Y
Z
D、2X+3Y![]() 2Z
2Z
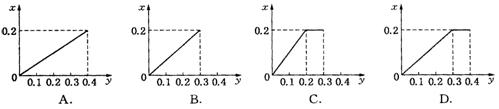
17. 将22.4 g铁粉逐渐加入到含![]() 0.8 mol的稀硝酸中,反应生成的气体的物质的量(x)随消耗铁粉的物质的量(y)变化关系中正确的是
0.8 mol的稀硝酸中,反应生成的气体的物质的量(x)随消耗铁粉的物质的量(y)变化关系中正确的是
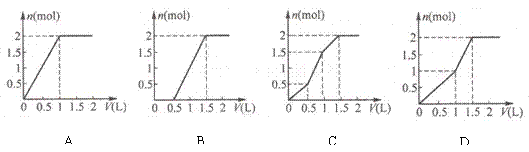
18.用含1 mol HCl的盐酸酸化含1 mol MgSO4的溶液,当向其中滴加1 mol/L 的Ba(OH)2 溶液时,产生沉淀的物质的量(n)与加入 Ba(OH)2 溶液体积(V)间的关系图正确的是
19、碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是
A、 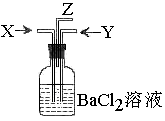 气瓶中产生的沉淀是碳酸钡
气瓶中产生的沉淀是碳酸钡
B、 Z导管出来的气体中无二氧化碳
C、 气瓶中产生的沉淀是硫酸钡
D、Z导管口只有二氧化碳气体放出
20、含8.0g NaOH的溶液中通入一定量H2S后,将得到的溶液小心蒸干,称得无水物7.9g,则该无水物中一定含有的物质是
A、Na2S B、NaHS
C、Na2S和NaHS D、NaOH和NaHS
第Ⅱ卷(非选择题 60)
二、简答题(本题方程式或设计方案每格2分,其余全部每格1分,共48分)
21.在元素周期表中,相邻近的元素在结构和性质上有许多相似之处。
(1)第二周期的碳、氮、氧、氟都可以形成氢化物,氧元素的氢化物除H2O外,还有H2O2;碳元素的氢化物除CH4外,还有C2H6等;与之相似的氮元素的氢化物除NH3外,还有________(填化学式),其沸点比液氨____(填“高”或“低”),稳定性比氨_____( 填“好”或“差”),该氢化物与足量盐酸反应的化学方程式为______________________________。
(2)氮原子间也可形成链状结构,假设氮原子间只以N-N键形式连接,并形成氢化物,则该系列氢化物的通式为___________________。
(3) (2)题的通式中氮原子数是2的化合物和NO2混合发生反应生成N2和H2O(气),今知4 g该气态化合物在上述反应中放出71kJ热量,写出其热化学方程式为: 。由于该反应放出大量热,可作火箭推进剂,2005年10月12日我国成功发射“神舟”六号飞船。飞船内需要有一种化合物来吸收宇航员呼出的 CO2,写出该物质的电子式________________。飞船中需要制造一种适合宇航员生存的人工生态环境,应该在氧气中充入一种气体用于稀释氧气,该气体分子的电子式是__________。
22.如图所示装置,两玻璃管中盛满滴有酚酞的溶液的NaCl饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。
(1)接通S1后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成。此时
C(Ⅱ)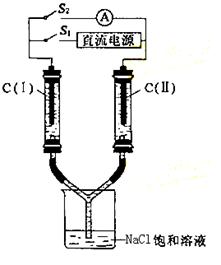 的电极名称是
;
的电极名称是
;
C(Ⅰ) 的电极反应式是 。
(2)一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转。此时:
C(Ⅰ)的电极名称是 ;
C(Ⅱ)的电极反应式是 。
23.(6分)下列有关实验的叙述,正确的是(填序号)
(A)配制500mL某物质的量浓度的溶液,可用两只250mL的容量瓶
(B)将0.1 mol/L的NaOH溶液与0.5 mol/L的CuSO4溶液等体积混合制得氢氧化铜浊液,用于检验醛基
(C)金属锂应存放在煤油中防止被氧化
(D)用酸式滴定管量取20.00mL高锰酸钾溶液
(E)NaOH固体可长期保存在玻璃瓶中
(F)常温下铜跟稀硫酸不反应,跟浓硫酸能立即反应。
(G)除去乙酸中混有的乙醇:向混合液中加入生石灰后蒸馏
(H)使用石蕊试纸(检验气体)的第一步操作是把试纸用蒸馏水湿润
(J)在氢氧化铁胶体中加注少量硫酸会产生沉淀
(K)铜丝在氯气中燃烧实验必须先将铜丝加热,再伸入到氯气中,而铜丝在硫蒸气中燃烧,铜丝不需加热就可伸入到硫蒸气中。
(L)用结晶法可以除去氯化钠中混有少量硝酸钾
(M)要探究纯碱溶液呈碱性是由CO32-引起的,可向纯碱溶液中滴入酚酞溶液,溶液显红色;若再向该溶液中滴入过量氯化钙溶液,产生白色沉淀,且溶液的红色褪去,说明纯碱呈碱性是由CO32-引起的。
(N) 在试管中制备取氢氧化亚铁时,将吸有氢氧化钠的滴管插入硫酸亚铁溶液液面下,挤出滴管中的液体,滴管取出后立即用水将其洗净;
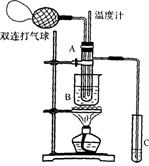 24.乙醛在催化剂存在的条件下,可以被空气氧化成乙酸。
24.乙醛在催化剂存在的条件下,可以被空气氧化成乙酸。
依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、
氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体)。已知在60~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见下表:
| 物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
| 沸点/℃ | 20.8 | 117.9 | 290 | 197.2 | 100 |
请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件):
______________________________________________________________。
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在________________________________;当试管A内的主要反应完成后温度计水银球的位置应在________________________________________,目的是_______________________________________________________________。
(3)烧杯B的作用是__________________________________________________________;烧杯B内盛装的液体可以是 _______________(在上表中选择,写出一种即可)。
(4)若想检验试管C中是否含产物乙酸,请你在所提供的药品中选择,设计一个简便的实验方案。
所提供的药品有:pH试纸、红色的石蕊试纸、白色的醋酸铅试纸、碳酸氢钠粉末。
实验仪器任选。
该方案为:______________________________________________
25.2005年11月13日,中石油吉化公司双苯厂胺苯车间的苯胺装置硝化单元发生着火爆炸。14日吉化公司东10号线入江口水样有强烈的苦杏仁气味,苯、苯胺、硝基苯、二甲苯等主要污染物指标均超过国家规定标准,同时由于苯、硝基苯易挥发,沿岸空气也受污染。12月22日,就在吉化爆炸案发生一个月多之后,所造成的污染带前锋“跋涉”数千公里,流经松花江汇入阿穆尔河,抵达了俄罗斯远东城市哈巴罗夫斯克,俄罗斯向我方要求巨额赔偿。
(1)下列事故应急处理方法可行的______________
A. 通过活性碳吸附方式清除悬浮污染物,远期还将清理沉淀污染物,以从根本上解决污染问题。
B、立即组织消防人员把事故现场的所有火源全部灭掉。
C、在把周围其它装置进行隔离保护,使火势得到控制后,应让余火把渗漏在地表上的苯及苯的衍生物全部燃烧后,再把所有火源灭掉。
D、在松花江中实现化学反应将其转化为毒性较小的物质。
F、为保证居民的饮用水安全,哈尔滨市在取水口投放粉末活性炭的做法将一直持续到明年“五一”。
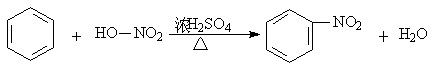
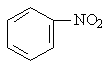
(2) 10号线入江口水样有强烈的苦杏仁气味是由于含有______________(填结构简式),写出苯在一定条件下合成该物质的反应方程式_______________________________,其反应类型_____________
(3)写出 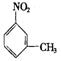 的同分异构体,要求苯环上有二个取代基且取代其位于对位______、_______、___________、_______________、___________、 。(可不填满也可补充);写出这些异构体中含有的官能团的名称(任写其中二种)___________,____________。
的同分异构体,要求苯环上有二个取代基且取代其位于对位______、_______、___________、_______________、___________、 。(可不填满也可补充);写出这些异构体中含有的官能团的名称(任写其中二种)___________,____________。
(4)指出有机物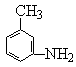 的所有原子 (填“是”或“不是”)在同一平面上,它的苯环上的一氯代物有________种同分异构体。写出它与盐酸反应的方程式____________________________________________。
的所有原子 (填“是”或“不是”)在同一平面上,它的苯环上的一氯代物有________种同分异构体。写出它与盐酸反应的方程式____________________________________________。
26.2005年10月5日,瑞典皇家科学院将本年度诺贝尔化学奖授予法国化学家伊夫·肖万、美国化学家罗伯特·格拉布和理查德·施罗克,以表彰他们在烯烃复分解反应研究领域作出的贡献。烯烃复分解反应,是指在金属催化下的碳碳重键的切断并重新结合的过程,它包括:
(1)烯烃的歧化:![]()
(2)环烯烃的开环聚合成高聚烯烃:
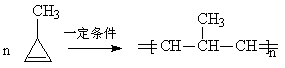
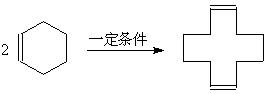
(3)环烯烃低聚生成大环烯烃:

下图中A是一个无支链也无甲基的链状化合物,1molB在一定条件下会发生烯烃的歧化,生成1mol环状化合物D和1molC,已知C是植物生长的调节剂,D在一定条件下,可开环聚合成高聚烯烃E,也可在一定条件下,二聚生成大环烯烃F,已知F中含12个碳原子。
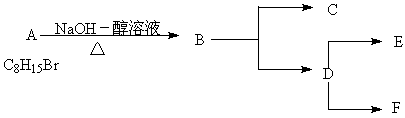
写出实现下列转化的化学方程式:
(1) B生成C和D
(2) D生成E
(3) D生成F
三、计算(8分)
27.(8分)硝酸与金属反应是硝酸的重要化学性质之一,请阅读下文并解答有关问题。
(1)ag铜与bmL浓HNO3充分反应后得到V1 L红棕色气体X,且溶液中余下cg铜;再将此红棕色气体通过水变成V2 L无色气体Y(气体已转换成标准状况下的体积,设题中产生的氮的化合物分子中均含有一个氮原子。)
①当反应生成X气体时有多少克氮元素被还原?
②计算X气体中各组分的物质的量。
(2)若在(1)反应余下的溶液中加入过量的稀H2SO4使留下的cg铜恰好完全溶解;此时溶液中只留下一种盐。
①写出此时发生的化学反应方程式
②计算a与c的质量比及浓HNO3的物质的量浓度
![]()
化学答题卷
一、选择题:每题只有一个正确答案(1-16:每题2分,17-20每题3分,共44分).
|
| 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
|
|
|
|
|
|
|
|
|
|
|
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
|
|
|
|
|
|
|
|
|
|
|
二、简答(方程式或实验方案每空2分,其余每空1分,共48分)
21.(10分) (1) , , ,
。
(2)___________________。
(3) 。 ________________ , ________________ 。
22. (6分)(1) , 。
(2)_________, 。
23. (2分) 。
24(8分)(1)_ 。
(2) , , 。
(3) , 。
(4)
。
25(16分)(1)
(2) , ,
。
(3) 、 、 、 、 ; , 。
(4) , , 。
26、(6分)(1)
(2)
(3)
三、计算(8分)
27.(1)(4分)
(2)(4分)
高三年级第3次月考化学试卷答案
一、选择题:每题只有一个正确答案(20×2分=40分).
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| A | A | B | C | D | C | D | D | B | D |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| B | B | B | C | D | A | C | C | A | C |
二、简答(方程式或实验设计方案每空2分,其余每空1分,共49分)
21. (10分)(1)N2H4,高,差,N2H4+2HClŽ N2H6Cl2
(2)Nn Hn+2
(3)2N2H4(g) + 2NO2 (g) =
3N2 (g) + 4H2O(g) ; △H = — 1136 kJ/ mol。Na+[
O O ]2-Na+, ![]()
22. (6分)(1)阳极,2H2O+2e-=H2↑+2OH-
(2)负极,Cl2+2e-=2Cl-
23. (2分)DHJKM 。
24(8分)
|
(2) 试管A内的反应液中;略低于试管A的支管口处;控制馏分的温度,收集含乙酸的馏分
(3)使试管A内的反应液均匀受热;甘油 或 乙二醇
(4)方法一:将少量碳酸氢钠粉末放入一个洁净的试管中,加入少量试管C中的液体,若有气体产生,则说明试管C中有产物乙酸;
方法二:把一小块pH试纸放在表面皿(或玻璃片)上,用洁净、干燥玻璃棒蘸取试管C内的液体,点在pH试纸中部,试纸变色后,用标准比色卡比较确定溶液的pH,进而说明是否有乙酸生成。
25(16分)(1) ACF
 (2)
(2)
,,
取代反应。
(3) 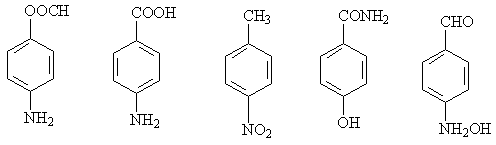 ,
,
氨基、硝基、羧基等。
(4)不是,4,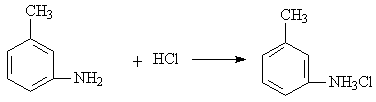
26、(6分)(1)
(2)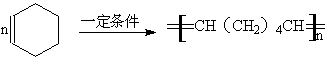
(3)
三、计算(8分)
27. 27.(8分)
(1)
①![]() (2分)
(2分)
② NO2: (3V1-3V2)/44.8 NO: (3V2-V1)/44.8(各1分)
(2) ① 3Cu+Cu( NO3)2 +4H2SO4 ==4CuSO4+2NO↑+4H2O; (1分)
② 4:3(1分); ![]()
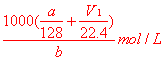 (2分)
(2分)