高三年级化学诊断性测试
化 学 试 题
说明:
1.本试卷分为Ⅰ卷(选择题)和Ⅱ卷(非选择题)两部分。满分100分,考试时间90
分钟。
2.考生请将第Ⅰ卷选择题的正确选项填涂在答题卡上。考试结束后,只收答题卡和第
Ⅱ卷。
可能用到的相对原子质量:H—1 O—16 Na—23 S—32 C—12 N—14
C1—35.5 Li—7 Zn—65 Ag—108 Pb—207
第Ⅰ卷(选择题,共40分)
说明:本卷包括20小题,每小题2分,共40分,每小题只有一个选项符合题意。
1.下列不符合现代化学研究方向的是 ( )
A.发现新物质 B.合成新材料
C.研究化学反应的微观过程 D.研究化学反应中原子守恒关系
2.根据相关化学原理,下列判断正确的是 ( )
A.若X的质子数为a,中子数为b,则X的质量数为:a - b
B.若A2+2D- 2A-+D2,则氧化性:D2>A2
C.若R2-和M+的电子层结构相同,则原子序数:R>M
D.若弱酸HA的酸性强于弱酸HB,则同浓度钠盐溶液的碱性:NaA<NaB
3.2005年,欧洲航天局的惠更斯号探测器首次成功登陆土星的最大卫星—土卫六。科学家对探测器发回的数据进行分析,发现土卫六的大气层中含有95%的氮气,剩余的气体为甲烷和其他碳氢化合物。下列关于碳氧化合物的叙述正确的是 ( )
A.碳氢化合物的通式为CnH2n+2 B.石油的主要成份是碳氧化合物
C.甲烷的含碳量最高的碳氢化合物 D.碳氧化合物中的化学键不一定是共价键
4.阿伏加德常数为6.02×1023mol-1,下列叙述中正确的是 ( )
A.常温常压下,18.0g重水(D2O)所含的电子数为10×6.02×1023
B.电解食盐水若产生2g氢气,则转移的电子数目为6.02×1023
C.标准状况下,aL甲烷和乙烷混合气体中分子数约为![]() ×6.02×1023
×6.02×1023
D.标准状况下,22.4L苯中所含的分子数为6.02×1023
5.下列反应的离子方程式正确的是 ( )
A.少量SO2通入NaOH溶液;2OH-+SO2=SO32-+H2O
![]() B.硫化钠水解:S2-+2H2O H2S+2OH-
B.硫化钠水解:S2-+2H2O H2S+2OH-
C.氢化铵与氢氧化钠两种浓溶液混合加热:OH-+NH4+=NH3·H2O
D.单质铜与稀硝酸反应:Cu+2H++2NO3-=Cu2++2NO↑+H2O
6.下列各组离子在指定条件下,一定能大量共存的是 ( )
A.能使蓝色石蕊试纸变红色的溶液中:K+、Na+、CO32-+NO3-
B.c(H+)=1×10-1mol·L-1的溶液中:Cu2+、A13+、SO42-、NO3-
C.能使碘化钾淀粉试纸变蓝的溶液中:Na+、NH4+、S2-、Br-
|
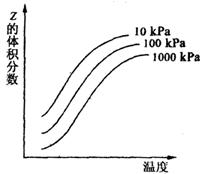
![]() 7.右图是温度和压强对X+Y 2Z反应
7.右图是温度和压强对X+Y 2Z反应
影响的示意图。图中横坐标表示温度,
纵坐标表示平衡混合气体中Z的体积
分数。下列叙述正确的是 ( )
A.Z一定为气态
B.X、Y、Z均为气态
C.X和Y一定不能为气态
D.上述反应的逆反应的△H>0
8.同一主族的两种元素的原子序数之差不可能是 ( )
A.16 B.26 C.36 D.46
9.若以![]() 分别表示浓度为amol·L-1和bmol·L-1氨水的质量分数,且知2a=b,则下列
分别表示浓度为amol·L-1和bmol·L-1氨水的质量分数,且知2a=b,则下列
推断正确的是 ( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
10.下列金属①铁 ②镁 ③锰 ④钒 ⑤铬 可用铝热法制备的是 ( )
A.①②④ B.①②③⑤
C.①③④⑤ D.①②③④⑤
11.锂离子电池已经成为新一代实用化的蓄电池,该电池具有能量密度大,电压高的特性。锂离子电池放电时的电极反应式为
负析反应:C6Li-xe-=C6Li1-x+xLi+(C6Li表示锂原子嵌入石墨形成复合材料)
正极反应:Li1-xMO2+xLi++xe-=LiMO2(LiMO2表示含锂的过渡金属氧化物)
下列说法错误的是
A.锂离子电池充电时电池反应为C6L1-x+LiMO2=C6Li+Li1-xMO2
B.电池反应中,锂、锌、银、铅各失去1mol电子,金属锂所消耗的质量最小
C.锂离子电池放电时电池内Li+向负极移动
D.锂离子电池充电时阴极反应为:C6Li1-x+xLi++xe-=C6Li
12.常温下,pH=2的盐酸和pH=2的醋酸等体积混合后,假设混合溶液的体积为盐酸和醋酸溶液的体积之和,则溶液的pH为 ( )
A.等于2 B.大于 2
C.小于2 D.无法确定
13.溴化碘的分子式IBr,它的化学性质活泼,能与大多数金属反应,其与H2O反应的化学方程式为:IBr+H2O=HBr+HIO。下列叙述不正确的是 ( )
A.溴化碘为共价化合物
| |
C.IBr与水的反应为非氧化还原反应
D.在化学反应中,IBr可以作为氧化剂
14.科学家发现了116号元素的一种稳定的核素,下列关于它的性质预测错误的是( )
A.它原子最外层有6个电子 B.它是主族元素
C.它具有-2、+4、+6价 D.它是一种金属元素
|
A.与氢氧化钠反应
B.与稀硫酸反应
C.发生酯化反应
D.使紫色石蕊变红
16.有机化合物分子中双键上的碳原子与其他原子(或原子团)直接结合生成新的化合物分子的反应是加成反应。下列过程与加成反应无关的是 ( )
A.苯与溴水混合振荡,水层颜色变浅
B.裂化汽油与溴水混合振荡,水层颜色变浅
C.乙烯与水在一定条件下反应制取乙醇
D.乙烯与氯化氢在一定条件下反应取纯净的一氯乙烷
17.下列所采取的分离方法正确的是 ( )
A.由于碘在酒精中的溶解度大,所以可用酒精将碘水中的碘萃取出来
B.水的沸点是100℃,酒精的沸点是78.5℃,所以可用直接加热的蒸馏法使含水酒精变为无水酒精
C.可用冷却热的饱和氯化钾和氯化钠的溶液的方法得到纯净的氯化钠晶体
D.由于胶体微粒的粒度比离子大,所以碘化钾混入淀粉中可用渗析法分离
18.25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
19.下列各组热化学方程式中,化学反应的△H前者大于后者的是 ( )
①![]()
②![]()
③![]()
④![]()
A.① B.④ C.②③④ D.①②③
|
20.在反应SiO2+3C SiC+2CO中,氧化剂和还原剂物质的量之比是 ( )
A.1:3 B.3:1 C.1:2 D.3:1
第Ⅱ卷(非选择题,共60分)
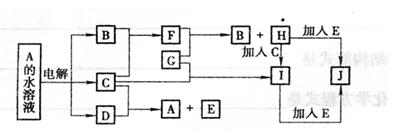
|
(1)E是 ,I是 ,I溶液蒸干灼烧得 (均填化学式)。
(2)写出C的水溶液与SO2反应的离子方程式 ,
(3)写出I+E→J在水溶液中反应的离子方程式 ,
| |
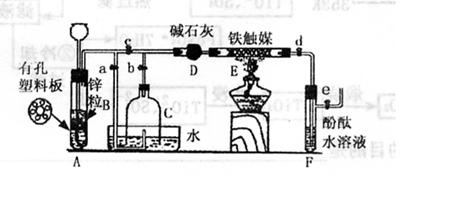
|
[实验操作]①检查实验装置的气密性后,关闭弹簧夹a、b、c、d、e。在A中加入锌粒,向长颈漏斗中注入一定量稀硫酸,则A中有氢气生成。打开弹簧夹c、d、e,在F出口处收集氢气并检验其纯度。
②关闭弹簧夹c,取下截去底部的细口瓶C,打开弹簧夹a,将氢气经导管B验纯后点燃,然后立即罩上无底细口瓶C,塞紧瓶塞,如图所示。氢气继续在瓶内燃烧,几分钟后火焰熄灭。
③用酒精灯加热反应管E,继续通氢气,待无底细口瓶C内液面下降到保持不变时,找开弹簧夹b,无底细口瓶C内气体经D进入反应管E,片刻后F中的溶液变红。
回答下列问题:
(1)检验氢气纯度的目的是 。
(2)C瓶内液面下降到保持不变时,A装置内发生的现象是 ,防止了实验装置中压强过大;此时再打开弹簧夹b的主要目的是 。
(3)在步骤③反应完成后,如果验证反应后的气体中还含有H2、N2?
|
23.(12分)将煤转化为水煤气的主要化学反应为C(s)+H2O(g) CO(g)+H2(g),C(S),CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1
H2(g)+![]() O2(g)=H2O(g) △H=-242.0kJ·mol-1
O2(g)=H2O(g) △H=-242.0kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) △H=-283.0kJ·mol-1
O2(g)=CO2(g) △H=-283.0kJ·mol-1
请回答:
(1)根据以上数据,写出C(s)与水蒸汔反应的热化学方程式:
(2)比较反应热数据可知,1molCO(g)和1molH2(g)完全燃烧放出的热量之和比1molC
(s)完全燃烧放出的热量多,甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律作出的下列循环图:
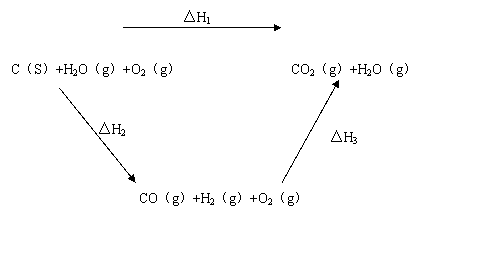 |
并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。
请分析:甲、乙两同学观点正确的是 (填“甲”或“乙”);判断的理由是
。
(3)将煤转化为水煤气为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点
。
(4)水煤气不仅是优良的气体燃料,也是重要的有机化工原料。CO和H2在一定条件下可以合成:①甲醇 ②甲醛 ③甲酸 ④乙酸。试分析当CO和H2按1:1的体积比混合反应,合成上述 (填序号)物质时,可以满足“绿色化学”的要求,完全利用原料中的原子,实现零排放。
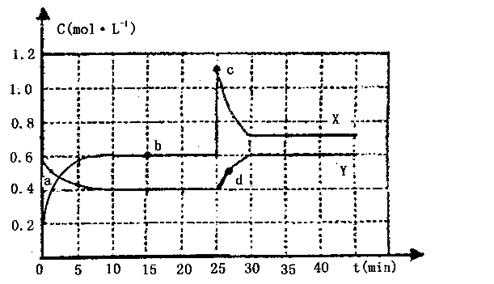
![]() 24.(12分)已知NO2和N2O4可以相互转化:2NO2(g) N2O4(g);△H<0,现将一定量NO2和N2O4的混合气体通入一体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如下图所示。根据下图,回答下列问题:
24.(12分)已知NO2和N2O4可以相互转化:2NO2(g) N2O4(g);△H<0,现将一定量NO2和N2O4的混合气体通入一体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如下图所示。根据下图,回答下列问题:
|
(1)图中共有两条曲线X和Y,其中曲线 表示N2O4浓度随时间的变化a、b、c、d四个点中,表示化学反应处于平衡状态的是
,并计算该点时反应的平衡常数为
。
(2)反应进行到25min时,曲线发生变化的原因是
;若要达到最后相同的化学平衡状态,在25min时还要以采取的措施是 。
A.升高温度 B.缩小容器体积
C.加入催化剂 D.加入一定量的N2O4
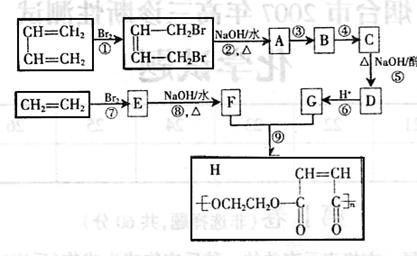
说明:下列25、26两小题是选考部分的内容,考生只需选答其中一小题,若选答两小题,则只按25小题计分。
|
请按要求填空:
(1)写出下列反应的反应类型:① 反应,⑧ 反应。
(2)写出③④中某一步反应是与HC1的加成反应,该反应是 (填反应序号);设计该步反应的目的是
。
(3)物质D的结构简式是 。
(4)反应⑨的化学方程式式是 。
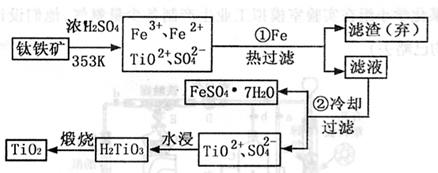
|
(1)步骤①加Fe的目的是 ;步骤②冷却的目的是 。
(2)上述制备TiO2的过程中,可以利用副产物是 ;考虑成本和废除物综合利用因素,废液中应加入 处理。
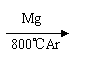
(3)由金红石(TiO2)制取单质Ti,涉及到的步骤为:TiO2→TiC14 Ti,反应
TiC14+2Mg=2MgC12+Ti在Ar气氛中进行的理由是
。
参考答案
选择题(本题包括20小题,每小题20分,共40分,每小题只有一个选项符合题意)
1.D 2.D 3.B 4.C 5.A 6.B 7.A 8.D 9.A
10.C 11.C 12.A 13.B 14.C 15.B 16.A 17.D 18.B
19.C 20.C
21.(12分)
(1)NaC1O FeC13 Fe2O3(每空2分,共6分)
(2)SO2+C12+2H2O=4H++SO2-4+2C1-
Fe3++3C1O-+3H2O=Fe(OH)3↓+3HC1P(每空3分,共6分)
22.(14分)
(1)检验H2中是否混有空气,防止点燃时爆炸。(3分)
(2)锌粒与酸脱离(3分),使N2和H2进入反应管E,同时增大氢气的浓度(3分)
(3)将经过酚酞溶液后剩余的乞体干燥后通过足量灼热氧化铜粉末,再通过无水CuSO4,若无水CuSO4变蓝,证明剩余气体中有H2,然后用排水法收集,若仍然有气体剩余,证明剩余气体中有N2(5分)
23.(12分)
(1)C(s)+H2O(g)=CO(g)+H2(g) △H=+131.5kJ·mol-1
(2)乙(1分)同学甲忽略了煤转化为水煤气要吸收热量(2分)(或△H1=△H2+△H3且△H2>0)
(3)①减少污染 ②燃烧充分 ③方便 ④直接燃烧水煤气热量大(3分)
(4)②④(3分)
24.(12分)
(1)Y(2分)b(2分)![]() (mol·L-1)(3分)
(mol·L-1)(3分)
(2)增大NO2的浓度(3分)BD(2分)
25.(10分)
(1)加成 取代(每空1分,共2分)
(2)③(2分)保护A中“C=C”不被氧化(2分)
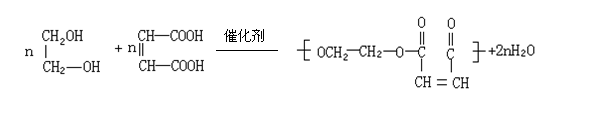 (3)NaOOC—CH=CH—COONa(2分)
(3)NaOOC—CH=CH—COONa(2分)
(4)
26.(10分)(每空2分,共10分)
(1)将Fe3+还原为Fe2+;析出(或分离或得到)FeSO4·7H2O
(2)FeSO4·7H2O;石灰(或石灰或废碱液)
(3)防止高温下空气部分气体参与反应而得不到钛