高三化学限时训练(1)------多练习,常反思
姓名 一次得分 (自评) 二次得分 (师评)
下列题目均有1到2个正确答案,每题4分,共60分
1、(2005年江苏)已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列反应在水溶液中不可能发生的是
A 3Cl2+6FeI2=2FeCl3+4FeI3
B Cl2+FeI2=FeCl2+I2
C Co2O3+6HCl=2CoCl2+Cl2↑+3H2O D
2Fe3++2I—=2Fe2++I2
2、已知I¯、Fe2+、SO2、Cl¯和H2O均有还原性,它们在本性溶液中还原性强弱的顺序为:
Cl¯<Fe2+<H2O2<I¯<SO2,则下列反应不能发生的是
A、2Fe3++SO2+2H2O==2Fe2++SO42¯+4H+
B、I2+SO2+2H2O==H2SO4+2HI
C、H2O2+H2SO4==SO2+O2+2H2O
D、2Fe2++I2==2Fe3++2I¯
3、(1998年上海)根据下列反应判断有关物质还原性由强到弱的顺序是
H2SO3+I2+H2O==2HI+H2SO4
2FeCl3+2HI==2FeCl2+2HCl+I2
3FeCl2+4HNO3==2FeCl3+NO+2H2O+Fe(NO3)3
A、H2SO3>I¯>Fe2+>NO B、I¯>Fe2+>H2SO3> NO
C、Fe2+>I¯>H2S>O3> NO D、NO>Fe2+> H2SO3>I¯>
4、(2004年春季)已知常温下在溶液中可发生如下两个离子反应
Ce4++Fe2+ Fe3++Ce3+
Sn2++2Fe3+ 2Fe2++Sn4+
由此可以确定Fe3+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是
A.Sn2+、Fe3+、Ce3+ B.Sn2+、Ce3+、Fe2+
C.Ce3+、Fe2+ 、Sn2+ D.Fe3+、Sn2+、Ce3+
5、(2006年广东)某金属氧化物在光照下可生成具有很强氧化能力的物质,能用来消除空气或水体中的污染物。下列有关该金属氧化物的应用的叙述不正确的是
A.将形成酸雨的SO2氧化为SO3
B.将家居装修挥发出的甲醛氧化为CO2和H2O
C.将医药废水中的苯酚氧化成H2O和CO2
D.将电镀废水中的氰根离子CN-氧化成CO2和N2
6、(2004年上海)设NA为阿佛加德罗常数,下列叙述中正确的是
A.46 g NO2 和 N2O4混合气体中含有原子数为3NA
B.标准状况下22.4 L H2 中含中子数为2NA
C.1L 1mol/L醋酸溶液中离子总数为2NA
D.1molMg与足量O2或N2反应生成MgO或Mg3N2均失去2NA个电子
7、(2004年江苏)阿伏加德罗常数约为6.02×1023mol-1。下列叙述中正确的是
A.标准状况下,2.24L苯中约含有3.612x10z:个碳原子
B.常温常压下,氧气和臭氧的混合物16s中约含有6.0Q×1O23个氧原子
C.25℃时,1 L pH=13的氢氧化钠溶液中约含有6.02×l023个氢氧根离子
D.0.5mol CH4中约含有3.01×1024个电子
8、在20恒温下,将CO、CO2和CH4分别放入三个容器中,使它们的密度相同,三个容器中的压强大小关系应为
A、p(CO2)<p(CO)<p(CH4) B、p(CO) <p(CO2)<p(CH4)
C、p(CO) <p(CH4) < p(CO2) D、p(CO2)<p(CH4)<p(CO)
9. (2000年广东)同温同压下两个容积相等的贮气瓶,一个装有C2H4,另一个装有C2H2和C2H6薄 的混合气体,两瓶内的气体一定具有相同的
A.质量 B.原子总数 C.碳原子数 D.密度
10、(2005年广州模拟)在某温度下,将200g KNO3溶液蒸发掉10g水或向其中加入10g KNO3固体,均可使溶液达到饱和,则该温度下饱和溶液中溶质的质量分数是
A、20% B、47.5% C、50% D、52.5%
11、将40℃的饱和硫酸铜溶液升温至50℃,或者温度仍保持在40℃并加入少量无水硫酸铜,在这两种情况下均保持不变的是
A、硫酸铜的溶解度 B、溶液中溶质的质量分数
C、溶液的质量 D、溶液中Cu2+的数目
12、(2003年上海)某温度下,甲、乙两个烧杯中各盛有100 g相同浓度的KCl溶液,现将甲烧杯中的溶液蒸发掉35gH2O,析出晶体5g;乙烧杯中的溶液蒸发掉45gH2O,析出晶体10g。则原溶液的质量分数为
A 10% B 15% C 20% D 25%
13. 将标准状况下的aLHCl(气)溶于1000g水中,得到盐酸密度为bgcm-3,则该盐酸的物质的量浓度是
(A)a/22.4molL-1 (B)ab/22400molL-1
(C)ab/(22400+36.5a)molL-1
(D)1000ab/(22400+36.5a)molL-1
14、(2003年上海)13C—NMR(核磁共振)、15N—NMR可用于测定蛋白质、核酸等生物大分子的空间结构,KurtW ü thrich等人为此获得2002年诺贝尔化学奖。下面有关13C、15N叙述正确的是
A 13C与15N有相同的中子数 B 13C与C60互为同素异形体
C 15N与14N互为同位素 D 15N的核外电子数与中子数相同
15、(2006年广东)SO42-和 S2O82-结构中,硫原子均位于由氧原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构。下列说法正确的是
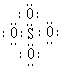
A. SO42-的电子式为 B.S2O82-中没有非极性键
C.S2O82-比SO42- 稳定 D.S2O82-有强氧化性