专题十四 非金属元素专题复习
悦来中学 高三化学备课组
[考点分析]
1.了解卤族、碳族、氧族、氮族主要物质的物理性质和化学性质。
2.从原子的核外电子排布,理解卤族、氧族、氮族等元素单质的相似性和递变性。
3.了解水、氢化物的性质、用途及变化规律。
4.了解氧气、臭氧、双氧水的性质、用途及变化规律
[例题解析]
例1 1mol H2燃烧时约放热286KJ,而每kg汽油燃烧时约放热46000KJ.而氢气却被公认是21世纪替代石化燃料的理想能源.请试述理由.
解析 ①燃料发热量的高低要看单位质量的物质放热量的多少.
H2 ~ Q 汽油 ~ Q
2g 286KJ 1000g 46000KJ
1g 143KJ 1g 46KJ
由此可知:每1g H2、汽油燃烧发热量前者大
②燃料是否理想,还要看来源是否丰富、燃烧对大气和环境保护是否有利.
氢气作为未来理想能源有三大优点:
①单位质量的H2燃烧发热量大.②资源丰富.③燃烧后不产生污染.
思考 Si、Al均能与强碱溶液反应放出H2.野外考察工作有时需要H2,为何一般选择Si而不用Al?
提示 从单位质量的Si、Al分别与碱液反应放出H2量的多少考虑.
例2 将含O2和CH4的混合气体充入装有23.4g Na2O2的密闭容器中点燃,反应结束后,容器温度为150℃,压强为Opa.将残留物溶于水无气体逸出.下列叙述正确的是( )
A.原混合气体中O2和CH4的体积比为2:1
B.原混合气体中O2和CH4的体积比为1:2
C.残留固体中有Na2CO3和NaOH
D.残留固体中只有Na2CO3
解析 若CH4与O2体积为1:2,则恰好反应,当气体产物通过Na2O2后必有O2生成,不合题意.
又根据氢、碳元素守恒,反应后的固体必为Na2CO3和NaOH的混合物.
由题意可知,最终反应后无Na2O2多余,也无气体多余.可用方程式的代数处理来求出CH4和O2的体积比.
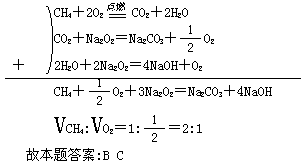
已知氧化铜在高温下可发生分解 4CuO![]() 2Cu2O+O2,生成的Cu2O也能被H2还原为Cu.(1)若将10g CuO在高温下部分分解后,再通入氢气使剩余固体全部还原成铜,消耗0.225g H2,则原氧化铜的分解率是多少?(2)若将mg CuO在高温下部分分解后,再通入ng H2,即可使剩余固体全部还原成铜,则原氧化铜的分解率是多少?n的取值范围是多少?(3)仍取mg CuO.并保持(2)的分解率不变,假设通入H2后固体被还原是按
2Cu2O+O2,生成的Cu2O也能被H2还原为Cu.(1)若将10g CuO在高温下部分分解后,再通入氢气使剩余固体全部还原成铜,消耗0.225g H2,则原氧化铜的分解率是多少?(2)若将mg CuO在高温下部分分解后,再通入ng H2,即可使剩余固体全部还原成铜,则原氧化铜的分解率是多少?n的取值范围是多少?(3)仍取mg CuO.并保持(2)的分解率不变,假设通入H2后固体被还原是按![]() 的顺序进行的,以x表示通入H2的质量(单位:g),试填写下表
的顺序进行的,以x表示通入H2的质量(单位:g),试填写下表
| 还原后剩余固体成分 | CuO和Cu2O | Cu2O和Cu |
| x的取值范围 |
|
|
解析 (1)设CuO的分解率为α
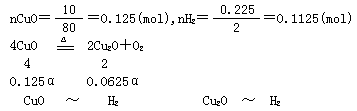
0.125(1-α) 0.125(1-α) 0.0625α 0.0625α
0.125(1-α)+0.0625α=0.1125
α=20%
(2)同理可得

注意:因原固体CuO部分分解,且最后固体成分有两种,故x的取值范围只能是开区间.
【方法归纳】
方法与技巧
1.每族元素抓住代表物.重点讨论该元素的单质、氧化物、氢化物、酸、碱或盐等有关知识.
2.注意该族元素与其代表物在结构、性质上的相似性、递变性和特殊性.
3.研究结构应分三层次考虑.
(1)原子结构(价电子数、原子半径、核电荷数等)
(2)分子结构(主要指化学键的种类及牢固程度)
(3)晶体结构(构成微粒、微粒间的作用力、空间构型等)
4.理清下列关系.
5.元素化合物知识网络化
元素化合物的知识在中学化学教材中占有较重的比例,内容繁多琐碎,要尽可能以最佳的方法或方式来总结成网络图,主线明确、脉络清晰.
(二)非金属元素在周期表中的位置及结构特点.
(1) 除H外,非金属元素均在“阶梯线”的右上方
(2) 非金属元素(包括稀有元素)均在主族(零族)
(3) 最外层电子数一般≥4(H.B除外)
(4) 原子半径比同周期金属半径小.(稀有元素除外)
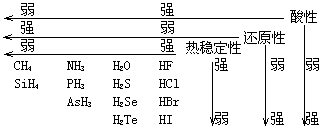
(三)非金属元素的性质及递变规律
1.单质:
(1)结构:除稀有气体外,非金属原子间以共价键结合.非金属单质的成键有明显的规律性.若它处在第N族,每个原子可提供8-N个价电子去和8-N个同种原子形成8-N个共价单键,可简称8-N规则;(H遵循2-N规则).如ⅦA族单质:x-x;H的共价数为1,H-H,第ⅥA族的S,Se、Te共价单键数为8-6=2,第ⅤA族的P、As共价单键数8-5=3.但第二周期的非金属单质中N2、O2形成多键.
2.熔沸点与聚集态
它们可以分为三类:
①小分子物质.如:H2、O2、N2、Cl2等,通常为气体,固体为分子晶体.
②多原子分子物质.如P4、S8、As等,通常为液态或固态.均为分子晶体,但熔、沸点因范德华力较大而比①高,Br2、I2也属此类,一般易挥发或升华.
③原子晶体类单质,如金刚石、晶体硅和硼等,是非金属单质中高熔点“三角区”,通常为难挥发的固体.
3.导电性
非金属一般属于非导体,金属是电的良导体,而锗、硅、砷、硒等属于半导体.但半导体与导体不同之一是导电率随温度升高而增大.
4.化学活性及反应
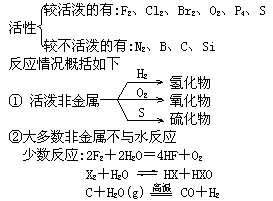
③非金属一般为成酸元素,难以与稀酸反应.
固体非金属能被氧化性酸氧化.
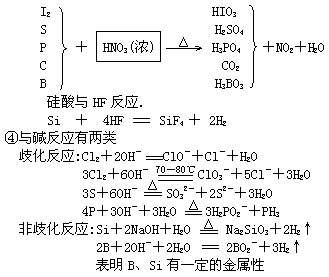
 2.氢化物
2.氢化物
3.卤化物:易水解
![]()
如 PCl3+3H2O=H3PO3+3HCl
SiCl4+3H2O=H2SiO3+4HCl
BCl3+3H2O=H3BO3+3HCl
BrF5+3H2O=HBrO3+5HF
利用此法可制得氢卤酸和含氧酸
4.含氧酸
① 同周期非金属元素最高价含氧酸从左到右酸性增强
② 氧化性:同种元素低价强于高价含氧酸
如: HClO>HClO3>HClO4(稀)
H2SO3>H2SO4(稀)
HNO2>HNO3(稀)
(四)氢气 水.
1.氢气:常温不很活泼,大多需高温(点燃)或用催化剂.高温下,作很好的还原剂.
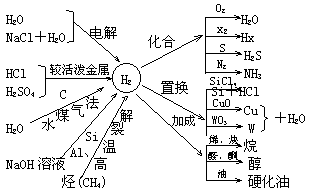
2.水
(1)水参与的反应
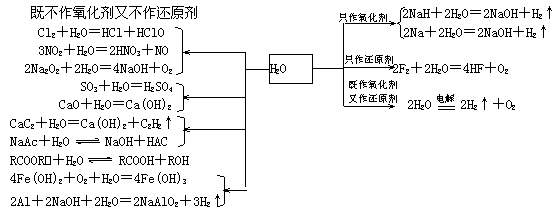
(2)水处理
①除去悬浮物:用明矾或FeCl3.
②脱色去味:用活性炭.
③杀菌消毒:用液氯、漂白粉、CuSO4.
④硬水软化:煮沸法、药剂法、离子交换法
想一想:每种方法的原理是什么?分属何种变化?
2.命题趋向
重点考查各族元素的单质及其化合物的性质。物质的特性是相对于共性而言的,掌握特性比共性更重要元素化合物知识与现代生产、科学技术、日常生活、医疗保健等方面有着广泛的联系。是高考的重点和热点
[专题训练]
1.在密闭容器中盛有H2、O2、Cl2的混合气体,通过电火花点燃,三种气体正好完全反应,冷却至室温后,所得溶液溶质的质量分数为25.26%,则容器中原有H2、O2、Cl2的分子个数比是( )
A.6:3:1 B.9:6:1 C.13:6:1 D.10:6:1
2.将水加入到下列物质中能发生反应,且有气体产生的是( )
①NaH ②Na2O ③Na2S ④Mg3N2 ⑤Al2S3 ⑥CaC2 ⑦NH4HCO3
A.①②⑤⑥⑦ B.①②④⑤⑥ C.①③④⑤ D.①②⑤⑥
3.有一金属钠与过氧化钠的混合物,与过量水充分反应后,产生的气体,用电火花引燃后,恢复到标准状况,测得剩余气体体积为1.12L,则原混合物中钠与过氧化钠的物质的量之比不可能的是( )
A.1:3 B.3:1 C.2:1 D.1:2
4.两份质量都是Ng的硫粉,分别与足量的氢气、氧气完全反应,混合反应后的生成物,使之充分反应,可析出硫的质量是(单位:g)( )
A.2N B.1.5N C.N D.0.5N
5.120℃时,将2LH2O、1LCO、1LO2和2LCO2组成的混合气体,依次缓慢通过炽热铜粉.过量过氧化钠和过量炽热的炭粉的三个反应管.经充分反应后恢复到原条件时气体的体积为( )
A.6L B.5L C.4L D.3L
6.某种H2和CO的混合气体,其密度为相同条件下O2密度的1/2.将3.2g这种混合气充入一盛有足量Na2O2的密闭容器中,再通入过量O2,并用电火花点燃使其充分反应,最后容器中固体的质量增加了( )
A.3.2g B.4.4g C.5.6g D.6.4g
7.2003年10月15日9时,我国成功发射了“神州五号”载人飞船,其在遨游太空20多小时后准确降落。我国成为第三个把人送上太空的国家!“神州五号”的成功发射对增强我国的国防力量和提高我国的国际地位都具有重要意义。
(1)肼(N2H4)是发射航天飞船常用的高能燃料。将NH3和NaClO按一定物质的量比混合反应,生成肼、NaCl和水,写出该反应的化学方程式: ;该反应中 是氧化剂、 是氧化产物。
(2)在火箭推进器中装有强还原剂肼和强还原剂过氧化氢,当它们混合时,即产生大量气体,并放出大量热。已知12.8g液态肼与足量过氧化氢反应生成氮气和水蒸气,放出256.65kJ的热量;1mol液态水变成1mol水蒸气需要吸收44kJ的热量。写出液态肼与过氧化氢反应生成液态水的热化学方程式: 。
(3)若在宇宙飞船的太空实验室(失重条件下)进行以下实验,其中最难完成的是( )
将金粉和铜粉混合 B、将牛奶加入水中混合
C、蒸发食盐水制取食盐晶体 D、用漏斗、滤纸过滤除去水中的泥沙
(4)新型无机非金属材料在航天事业上有广泛应用。氮化硅陶瓷是一种重要的结构材料。氮化硅(Si3N4)晶体是一种超硬物质,耐磨损、耐高温。氮化硅晶体类型是 ;晶体中存在的化学键是 。
8.已知氢化钠与水反应放出氢气.现有氢化钠和铝粉的混合物mg,与足量水充分反应后,收集到的气体为ng,试回答:
(1)若充分反应后得到只含一种物质的水溶液时,该物质是________;则原混合物中氢化钠与铝粉的物质的量之比为________,质量比为________.
(2)当物质的量之比:NaH:Al≤_______时,铝粉质量为_______;当物质的量之比:NaH:Al>_______时,铝粉的质量为________.
9.如图所示,在一密闭容器中间用一不漏气,
可滑动的活塞隔开,左边充洁净空气,右边充H2、O2混合气,在室温下引燃后恢复到原室温,若活塞原来离容器左端的距离为1/4(A)反应后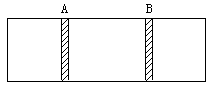 活塞静止在离右端1/4处(B),求原来H2和O2的体积比.
活塞静止在离右端1/4处(B),求原来H2和O2的体积比.
[参考答案]
1.C 2.B 3.C 4.B 5.B 6.A
7.(1)2NH3+NaClO=N2H4+NaCl+H2O NaClO N2H4
(2)N2H4(l)+2H2O2(l)=N2(g)+4H2O(l);△H=-817.625KJ/mol (3) D
(4)原子晶体 共价键
8.(1)NaAlO2; 1:1,8:9 (2)1:1 (m-4.8n)g 1:1 (36n-3m)g
9.V(H2):V(O2)=16:11或19:8