高三十校大联考第一次考试化学试卷
|
|
醴陵一中 澧县一中 郴州二中 益阳市一中 桃源县一中
本卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分
可能用到的相对原子质量:
H:1 Li:7 C:12 O:16 F:19 Na:23 S:32
Cl:35.5 K:39 Cu:64 Br:80 Ag:108 I:127
第I卷(选择题 共48分)
一、选择题(本题包括16小题,每小题3分,共48分。每小题只有一个选项符合题意)
1、生活中碰到的某些问题,常涉及到化学知识,下列分析不正确的是
A、Mg(OH)2和Al(OH)3热分解生成的气态水可覆盖火焰、驱逐O2、稀释可燃气体,分解产物MgO和Al2O3能较快地与塑料燃烧过程中产生的酸性及腐蚀性气体反应,所以它们可以作为未来发展方向的无机阻燃剂。
B、用灼烧并闻气味的方法区别纯棉织物和纯毛织物。
C、某雨水样品采集后放置一段时间,pH值由4.68变为4.28,是因为水中溶解了较多的CO2。
D、蒙古牧民喜欢用银器盛放鲜牛奶有其科学道理:用银器盛放鲜牛奶,溶入的极微量的银离子,可杀死牛奶中的细菌,防止牛奶变质。
2.叠氮酸(HN3)与醋酸酸性相近,其盐稳定,但撞击时会发生爆炸生成氮气。有关叠氮酸的叙述中正确的是
①NaN3 的水溶液呈碱性 ② HN3 的固体属于共价化合物
③NaN3 的固体属于离子化合物 ④NaN3可用于小汽车防撞保护气囊
A、①②③ B、②③④ C、①③④ D、①②③④
3.下列各组物质间反应可能包括多步反应,其总的离子方程式正确的是
A.在硫酸工艺流程中,对尾气中的SO2用过量的氨水吸收的反应
2 NH3·H2O + SO2 = 2NH4+ + SO32- +H2O
B.FeCl2在空气中被氧化 4Fe2+ + O2 + 2H2O = 4Fe3+ + 4OH-
C.工业上制备漂粉精的反应 Cl2 + 2OH- = Cl- + ClO- + H2O
D.FeBr2 (aq) 中通入少量Cl2 2Fe2+ + 4Br— + 3Cl2 = 2Fe3+ + 2 Br2 + 6Cl—
4、次氯酸盐最大的用途是漂白和消毒。这类漂白剂氧化能力是以“有效氯”的含量来标志。“有效氯”的含量定义为:从HI中氧化出相同量的I2所需Cl2的质量与指定化合物的质量之比,常以百分数表示。请问纯LiClO的“有效氯”为
A、121% B、100% C、89% D、21%
5.现有5 mL Ag+浓度为0.1 mol·L-1的某溶液,加入等物质的量的某种碱金属盐,待卤化物完全沉淀后,经过滤、干燥,称得质量为0.013 g,则此沉淀是
A.LiF B.LiCl C.AgF D.AgCl
6.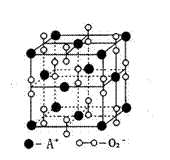 某离子晶体的晶体结构示意图如右图,晶体中氧的化合价可看作部分为0价,部分为-2价。则下列说法错误的是
某离子晶体的晶体结构示意图如右图,晶体中氧的化合价可看作部分为0价,部分为-2价。则下列说法错误的是
A、晶体中与每个A+距离最近的A+有12个
B、晶体中,阴离子与阳离子个数之比为1:1
C、该离子晶体化学式为A2O2
D、晶体中,0价氧原子与-2价氧原子的数目比为3:1
7.有机物分子中原子(或原子团)间的相互影响会导致化学性质的不同。下列叙述不能说明上述观点的是
A.苯酚能与NaOH溶液反应,而乙醇不能
B.乙醛能与H2发生加成反应,而乙酸不能
C.苯酚与溴水作用可得三溴苯酚,而苯与纯溴作用要在催化剂作用下才得到一溴代物
D.乙烯可发生加成反应,而乙烷不能
8.2005年1月14日,成功登陆“土卫六”的“惠更斯”号探测器发回了350张照片和大量数据。分析指出,土卫六“酷似地球经常下雨”,不过“雨”的成份是液态甲烷。下列关于土卫六的说法中,不正确的是
A.土卫六上存在有机分子 B.地表温度极高
C.地貌形成与液态甲烷冲刷有关 D.土卫六上形成了甲烷的气液循环系统
9.NA表示阿伏加德罗常数的值,则下列叙述正确的是
A.6.8g熔融的KHSO4中含有0.1NA个阳离子
B.1mol羟基所含电子数比1mol OH—所含电子数少 NA个
C.2L 0.5mol/L的醋酸溶液中含有CH3COO-NA个
D.2g超重氢气中含有NA个中子
10.向含下列微粒的溶液中,①HS-、②Fe2+、③![]() 、④
、④![]() 分别加入少量氢氧化钠固体,或少量浓盐酸或几滴酸性KMnO4溶液。(溶液体积变化忽略不计),都使溶液中对应的离子或分子浓度减少的是
分别加入少量氢氧化钠固体,或少量浓盐酸或几滴酸性KMnO4溶液。(溶液体积变化忽略不计),都使溶液中对应的离子或分子浓度减少的是
A.①② B.②③ C.①④ D.③④
11.将石墨置于熔融的钾或气态钾中,石墨会吸收钾而形成称为钾石墨的物质,其组成是C8K、C24K、C36K、C48K和C60K。在钾石墨中,钾原子把价电子交给石墨层,但在遇到与金属钾易反应的其他物质时还会收回。在钾石墨中,钾元素处于石墨层中间,因而石墨层之间被胀大,层间的距离增加。下列对钾石墨的叙述中正确的是
A.钾石墨是一类离子化合物 B.钾石墨导电性比石墨弱
C.钾石墨与水相遇不发生任何反应 D.题干中的5种钾石墨属于同素异形体
12.用石墨做电极,电解氯化铜和氯化钠的混合溶液,在任何情况下,阴、阳两极下不可能同时发生的反应是
A.阴极:2H++2e—=H2↑ 阳极:4OH——4e—=2H2O+O2↑
B.阴极:2H++2e—=H2↑ 阳极:2Cl——2e—=Cl2↑
C.阴极:Cu2++2e—=Cu 阳极:4OH——4e—=2H2O+O2↑
D.阴极:Cu2++2e—=Cu 阳极:2Cl——2e—=Cl2↑
13.已知氯酸钾与蔗糖反应的产物为KCl、CO2和H2O,则氧化产物与还原产物的物质的量之比为
A.3︰2 B.2︰3 C.8︰1 D.1︰8
14.在500℃时,向甲容器中充入1 mol SO3,向相同容积的乙容器中充入1 mol SO2和0.5 mol O2。若甲容器保持容积不变,乙容器保持压强不变,分别达到平衡,下列说法正确的是
A.平衡时容器内的压强:甲﹥乙 B.平衡时容器内的压强:乙﹥甲
C.平衡时容器内O2的体积分数:乙﹥甲
D.平衡时容器内SO3的体积分数:甲﹥乙
15. 用惰性电极电解+1价汞的硝酸盐溶液时,阴极上得到的产物是单质汞。当阴极消耗2mol该盐的阳离子时,阳极可得到1mol的气体产物,以下正确的是
A阳极上产生氢气 B电解时要消耗OH--,故溶液的PH值减小
C阴极的电极反应式:O2+2H2O+4e-=4OH- D阳极的电极反应式:Hg++e-=Hg
16.近几年一种新型的甜味剂木糖醇悄悄地走入生活,进入人们的视野,因为木糖醇是一种理想的蔗糖代替品,它具有甜味足,溶解性好,防踽齿,适合糖尿病患者的优点。木糖醇是一种白色粉末状的结晶,分子式为C5H12O5,结构式为CH2OH(CHOH)3CH2OH,下列有关木糖醇的叙述中不正确的是
A.木糖醇与葡萄糖、果糖等一样是一种单糖
B.已知木糖醇的溶解度随着温度的升高而增大,说明木糖醇的溶解过程是一个吸热过程
C.木糖醇是一种五元醇 D.木糖醇是一种无糖型植物甜味剂
第错误!未找到引用源。卷(非选择题,共62分)
二、(本大题共14分)
17.某研究性学习小组的一个课题是“NO2能否支持木条的燃烧?”由于实验室中没有现成的NO2气体,该小组的同学设计了两个方案(忽略N2O4的存在,图中铁架台等夹持仪器均已略去):
Ⅰ.实验装置如下图1所示

图1 图2
(1)浓硝酸受热分解的化学方程式是 。
(2)实验开始后木条上的火星逐渐熄灭,有的同学得出“NO2不能支持木条的燃烧”的结论。你认为这一结论是否正确? (填“正确”或“不正确),理由是 。
Ⅱ.实验装置如上图2所示
(1)硝酸铜固体加热分解的产物有氧化铜、二氧化氮和氧气,该反应的化学方程式是 。
(2)当集气瓶中充满红棕色气体时,木条复燃了,有的同学得出“NO2能支持木条的燃烧”的结论。你认为这一结论是否正确? (填“正确”或“不正确”),理由是 。
Ⅲ.为了更直接说明“NO2能否支持木条的燃烧”这一问题,请你重新设计一个简单的实验方案,简述实验原理和主要操作。
三、(本题包括4个小题,共38分)
18.(6分)氯、溴、碘同属于周期表中的VII A族,在上个世纪,人们很早就制得高碘酸及其盐,但得不到含+7价溴的化合物,1968年,化学家用发现不久的XeF2和KBrO3首先制得纯净的KBrO4晶体。
(1)高碘酸盐(IO65-)能在酸性条件下将Mn2+氧化为MnO4-(本身被还原成I03-),其反应平稳而迅速,写出离子反应方程式: 。
(2)在25℃,已知pH=2的高碘酸溶液与pH=12的NaOH溶液等体积混合,所得混合液显酸性;0.01mol·L-1的碘酸或高锰酸溶液与pH=12的NaOH溶液等体积混合,所得混合液显中性。则高碘酸是 ;高锰酸是 (填“强酸”或“弱酸”)。
(3)写出XeF2和含KOH、KBrO3的水溶液反应得到KBrO4的离子方程式 。
19.(6分)元素周期表是20世纪科学技术发展的重要理论依据之一,是我们学习化学的重要工具。假设NH4+是“元素”NH4的阳离子,则“元素” NH4在周期表中的位置应该是第 周期第 族;“元素” NH4的单质常温常压下应为 (填“固”、“液”或“气”)体;熔点 (填“高”或“低”) ; (填“能”或“不能”)导电;NH4的碳酸盐应 (填“易”或“不易”)溶于水。
20.(12分)硫酸钡是惟一无毒的钡盐,工业上以![]() 等为原料通入下列流程反应可以制备锌钡白和过氧化氢:
等为原料通入下列流程反应可以制备锌钡白和过氧化氢:
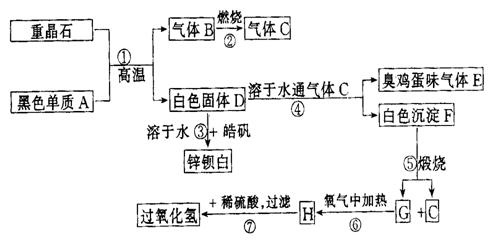
(1)上述流程中共有7个化学反应,其中_______(填编号)属于氧化还原反应.
(2)写出物质H的电子式_____________.
(3)写出下列化学反应方程式:
反应①:__________________________________________________________.
反应③:__________________________________________________________.
反应④:__________________________________________________________.
反应⑦:__________________________________________________________.
21.(14分)我国第二代身份证采用的是具有绿色环保性能的PETG新材料,PETG新材料可以回收再利用,而且对周边环境不构成任何污染。这一材料是由江苏华信塑业发展有限公司最新研发成功的新材料,并成为公安部定点产地。PETG的结构简式为:
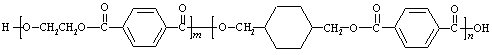
EG TPA CHDM TPA
已知:Ⅰ.![]()
![]()
![]()
![]()
Ⅱ.RCOOR1+R2OH→RCOOR2+R1OH (R、R1、R2表示烃基)
这种材料可采用下列合成路线
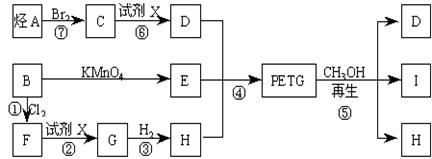 试回答下列问题:
试回答下列问题:
(1)反应②、⑥中加入的试剂X是_____________________;
(2)⑤的反应类型是________________;
(3)写出结构简式:B______________________,I________________________;
(4)合成时应控制的单体的物质的量n(D):n(E):n(H)=_____:_______:_______(用m、n表示)。
(5)写出化学方程式:
反应③:____________________________________________________;
反应⑥:_____________________________________________________。
四、(本题包括1个小题,共10分)
22.化合物A含硫(每个分子只含一个硫原子)、氧以及一种或几种卤素;少量A与水反应可完全水解而不被氧化或还原,所有反应产物均可溶于水;将A配成水溶液稀释后分成几份,分别加入一系列0.1mol/L的试剂,现象如下:
①加入硝酸和硝酸银,产生白色沉淀 ;
②加入氯化钡溶液,无沉淀生成;
③溶液经酸化后加入高锰酸钾溶液,紫色褪去,再加入硝酸钡溶液,产生白色沉淀;
(1)由此判断组成该化合物的元素中,可能存在的卤素有 ,A与水反应后生成的溶液中含有的离子可能有 。
(2)要确定该化合物的分子式,称取11.90g A溶于水稀释至250.0mL,取25.00mL溶液加入足量的高锰酸钾溶液和硝酸钡溶液,使沉淀完全,沉淀经洗涤、干燥后称重,为2.33g,试确定A的化学式,写出计算过程。
高三 百校大联考 第一次考试
化 学 参考答案及评分标准
一.选择题(每题只有一个正确选项 每题3分,共48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | C | D | A | A | A | C | D | B | B | C |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | ||||
| 答案 | A | C | A | B | B | A |
二、(本大题共14分)
17.
Ⅰ.(1)化学方程式是 (1)4HNO3(浓)
![]() 4NO2↑+O2↑+2H2O (2分)
4NO2↑+O2↑+2H2O (2分)
(2)不正确(1分),理由是带火星的木条熄灭可能是由于加热时产生大量水蒸气。 (2分)
Ⅱ.(1)该反应的化学方程式是2Cu(NO3)2 ![]() 2CuO+4NO2↑+O2↑ (2分)
2CuO+4NO2↑+O2↑ (2分)
(2)正确(1分) ,理由是硝酸铜分解产生的混合气体中氧气的体积分数与空气中氧气的体积分数基本相同,若NO2不支持燃烧,则木条不会复燃。 (2分)
III.用金属铜与浓硝酸反应制取NO2气体,并用浓硫酸或无水氯化钙进行干燥,再将带火星的木条伸入二氧化氮中观察现象。(4分)
三、(本题包括4个小题,共38分)
18.(6分)
(1)离子反应方程式:5IO65-+2Mn2++14H+=5IO3-+2MnO4-+7H2O。(2分)
(2)高碘酸是弱酸(1分);高锰酸是强酸(1分)。
(3)离子方程式: XeF2 + 2OH- + BrO3- =BrO4- + Xe + 2F- + H2O。(2分)
19.(6分,每空1分)
第三周期第IA族 ; 低 ; 固 ; 能 ; 易
20.(12分,每空2分)
(1)7个反应中有①②⑥(填编号)属于氧化还原反应.(全对才给分)
(2)写出物质H的电子式![]() .
.
(3)写出下列化学反应方程式(本题未写反应条件或未标气体符号或沉淀符号,不扣分;化学反应方程式没有配平,不计分):
反应①:BaSO4+4C=BaS+4CO↑ . 反应③:BaS+ZnSO4=ZnS↓+BaSO4↓.
反应④:BaS+H2O+CO2=BaCO3↓+H2S. 反应⑦:BaO2+H2SO4=BaSO4↓+H2O2.
21.(14分)
(1)NaOH溶液 (2分) (2)取代(或醇解)(2分)
(3)![]() (2分)
(2分) ![]() (2分)
(2分)
(4)m∶(m+n)∶n (2分)
(5) +3H2
+3H2![]()
![]()
![]() (2分,未写反应条件不计分)
(2分,未写反应条件不计分)
CH2Br-CH2Br+2H2O![]()
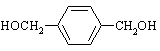
![]() HOCH2-CH 2OH+2HBr (2分,未写反应条件不计分)
HOCH2-CH 2OH+2HBr (2分,未写反应条件不计分)
四、(本题包括1个小题,共10分)
22.
(1)可能存在的卤素有F、Cl …………2分(全对才给分)
溶液中含有的离子可能有H+、SO32—、HSO3—、Cl—、F—……2分(全对才给分)
(2)在25.00 mL溶液中产生n(BaSO4)=0.01mol,
则n(SO42-)=0.01mol …… 1分
原A中n(S)=0.1mol, n (A) =n (S)=0.1mol,
M (A)=11.90g/ 0.1mol=119g/mol, …………1分
由于S元素在A中的化合价为+4价,且A中只含一个S原子,故A中只能含有一个氧原子和两个卤原子 …………1分
又A的相对分子质量为119,故两个卤原子的相对原子质量和为:119-32-16=71
所以,只能是两个氯原子 …………1分
A的化学式为SOCl2…………2分