高三年级化学上册期末考试试题
化 学 试 题
可能用到的相对原子质量:H:1、 C:12、 N:14、 O:16、Na:23、Si:28、
Cl:35.5 Cu:64、 Br:80、I:127
一、选择题(每小题只有一个正确选项符合题意。每题1分,共10分)
1.我国科学家成功地合成了3mm长的管状碳纳米管,长度居世界之首。这种碳纤维具
有强度高、刚度(抵抗变形的能力)高、密度小(只有钢的1/4)、熔点高,化学稳定性
好的特点,因此被称为“超级纤维”。下列对碳纤维的说法中不正确的是 ( )
A.它是制造飞机的理想材料 B.它的主要组成是碳元素
C.它的结构与石墨相似 D.碳纤维复合材料不易导电
2.2006年12月1日为世界第19个艾滋病日,调查结果显示全国艾滋病病毒感染者人数在
不断地上升。医学界通过放射性14C标记的C60,发现C60的羧酸衍生物在特定条件下可
断裂DNA杀死细胞,抑制艾滋病。关于14C的下列说法中正确的是 ( )
A.14C原子与C60中普通碳原子的化学性质不同
B.是C60的同素异形体
C.14C原子与14N原子所含中子数相同
D.与12C、13C是碳元素的三种同位素
3.下列说法中正确的是 ( )
A.酸性氧化物都是非金属氧化物
B.含有极性键的分子一定是极性分子
C.含有离子键的化合物一定是离子化合物
D.所有物质中都存在化学键
4.将相同质量的铜分别和过量浓硝酸、稀硝酸反应,下列叙述正确的是 ( )
A.反应速率:两者相同
B.消耗硝酸的物质的量:前者多,后者少
C.反应生成气体的颜色:前者浅,后者深
D.反应中转移的电子总数:前者多,后者少
5.下列单质中,最容易跟氢气发生反应的是 ( )
A.F2 B.O2 C.Cl2 D.N2
| |
①白磷保存在冷水中,②Na保存在CCl4中 ③HF溶液保存在塑料瓶中,④AgNO3固体
保存在棕色试剂瓶内,⑤浓硝酸保存在溶液棕色广口瓶内
A.①③④ B.③④ C.①②③④ D.①②③④⑤
7.高压电机、复印机工作时会产生臭氧,该气体有强氧化性。下列叙述中不正确的是( )
A.臭氧和氧气是氧的同素异形体 B.臭氧的存在对人体有害无益
C.臭氧可使湿润的淀粉KI试纸变蓝 D.臭氧是很好的消毒剂和脱色剂
8.下列反应中,氧化剂与还原剂物质的量的关系为2:1的是 ( )
A.O3+2KI+H2O===2KOH+O2+I2
B.2CH3COOH+Ca(ClO)2====2HClO+Ca(CH3COO)2
C.I2+2NaClO3====2NaIO3+Cl2
D.4HCl+MnO2===MnCl2+Cl2↑+2H2O
9.下列分子的结构中,各原子的最外层不能满足8电子稳定结构的是 ( )
A.CO2 B.NCl3 C.BF3 D.SiCl4
10.将CO2通入下列物质的溶液中不与其反应的是:①Na2CO3 ②Na2SiO3 ③NaAlO2
④C6H5ONa ⑤Ca(ClO)2 ⑥CaCl2 ⑦CaCO3
A.①④ B.①⑦ C.① D.⑥
二、选择题(每小题只有一个正确选项符合题意。每题3分,共36分)
11.下列离子方程式书写正确的是 ( )
A.氢氟酸与石灰水反应:![]()
B.硫酸与氢氧化钡反应:![]()
C.相同物质的量浓度相同体积的FeBr2溶液和氯水混合:
![]()
D.少量NaHCO3溶液和足量Ba(OH)2溶液混合:
![]()
12.阿伏加德罗常数约为6.02×1023mol-1,下列说法正确的是 ( )
A.22.4LN2中所含的分子数为6.02×1023
B.1L 1mol/LCH3COOH溶液中,CH3COOH的分子数为6.02×1023
C.Na2O2与水反应生成11.2L O2(标准状况)转移的电子数为2×6.02×1023
D.60g SiO2固体中含有的Si—O键个数为4×6.02×1023
13.从下列事实所列出的相应结论正确的是 ( )
| 实验事实 | 结论 | |
| A | NH3的水溶液可以导电 | NH3是电解质 |
| B | SO2通入硝酸钡溶液出现白色沉淀 | 产生BaSO3沉淀 |
| C | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 酸性:HCO3->Al(OH)3 |
| D | 常温下白磷可自燃而氮气须在放电时才与氧气反应 | 非金属性:P>N |
14.已知Br2和NaOH溶液的反应类似Cl2和NaOH溶液的反应,用溴水做试剂可以将下列
各组中的溶液鉴别出来的是 ( )
A.AgNO3、NaOH、KI B.NaCl、NaBr、NaI
C.水、汽油、酒精 D.乙酸、酒精、NaOH
15.下列实验一定能证明有SO2存在的是:①能使澄清石灰水变混浊②能使蓝色石蕊试纸变
色③能使品红溶液褪色④通入溴水能使溴水褪色,再滴加氯化钡溶液有白色沉淀生成⑤
先通入足量的NaOH溶液,再滴加氯化钡溶液有白色沉淀生成 ( )
A.都能证明 B.只有④能证明 C.③④⑤能证明 D.都不能证明
|
半径及主要化合价见右
表,下列叙述不正确的
是 ( )
A.L、Q形成的简单离子核外电子数相等 B.M与T形成的化合物有两性
C.T、L能形成两种离子化合物 D.L、M的单质与稀盐酸反应速率L>M
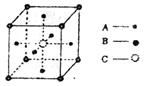
17.右图为CaTiO3的晶体结构模型,A、B、C分别表示O2-、Ti4+、Ca2+位于立方体的面心、
|
A.分子晶体中都存在共价键
B.CaTiO3晶体中每个Ti4+和12个O2-相紧邻
C.SiO2晶体中每个硅原子与两个氧原子以共价键相结合
D.金属晶体的熔点都比分子晶体的熔点高
18.向50mL18mol/LH2SO4中加入足量的Cu并加热,将加热后所得的混合物溶于水,过滤,
| |
A.0.9mol B.0.45mol
C.0.45mol<n<0.9mol D.<0.45mol
19.已知某溶液中存在较多的H+、SO42-、NO3-,则溶液中还可能大量存在的离子组是( )
A.Al3+、CH3COO-、Cl- B.Na+、NH4+、Cl-
C.Mg2+、Cl-、Fe2+ D.Mg2+、Ba2+、Br-
20.要求设计实验,证明某种盐的水解是吸热的,有四位学生分别作出如下回答,其中正确
的是 ( )
A.甲学生:将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的
B.乙学生:在盐酸中加入相同温度的氨水,若实验过程中混合液温度下降,说明盐类
水解是吸热的
C.丙学生:在醋酸钠溶液中加入醋酸钠晶体,若溶液温度下降,说明盐水类水解是吸
热的
D.丁学生:在醋酸钠溶液中滴入酚酞试液,加热后若红色加深,说明盐类水解是吸热的
21.过氧化氢(H2O2)是一种黏稠液体,易分解为水和氧气,常用作氧化剂、漂白剂和消毒
剂。为了储存、运输使用方便,工业上采用“醇析法”将H2O2转化为固体的过碳酸钠
晶体(其化学式为2Na2CO3·3H2O2),该晶体具有Na2CO3和H2O的双重性质。接触下
列物质不会使过碳酸钠失效的是 ( )
A.MnO2 B.FeCl2 C.CH3COOH D.NaHCO3
22.将一定量的Cu和Fe2O3的混合物放入25mL2mol/LHNO3中,反应完成后,无固体剩余,
生成224mLNO气体(标准状况),再向反应后的溶液中加入1mol/L NaOH溶液,要使
金属元素全部沉淀下来,所加NaOH溶液体积最少是 ( )
A.40mL B.45mL C.50mL D.无法判断
三、填空题(28分)
23.(6分)配平化学方程式:
___HNO3+___FeSO4====___Fe(NO3)3+___Fe(SO4)3+ N2O↑+___H2O
反应物中发生氧化反应的物质是______,被还原的元素是______,反应中1mol氧化剂
______(填“得到”或“失去”)______mol电子。
24.(8分)物质间的转化关系如下图所示:
(1)固体A是一种重要的工业原料。1mol气体乙完全燃烧时生成1molE和2mol丙。则丙
的电子式为:_____,写出反应①化学方程式:
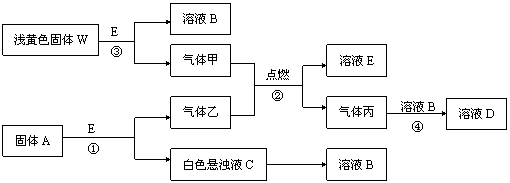 |
(2)C溶液中的溶质和丙以物质的量之比1∶2反应时,该反应的离子方程式为:
_____________________。实验C→B的转变,加入的物质为______(填写化学式)。
25.(8分)某待测溶液(阳离子为Na+)中可能会有SO42-、SO32-、NO3-、Cl-、Br-、CO32-、
HCO3-中的一种或多种,进行如图所示实验,每次实验所加试剂均过量,回答以下问题:
(1)沉淀B的化学式为____________。
(2)根据以上实验,待测液中肯定没有的离子是______,肯定存在的离子是___________。
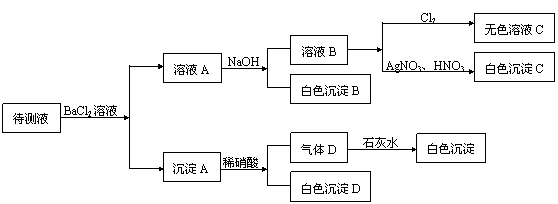 |
26.(6分)有A、B、C、D四种原子序数依次增大的短周期非金属元素(其单质也可分别
用A、B、C、D表示)。在一定条件下,A可以分别和B、C、D化合生成甲、乙、丙化
合物,且甲、乙两分子中各含有10个电子。B、C元素在周期表中位置相邻,B、C化
和可得丁。已知一定条件下有如下变化关系:
①D+乙→丙+戊 ②戊→丙+C ③C+甲→丁+乙
请填空:(1)丙的浓溶液与一种黑色粉末共热可得D,则丙为______,乙为______。
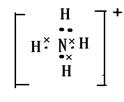
(2)戊的结构式是______,DB4+的电子式是______。(3)写出反应③化学方程式。
|
四、实验题(14分)
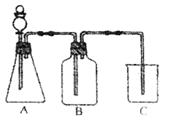
27.(5分)为确认HCl、H2CO3、H2SiO3的酸性强弱,
有人设计用如右图装置,一次实验即可达到目的
(不必再选用其它酸性溶液)。请依据此实验填空:
(1)锥形瓶内装某可溶性正盐固体,分液漏斗中所盛试剂是______。
(2)装置B所盛试剂是____________,装置B所盛试剂的作用是__________________。
(3)装置C所盛试剂是____________,出现的现象是____________________________。
|
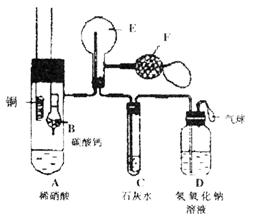
一氧化氮,某同学设计了一个实验,其
装置如图所示(加热装置和固定装置均
已略去),B为一个用金属丝固定的干燥
管,内装块状碳酸钙固体;E为一个空
的蒸馏烧瓶;F是用于鼓动入空气的双
连打气球。(1)实验时,先将B装置下
移,使碳酸钙与稀硝酸接触产生气体,
当C产生白色沉淀时,立刻将B装置上
提,使之与稀硝酸分离。该组学生设计此步操作的目的为_________________________。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反
应的化学方程式为________________________________________________,装置D
中开始时出现气泡时,用F向E中鼓入空气后,可观察到烧瓶E中的现象是_______
_____________,产生上述现象的原因是______________________________。
(3)一段时间后,C中可观察到白色沉淀溶解,发生的化学反应是__________________
__________________________________________________________________。
(4)装置D的作用是______________________________________________________。
五、计算题(12分)
29.(4分)以NH3为原料生产NH4NO3,若硝酸车间的原料转化率为90%,NH3被硝酸吸收
生产NH4NO3的吸收率为98%,则生产80吨NH4NO3需NH3多少吨?
30.(8分)向的混合溶液中通入适量Cl2,反应完全后将溶液蒸干并小心灼烧至恒重,得固
体W。(1)W的可能组成为①____________,②____________,③____________,
④____________。(填化学式,可以多填或少填)
(2)现将NaBr、NaI的混合固体10.0g溶于适量水中,通入448mL Cl2(标准状况)充
分反应后,按上述操作得到W的质量为7.28g。则原混合物中NaI的质量分数为_____
____________。
参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | ||
| 答案 | C | D | C | B | A | A | B | C | C | D | ||
| 题号 | 11 | 12 | 13 | 14 | 15 | 6 | 17 | 18 | 19 | 20 | 21 | 22 |
| 答案 | C | D | C | A | B | A | B | C | B | D | D | A |
23.30HNO3+24FeSO4====8Fe8Fe2(SO4)3+3N2O↑+15H2O(2分)
FeSO4;氮(或N);得到;4(每空1分)
|
24.(1)_____________, CaC2+2H2O====Ca(OH)2+C2H2↑。
(2)OH-+CO2====HCO3-,NaCO3或NaHCO3。(每空2分)
25.(1)BaCO3(2分)
|
有(4分)。
26.(1)HCl,H2O。(2)H -O-Cl,
催化剂加热
(3)4NH3+5O2 ==== 4NO+6H2O
(化学方程式2分其余每空1分)
27.(每空1分)(1)盐酸;(2)饱和NaHCO3溶液;除CO2中含有的HCl
(3)Na2SiO3溶液;产生白色沉淀。
28.(1)(2分)利用反应产生的CO2将装置中空气排尽。
(2)3Cu+8HNO3====3Cu(NO3)2+2NO↑+4H2O(2分);
无色气体变红棕色(1分);2NO+O2====2NO2(1分)
(3)(每空1分)3NO2+H2O====NO+2HNO3
2HNO3+CaCO3====Ca(NO3)2+H2O+CO2↑
(4)(1分)吸收有毒气体
29.(4分)17/90%+17/98%=36.2
30.(每空2分)(1)①NaCl、NaBr、NaI ②NaCl、NaBr ③NaCl
(2)原混合物中NaI质量分数为30.0%