高三年级化学上册调研测试(一)
化 学 试 题
本试卷分选择题和非选择题两部分,共10页,满分为150分。考试用时120分钟。
可能用到的原子量:
H 1 C 12 O 16 Cl 35.5 Fe 56 Cu 64
第一部分选择题(共70分)
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意。)
1.下列叙述不正确的是 ( )
A.金刚砂的成分是Al2O3,可用作砂纸、砂轮的磨料
B.水晶和玛瑙的主要成分都是SiO2
C.含硅的钢具有良好的导磁性
D.太阳能电池可用硅材料制作,其应用有利于环保、节能
2.NA为阿伏加德罗常数,下列说法中正确的是 ( )
A.用稀氢氧化钠溶液吸收氯气22.4L,反应中转移的电子数目为NA
B.1mol/L Mg(NO3)2溶液中含有![]() 的数目为2NA
的数目为2NA
C.室温下,28.0g乙烯和丙烯混合气体中含有的碳原子数为2NA
D.标准状况下,11.2L臭氧中含有的氧原子数目为3NA
3.巴豆酸的结构简式为CH3CH=CHCOOH,现有
①水 ②溴的四氯化碳溶液 ③丁醇
④纯碱溶液 ⑤酸性KMnO4溶液
在一定条件下,能与巴豆酸反应的物质组合是 ( )
A.只有②④⑤ B.只有②③⑤
C.只有②③④⑤ D.①②③④⑤
4.金属钛对体液无毒且惰性,能与肌肉和骨骼生长在一起,有“生物金属”之称。下列有关![]() 的说法中正确的是 ( )
的说法中正确的是 ( )
A.![]() 原子中均含有22个中子
原子中均含有22个中子
B.![]() 在周期表中位置相同,都在第4纵行
在周期表中位置相同,都在第4纵行
C.分别由![]() 组成的金属钛单质互称为同分异构体
组成的金属钛单质互称为同分异构体
|
5.食品中含有过量的CH2=CH—C—NH2(丙烯酰胺)可能引起令人不安的食品安全问题。关于丙烯酰胺有下列叙述:①能使酸性高锰酸钾溶液褪色,②能发生加聚反应,③能与氢气发生加成反应,④是高分子化合物。其中正确的是 ( )
A.①②④ B.②③④ C.①②③ D.①③④
|
![]() A.
A.![]()
![]()
![]() B.
B.![]()
![]()
![]() C.
C.![]() 2HI(g);△H>0
2HI(g);△H>0
![]() D.
D.![]() CO(g)+H2(g);△H>0
CO(g)+H2(g);△H>0
7.肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,反应生成N2和水蒸气。已知:N2(g)+2O2(g)===N2O4(g);△H=+8.7kJ/mol
N2H4(g)+2O2(g)==N2(g)+2H2O(g);△H=-534kJ/mol
下列表示肼和N2O4反应的热化学方程式,正确的是 ( )
A.![]()
B.![]()
C.![]()
D.![]()
8.下列说法中正确的是 ( )
A.ⅠA、ⅡA族元素的原子,其半径越大,越难失去电子
B.元素 周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
C.原子及其离子的核外电子层等于该元素所在的周期数
D.所有主族元素的原子,形成单原子离子时的化合价和它的族序数相等
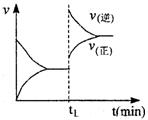
![]() 9.某温度下,在密闭容器中发生如下反应:2A(g)+B(g) 2C(g),若开始时只
9.某温度下,在密闭容器中发生如下反应:2A(g)+B(g) 2C(g),若开始时只
充入2mol C气体,达到平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2molA和1mol B 的混合气体,达到平衡时A的转化率为 ( )
A.20% B.40% C.60% D.80%
10.化学实验设计和操作中必须十分重视安全问题和环境保护问题。下列实验问题处理方法不正确的是 ( )
①在制氧气时排水法收集氧气后出现倒吸现象,立即松开试管上的橡皮塞
②在气体发生装置上直接点燃一氧化碳气体时,必需要先检验一氧化碳气体的浓度。最简单的方法是用排空气的方法先收集一试管气体,点燃气体,听爆鸣声。
③实验结束后将所有的废液倒入下水道排出实验室, 以免污染实验室
④给试管中的液体加热时不时移动试管或加入碎瓷片,以免暴沸伤人
⑤不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛
⑥配制浓硫酸时,可先在烧杯中加一定体积的水,再边搅拌边加入浓硫酸
A.①② B.②③ C.③⑤ D.②⑥
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案只包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
11.下列有关溶液性质的叙述,正确的是 ( )
A.室温时饱和的二氧化碳水溶液,冷却到0℃时会放出一些二氧化碳气体
B.强电解质在水中溶解度一定大于弱电解质
C.相同温度下,把水面上的空气换成相同压力的纯氧,100g水中溶入氧气的质量增加
D.将40℃的饱和硫酸铜溶液升温至50℃,或者温度仍保持在40℃并加入少量无水硫酸铜,在这两种情况下溶液中溶质的质量分数均保持不变。
12.X、Y是元素周期表ⅦA族中的两种元素。下列叙述能说明X的非金属性比Y强的是( )
A.X原子的电子层数比Y原子的电子层数多
B.Y的单质能将X从NaX的溶液中置换出来
C. X的单质比Y的单质更容易与氢气反应
D.同浓度下X的氢化物水溶液比Y的氢化物水溶液的酸性强
13.下列溶液中,有关离子一定能大量共存的是 ( )
A.能使石蕊呈蓝色的溶液中:Na+、I-、Cl-、NO![]()
B.能使甲基橙呈黄色的溶液中:![]()
C.能使pH试纸变红色的溶液中:![]()
D.能跟金属铝反应生成氢气的溶液中:![]()
14.相等物质的量的KClO3分别发生下述反应:①有MnO2催化剂存在时,受热分解得到氧气;②若不使用催化剂,加热至470℃左右,得到KClO4和KCl。下列关于①和②的说法正确的是 ( )
A.都属于氧化还原反应 B.发生还原反应的元素不同
C.发生氧化反应的元素相同 D.生成KCl的物质的量不同
15.下列反应离子方程式正确的是 ( )
A.Fe2(SO4)3的酸性溶液中通入足量硫化氢 ![]()
B.碳酸氢钙溶液中加入过量氢氧化钠溶液
![]()
C.氯化铝溶液中加入过量氨水 ![]()
| |
16.几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | L | M | X | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
A.离子半径大小:r(M+3)>r(T2-)
B.R的氧化物对应的水化物可能具有两性
C.X单质可在氧气燃烧生成XO3
D.L、X形成的简单离子核外电子数相等
17.常温下将NaOH稀溶液与CH3COOH稀溶液混合,不可能出现的结果是( )
A.pH>7,且![]()
B.pH>7,且![]()
C.pH=7,且![]()
D.pH<7,且![]()
18.元素A和B的原子序数都小于18。已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M电子层数为(a-b),L层电子数为(a+b),则A、B两元素所形成的化合价的性质可能有 ( )
A.能与水反应 B.能与氢氧化钠反应
C.能与硫酸反应 D.能与碳酸钠反应
19.室温下,pH相同体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是 ( )
A.加水稀释2倍后,两溶液的pH均减小
B.使温度都升高20℃后,两溶液的pH均不变
C.加适量的醋酸钠晶体后,两溶液的pH均增大
D.加足量的锌充分反应后,醋酸产生的氢气比盐酸多
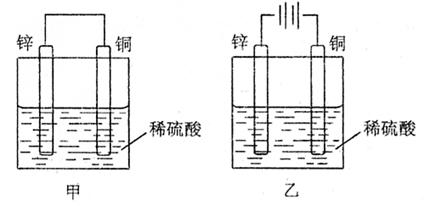
20.关于如图所示装置的叙述,正确的是 ( )
|
A.甲乙装置中锌片都作负极
B.甲乙装置中,溶液内的氢离子在铜片表面被还原
C.甲乙装置中,锌片上发生的反应都是还原反应
D.甲装置中,铜上面有气泡生成,乙装置中铜片质量减少
第二部分非选择题(共80分)
三、(本题包括2小题,共30分)
|
| |
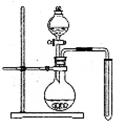
(1)实验室常用浓硝酸与铜反应制备二氧化氮,
化学方程式是 。
(2)可用右图装置制备并收集一试管二氧化氮,
①在加入药品前,必须进行的操作是
。
②该装置的缺点是(只填一个缺点既可)
|
实验二:尽可能多地使试管中的二氧化氮被水吸收
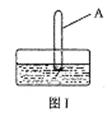
(3)将装有二氧化氮的试管A倒插入水中(图1),
并轻轻晃动试管,观察到的现象是:
反应的化学方程式是
(4)从下图中挑选所需的仪器,完成制取O2,并将O2通入到上述实验后的试管A中。
①画出制取O2装置简图(添加必要的塞子、玻璃导管、胶皮管。固定装置不用画),并表明所用试剂。
|
②某同学在图Ⅱ的试管A内通入O2的过程中没有观察到液面上升,而是试管内充满了无色气体,主要原因是 。
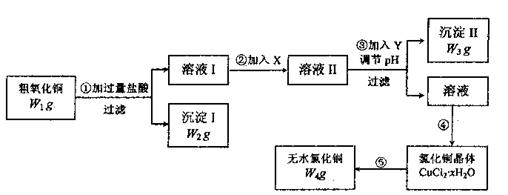
22.(15分)某化学研究性学习小组拟用粗氧化铜(含少量氧化亚铁及不溶于酸的杂质)制取无水氧化铜并测定样品中氧化铜的质量分数,其实验流程图如下:
|
实验过程中的pH调节可参考下表:
| 物质 | 开始沉淀是的pH | 完全沉淀时的pH |
| 氢氧化铁 | 2.7 | 3.7 |
| 氢氧化亚铁 | 7.6 | 9.6 |
| 氢氧化铜 | 5.2 | 6.4 |
回答以下问题:
(1)步骤①过滤操作中所用仪器有铁架台(带铁圈)、漏斗、烧杯等,还需要使用的仪器用品有 。
(2)步骤①中发生的离子反应方程式 。
(3)步骤②溶液I中加入X的目的是 。
(4)试剂Y可选用(填字母) ,选择的原因是
。
a.氢氧化钠 b.氨水 c.碱式碳酸铜 d.氧化铜
(5)步骤⑤要得到无水氯化铜,需要在干燥的HCl气流中加热CuCl2·xH2O中其原因是
。
(6)经检测,CuCl2·xH2O中含水28.6%,则CuCl2·xH2O中x的值为 。
(7)看步骤④中有80%的氯化铜转入晶体,其余各步转化都是完全的,请根据流程图中表示的质量数据,写出样品中氧化铜的质量分数计算式 。
四、(本题包括3小题,共30分)
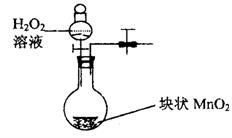
23.(10分)(1)向H2O2溶液中滴加FeCl3溶液,可发生下列反应:
![]() 在以上反应中Fe3+实际上起着
作用,总反应式为
在以上反应中Fe3+实际上起着
作用,总反应式为
。
(2)I2与Fe3+一样也可以发生上述类似反应,类比(1)在下面填入合适的化学反应方程式:
H2O2+I2=2HIO, 。
总反应式为 。
(3)在硫酸和KI的混合溶液中加入足量的H2O2,放出大量的无色气体,溶液呈棕色,并可使淀粉变蓝色。该反应的离子方程式为: 。
(4)铁酸钠(Na2FeO4)可作为一种新型净水剂,在反应中Na2FeO4被还原为Fe3+离子,请简述铁酸钠之所以能净水,除了具有强氧化性,能消毒杀菌外,另一原因是
。
(5)铁酸钠的制备常用氧化铁在碱性溶液中与硝酸钠反应制得:
Fe2O3 + NaNO3+ NaOH → Na2FeO4+ NaNO2+ H2O
配平化学方程式,并标出电子转移的方向和数目。
Fe2O3 + NaNO3+ NaOH → Na2FeO4+ NaNO2+ H2O
24.(10分)二氧化钛最重要的用途是用于制造钛的其他化合物。由二氧化钛直接制取金属钛是比较困难的,原因是二氧化钛的热稳定性很强。例如:用碳还原二氧化钛,即使在高温1800℃也难反应。现用钛铁矿石为原料,经过一系列的反应制得颜料钛白粉(TiO2),其工业流程图大致如下:
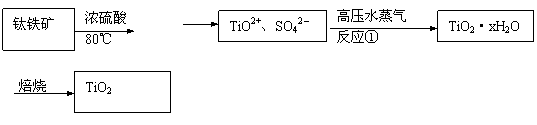 |
……
(1)反应①的离子方程式为 ,高压水蒸气的作用是
。
(2)用金红石主要成分(TiO2)制取颜料钛白粉(TiO2),涉及的工业流程大致如下:
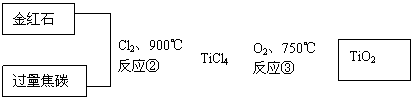
![]()
![]()
反应②的化学方程式 。
反应③的化学方程式 。
![]() 25.(10分)工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g) 2NH3(g),
25.(10分)工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g) 2NH3(g),
△H=-92.44kJ/mol;其部分工艺流程如下:
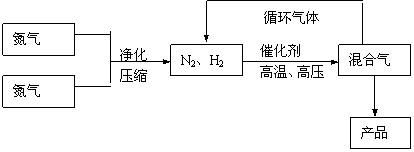 |
反应体系中各组分的部分性质见下表:
| 气体 | 氮气 | 氢气 | 氨 |
| 熔点(℃) | -210.01 | -252.77 | -77.74 |
| 沸点(℃) | -195.79 | -259.23 | -33.42 |
回答下列问题:
(1)写出该反应的化学平衡常数表达式:K= 。随着温度升高,K值 (填增大、减小、不变)。
(2)平衡常数K值越大,表明 (填序号)。
A.N2的转化率越高 B.NH3的产率越大
C.原料中N2的含量越高 D.化学反映速率越快
(3)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过把混合气体的温度降低到 使 分离出来;继续循环的气体是 。
五、(本题包括2小题,共20分)
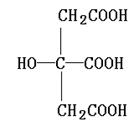
26.(10分)有机化合物A广泛存在于水果肉中,尤以苹果、葡萄、西瓜、山楂内为多。已知:
①A中碳和氢的质量分数之和为40.3%,其余为氧;其相对分子质量大于110,小于150。
②A与乙酸或丙醇在浓硫酸、加热的条件下生成有香味的产物;
③1molA与足量的钠最多能产生1.5mol气体;
④A在一定温度下脱水得到产物B(不是环状化合物),B可以和溴水发生加成反应。
试回答:
(1)A的分子式为 。
(2)对A的结构可作出的判断是 (多选扣分)。
(a)肯定有碳碳双键 (b)有两个羧基
(c)肯定有羟基 (d)有—COOR官能团
(3)有机物A的结构简式(不含—CH3)为 。
(4)A在一定温度下脱水产物B具有反异构现象,B和溴水反应的化学方程式:
。
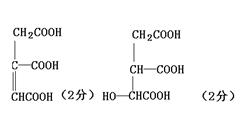
|
若将柠檬酸加热到150℃,则分子内失去一分子水而形成不饱和酸——顺乌头酸,后者在一定条件下和水反应又生成柠檬酸和异柠檬酸两种异构体。
(1)写出顺乌头酸和异柠檬酸的结构简式:
顺乌头酸: ,异柠檬酸:
(2)由柠檬酸转化为顺乌头酸的反应过程,属于 反应(填反应类型),
顺乌头酸转化为柠檬酸和异柠檬酸的反应过程,属于 反应(填反应类型)。
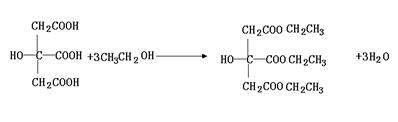
(3)传统塑料增塑剂为邻苯二甲酸双酯(DEHP)。因其结构中含苯环,可能致癌。柠檬酸酯无毒无味,可替代传统增塑剂。请写出用柠檬酸合成柠檬酸三乙酯(TEC)的化学式:
。
参考答案
第一部分选择题(共30分)
一、(本题包括10小题,每小题3分,共30分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | A | C | D | B | C | B | A | B | C | B |
二、(本题包括10小题,每小题4分,共40分)
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | CD | C | A | AD | D | B | AC | BD | CD | D |
第二部分非选择题(共80分)
四、(本题包括2小题,共30分)
21.(15分)
(1)Cu+4HNO3(浓) == Cu(NO3)2+2NO2↑+2H2O (2分)
(2)①检查装置的气密性 (1分)
②没有尾气处理装置,过量的NO2逸出后将导致空气污染。(2分)
(或:不能随时控制反应的开始和停止,浪费药品,且过量的NO2逸出后将导致空气污染)
(3)试管内液面上升到约为试管体积的2/3,气体由棕红色变为无色。(2分)
|
(4)
①
(4分)
[4分,其中药品选择合理1分,仪器绘制正确1分,仪器连接正确2分(胶塞、活塞各1分)]
②O2通入的速度过快,导致试管内迅速充满了O2。 (2分)
22.(15分)
(1)玻璃棒、滤纸(1分)
(2)CuO+2H+ == Cu2++H2O FeO+2H+ == Fe2++H2O (2分)
(3)Fe2+全部氧化为Fe3+ (2分)
(4)c、d,(2分)
写对1个给1分,写对2个给2分,写错1个扣1分,但不出现负分,
加入碱式碳酸铜或氧化铜后,不引入新的杂质,并可降低溶液中H+浓度,控制溶液的pH在3.7~5.2之间,使Fe3+水解转化为Fe(OH)3,而Cu2+不水解。(2分)
(5)在干燥的HCl气流中抑制Cu2+的水解,且带走CuCl2·xH2O受热产生的水气,故能得到无水氯化铜。 (2分)
(6)3 (2分)
(7)![]() (2分)
(2分)
四、(本题包括3小题,共30分)
|
|
|
(3)H2O2+2H++2I-= I2+2H2O (1分) 2H2O2 ===== O2↑+2H2O (1分)
![]() (4)生成的Fe3+离子水解可产生Fe(OH)3胶体,吸附水中悬浮的杂质。
(1分)
(4)生成的Fe3+离子水解可产生Fe(OH)3胶体,吸附水中悬浮的杂质。
(1分)
(5)
Fe2O3 + 3NaNO3 + 4NaOH ==== 2Na2FeO4 + 3NaNO2 +2H2O (3分)
(配平2分,转移方向和数目1分,共3分。用双线桥也可以)
24.(10分)
![]() (1)TiO2+ +(x+1)H2O TiO2·xH2O+2H+
(3分)
(1)TiO2+ +(x+1)H2O TiO2·xH2O+2H+
(3分)
|
|
TiCl4+O2 ===== TiO2+2Cl2 (2分)
25.(10分)
(1)![]() (2分),减小(2分)
(2分),减小(2分)
(2)AB(2分)
写对1个给1分,写对2个给2分,写错1个扣1分,但不出现负分,
(3)-33.42℃(1分),氨(1分),N2,H2(2分)
五、(本题包括2小题,共20分)
26.(10分)
(1)C4H6O5(2分)
(2)b、c(2分)
写对1个给1分,写对2个给2分,写错1个扣1分,但不出现负分,
|
|
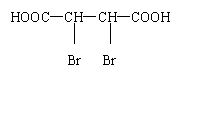 (各2分共4分)
(各2分共4分)
![]() (4)HOOC—CH=CH—COOH+Br
(4)HOOC—CH=CH—COOH+Br
|
27.(10分)
(1)
(2)消去,加成(各2分,共4分)
|