高三年级化学上学期期中试题
本卷可能用到的相对原子质量:
H 1 He 4 N 14 Na 23 Mg 24 Al 27 Cl 35.5 O 16
一.选择题(单选,每题2分,14题共28分)
1.下列家庭小实验最合理的是 ( )
A.将适量的发酵粉放在容器中加热,观察气体的产生
B.在洁净的水杯中先加入小苏打粉,再加入食醋,观察气体的产生
C.往稀白粥中加入少量加碘食盐,检验加碘食盐中含有I2
D.在一瓣橘子上插入两根铜线并与小灯泡连接,验证电流的产生
 2.从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平。下图表示了三种金属被人类开发利用的大致年限,之所以有先后,主要取决于 (
)
2.从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平。下图表示了三种金属被人类开发利用的大致年限,之所以有先后,主要取决于 (
)
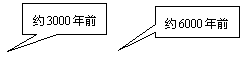
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
A.金属的导电性强弱 B.金属在地壳中的含量多少
 C.金属的化合价高低 D.金属的活动性大小
C.金属的化合价高低 D.金属的活动性大小
3.为测定气球内的气体成分,有学生用超薄材料的气球按图
装置进行实验。开始时气球沉于烧杯底部,打开开关后,过
一会儿气球从烧杯底部慢慢浮起,最后悬于烧杯口。气球内
可能的气体是 ( )
A.氧气 B.氢气 C.甲烷 D.氯气
4.如今,宁波市有很多家庭已用上比液化气便宜得多的东海天然气。已知,天然气的主要成分是甲烷,在101kPa时,一定质量的甲烷完全燃烧生成CO2和液态H2O,放出的热量为Q kJ,若完全吸收生成的CO2,需消耗掉8.0mol/L的NaOH溶液50mL,则下列热化学方程式肯定错误的是 ( )
A.CH4(g) + 2O2(g) = CO2(g) + 2H2O(g);ΔH=-5.0 Q kJ/mol
B.CH4(g) + 2O2(g) = CO2(g) + 2H2O(l);ΔH=-5.0 Q kJ/mol
C.CH4(g) + 2O2(g) = CO2(g) + 2H2O(l);ΔH=-3.0 Q kJ/mol
D.CH4(g) + 2O2(g) = CO2(g) + 2H2O(g);ΔH=-2.4 Q kJ/mol
5.据报道,碳纳米管是碳原子形成的大分子,其导电性是铜的1万倍;N5可用作烈性炸药。下列说法正确的是 ( )
A. 金刚石与碳纳米管互为同分异构体 B. N5与N2互为同素异形体
C. 14C的质子数为14 D. C原子半径比N原子半径小
6.钛(Ti)被称为继铁、铝之后的第三金属,以TiO2制取Ti的主要反应有:
① TiO2+2C+2Cl2![]() TiCl4+2CO ② TiCl4+2Mg
TiCl4+2CO ② TiCl4+2Mg![]() 2MgCl2+Ti
2MgCl2+Ti
下列叙述正确的是 ( )
A.反应①是置换反应 B.反应②是复分解反应
C.反应①中TiO2是氧化剂 D.反应②中金属镁是还原剂
7.下列各组离子一定能大量共存的是 ( )
A 在含大量Fe3+的溶液中:NH4+、Na+、Cl—、SCN—
B 在强碱溶液中:Na+、K+、AlO2—、CO32—
C 在c(H+)=10—13mol/L 的溶液中:NH4+、Al3+、SO42—、NO3—
D 在pH=1的溶液中:K+、Fe2+、Cl—、NO3—
8.下列各指定微粒的数目之比不是1:1的是 ( )
A.食盐晶体中的Na+和Cl- B.NaHCO3晶体中的Na+和HCO3-
C.![]() Mg2+离子中的质子和中子 D.NH4Cl溶液中的NH4+和Cl-
Mg2+离子中的质子和中子 D.NH4Cl溶液中的NH4+和Cl-
9.硝酸生产工艺中,在吸收塔里发生如下反应:3NO2+H2O![]() 2HNO3+NO;△H<0,为提高NO2的转化率,理论上应该采取的措施是 ( )
2HNO3+NO;△H<0,为提高NO2的转化率,理论上应该采取的措施是 ( )
A.减压 B.增压 C.升温 D.加催化剂
10.下列离子方程式正确的是 ( )
A 碳酸氢钠溶液与少量石灰水反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
B 氯化铵与氢氧化钠两种浓溶液混合加热:NH4++OH-![]() H2O+NH3↑
H2O+NH3↑
C 氢氧化镁与稀硫酸反应:H++OH-=H2O
D 单质铜与稀硝酸反应:Cu+2H++2NO3-=Cu2++2NO↑+H2O
11.将100mL0.1 mol·L-1的BaCl2溶液加入到100mL0.2 mol·L-1的H2SO4溶液中,则溶液中存在的离子浓度关系是 ( )
A c(H+)> c(Cl-)> c(Ba2+)> c(SO42-) B c(Cl-)>c(H+)> c(SO42-) > c(Ba2+)
C c(H+)>c(Cl-) >c(SO42-)>c(Ba2+) D c(Cl-)>c(H+)> c(Ba2+)>c(SO42-)
12.下列说法错误的是 ( )
A 原子晶体中只存在非极性共价键
B 分子晶体的状态变化,一般只需克服分子间作用力
C 金属晶体通常具有导电、导热和良好的延展性
D 离子晶体在熔化状态下能导电
13.电动车中使用的蓄电池是一种高能电池——钠硫电池。钠硫电池无污染,无废液,是一种可反复使用的绿色能源。它以熔融的钠、硫为两极,以含Na+并具有层状结构的β-Al2O3陶瓷作固体电解质。该电池的反应如下:2Na+xS![]() Na2Sx,以下说法正确的是( )
Na2Sx,以下说法正确的是( )
A 放电时,钠作正极,硫作负极
B 放电时,钠极发生还原反应:2Na+ +2e-→2Na
C 充电时,钠极与外电源正极相连,硫极与外电源的负极相连
D 充电时,阳极发生的反应是:Sx2--2e-=xS,阴极发生的反应是:2Na+ +2e-→2Na
14.在一定温度不同压强(p1<p2),可逆反应2X(g)![]() 2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(
2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(![]() )与反应时间(t)的关系有以下图示,正确的是 ( )
)与反应时间(t)的关系有以下图示,正确的是 ( )
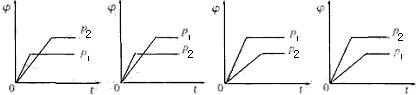
A B C D
二.选择题(单选,每题3分,6题共18分)
15.相等物质的量的KClO3分别发生下述反应:
①有MnO2催化剂存在时,受热分解得到氧气;
②若不使用催化剂,加热至470℃左右,得到KClO4(高氯酸钾)和KCl。
下列关于①和②的说法不正确的是 ( )
A 都属于氧化还原反应 B 发生还原反应的元素相同
C 发生氧化反应的元素不同 D 生成KCl的物质的量相同
16.某温度下,体积一定的密闭容器中进行如下可逆反应:
X(g)+Y(g) ![]() Z(g)+W(s);△H>0 下列叙述正确的是( )
Z(g)+W(s);△H>0 下列叙述正确的是( )
A.加入少量W,逆反应速率增大 B.当容器中气体压强不变时,反应达到平衡
C.升高温度,平衡逆向移动 D.平衡后加入X,上述反应的△H增大
17.设NA表示阿伏加德罗常数的值,下列说法正确的是 ( )
A.铁、铜和稀硫酸构成原电池,当转移了NA个电子时,产生的气体体积一定为11.2 L
B.在含4 mol Si-O键的石英晶体中,氧原子的数目为4NA
C.关于反应C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l);△H=-1300 kJ·mol-1,有8NA个碳氧共用电子对形成时,放出1300 kJ的能量
D.在标准状况下,2.24 L的乙烷中含有共价键的数目为0.6NA
18.有五组同族元素的物质,在101.3 kPa时测定它们的沸点℃、如下表所示:
| ① | He -268.8 | (a) -249.5 | Ar -185.8 | Kr -151.7 |
| ② | F2 -187.0 | Cl2 -33.6 | (b) 58.7 | I2 184.0 |
| ③ | (c) 19.4 | HCl -84.0 | HBr -67.0 | HI -35.3 |
| ④ | H2O 100.0 | H2S -60.2 | (d) -42.0 | H2Te -1.8 |
| ⑤ | CH4 -161.0 | SiH4 -112.0 | GeH4 -90.0 | (e) -52.0 |
对应表中内容,下列各项中正确的是 ( )
A.a、b、c的化学式分别为Ne2、Br2、HF
B.第②组物质均有氧化性;第③组物质对应水溶液均是强酸
C.第④组中各化合物的稳定性顺序为:H2O>H2S> H2Se>H2Te
D.上表物质中HF和H2O由于氢键的影响,其分子特别稳定
19.将a L NH3通过灼热的装有铁触媒的硬质玻璃管后,气体体积变为b L(气体体积均在同温同压下测定)。该b L气体中NH3的体积分数是 ( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
20.按如图甲装置进行实验,若乙中横坐标x表示流入电极的电子的物质的量,下列叙述不正确的是 ( )
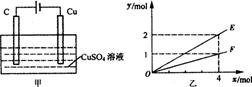
A.E表示生成铜的物质的量 B.E表示反应消耗水的物质的量
C.F表示反应生成氧气的物质的量 D.F表示生成硫酸的物质的量
三.简答题(27分)
21.(5分)某仓库工作人员违章操作,在雨天转运“保险粉”引起爆炸。“保险粉”学名为连二亚硫酸钠(Na2S2O4),主要用于印染工业作为还原剂。该化学品在潮湿空气中极不稳定,易分解并引起燃烧。在190℃时发生爆炸,反应的化学方程式为:2Na2S2O4=Na2S2O3+Na2SO3+ 。因此,该化学品通常要在通风、 、阴凉处密闭贮存。发生爆炸时,现场会扬起大量的白色烟雾,粉末漂浮在空中并四处扩散。尽快逃生的正确做法是 (填写正确选项的字母)
A.用干毛巾捂住口鼻 B.用湿毛巾捂住口鼻
C.顺风远离现场 D.逆风远离现场
22.(7分)同周期中A、B、C、D、E、F为原子序数依次增大的短周期元素。已知:A、C、F三种原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水。请回答下列问题:
(1)根据以上条件一定能判断出的元素有几种,请填写出相对应的元素符号:
A_______ B_______ C_______ D_______ E_______ F_______。
(2)已知D单质在F单质中燃烧可能生成两种化合物,其中有一种化合物中的所有原子均满足最外层8电子稳定结构,请写出生成该化合物的化学方程式:___________________。
(3)若1 mol F的最高价氧化物的水化物与C的最高价氧化物的水化物恰好完全反应,则等物质的量的C的最高价氧化物的水化物与A的最高价氧化物的水化物反应消耗_____mol A的最高价氧化物的水化物。
23.(6分) (1)1gH2与Cl2完全反应生成HCl时放出92.3kJ热量,写出该反应的热化学方程式 。
(2)已知:HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-,则下列5种稀溶液中:
①Na2CO3;②NaHCO3;③NaAlO2;④CH3COONa;⑤NaOH。
当它们pH相同时,其物质的量浓度由大到小为(以序号表示):
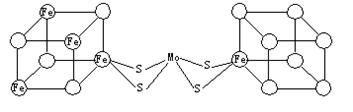
(3)人们一直致力于人工固氮的研究以获得廉价的氮肥。科学家先后提出并合成了出固氮酶的多种模拟物。其中一类是含Mo、Fe、S原子的类立方体结构,如下图所示。
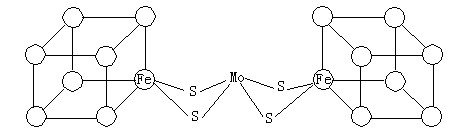 |
图中左右两边对称,各含一个近似为立方体的结构。每个立方体含有4个Fe原子、4个S原子,它们位于立方体的8个顶点,且原子间只有一种化学键。
①请在图中左边立方体的○中填写出其余3个Fe原子。
②上述一个立方体中4个Fe原子所在的顶点连接所构成的空间几何体为___________。
24.(9分)已知A、B、C为常见的单质,在一定条件下相互转化的关系如图:(有部分物质省略)
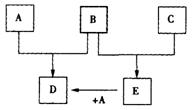
(1)若常温下,A、B均为气体,C为红色固体,E为黑色固体,则E的化学式为_____,写出A+E→D的化学反应方程式___________________________________________。
(2)若常温下B、C均为气体,A为金属单质,D为黑色晶体,则E的电子式为______,写出A+E→D的化学反应方程式 ______________________________________________。
(3)若常温下B为气体,C为黑色固体,则构成金属A的原子结构示意图为______,写出A+E→D的化学反应方程式____________________________________________。
四.实验题(17分)
25.某研究性学习小组在研究由Fe2+制备Fe(OH)2的过程中,设计了如下实验方案: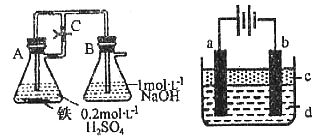
图1 图2
[实验设计]
方法一:按照图1进行实验,容器A中的反应开始时,弹簧夹C处于打开状态,一段时间后,关闭弹簧夹C,容器A中的反应仍在进行。最终在___________容器中观察到白色沉淀,该实验中涉及到的化学方程式有:______________________,_____________________。
方法二:按图2进行实验,最终在两极间的溶液中首先观察到白色沉淀。请从所提供的试剂或电极材料中选择正确的序号填在横线上:
①纯水 ②NaCl溶液 ③NaOH溶液 ④四氯化碳 ⑤CuCl2溶液 ⑥乙醇
⑦Fe棒 ⑧植物油 ⑨碳棒
a为_________,b为__________,c为__________,d为_________。(填序号)
[探究思考] 实验表明上述实验中出现白色的沉淀会逐渐转变为灰绿色或绿色,那么如何解释出现灰绿色或绿色的现象呢?
(1)甲同学查阅资料后,得到Fe(OH)2如下信息:
| 资料名称 | 物理性质描述 | 化学性质描述 |
| 《化学辞典》,顾翼东编,1989年版P637 | 白色无定形粉末或白色至淡绿色六方晶体 | 与空气接触易被氧化,将细粉喷于空气中,则立即燃烧出火花 |
| 《大学普通化学(下册)》傅鹰著P637 | 白色沉淀 | 此沉淀易被氧化成微绿色Fe3(OH)8 |
| 《普通化学教程》(下册)P788 | 白色 | 能强烈吸收O2,迅速变成棕色Fe(OH)3。这时作为氧化的中间产物为土绿色,其中含有Fe2+、Fe3+。 |
阅读该资料后,你对上述实验中出现灰绿色或绿色的现象的解释是:____________________;
资料中提及的微绿色Fe3(OH)8,用氧化物的形式表示可写成__________________________。
(2)乙同学依据配色原理:白色和棕色不可能调配成绿色或灰绿色的常识,认为绿色可能是形成Fe(OH)2·nH2O所致。用热水浴的方式加热“方法一”中生成的绿色沉淀,观察到沉淀由绿变白的趋势。
加热时,“方法一”中弹簧夹C应处于_________(填“打开”或“关闭”)状态,容器A中的反应须处于____________(填“停止”或“发生”)状态。写出该实验中支持乙同学观点的化学方程式_________________。
(3)欢迎你参加该研究小组的讨论,请提出一种在研究由Fe2+制备Fe(OH)2的过程中,有助于对沉淀由“白”变“绿”的现象进行合理解释的方案。你设计的方案为:________________。
五.计算分析题(10分)
26.现有一包铝热剂是铝粉和氧化铁粉末的混合物,在高温下使之充分反应,将反应后的固体分为两等份,进行如下实验(计算pH时假定溶液体积没有变化):
①向其中一份固体中加入100 mL 2.0 mol·L—1的NaOH溶液,加热使其充分反应后过滤,测得滤液的pH=14;
②向另一份固体中加入140 mL 4.0 mol·L—1的HCl溶液,使固体全部溶解,测得反应后所得溶液中只有H+、Fe2+和Al3+三种阳离子且pH=0。
⑴计算这包铝热剂中铝的质量和氧化铁的质量。
⑵计算实验②产生气体的体积(标准状况)。
高三年级化学期中试题答题卷
一.选择题(单选,每题2分,14题共28分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 答案 | |||||||
| 题号 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| 答案 |
二.选择题(单选,每题3分,6题共18分)
| 题号 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
三.简答题(27分)
21.2Na2S2O4=Na2S2O3+Na2SO3+ 、
通风、 、阴凉处密闭贮存。 (填写正确选项的字母)
22.(1)A B C D E F 。
(2)
(3)
23.(6分,每小题各2分)
(1)
(2)
 (3)①
(3)①
②
24.(9分,每小题均为1分+2分)
(1) E: , 。
(2) E: , 。
(3) A: , 。
四.实验题(17分)
25.[实验设计]
方法一: ;
、
方法二: 、 、 、
[探究思考]
(1)解释是 、
可写成
(2)(共3分,各1分) , ,
(3)
五.计算分析题(10分)
26.
|
一.选择题(单选,每题2分,14题共28分)
1.B 2.D 3.A 4. A 5.B 6.D 7.B
8.D 9.B 10.B 11.C 12.A 13.D 14.B
二.选择题(单选,每题3分,6题共18分)
15.D 16.B 17.C 18.C 19.C 20.D
三.简答题(27分)
21.2Na2S2O4=Na2S2O3+Na2SO3+ SO2↑ (2分) 、干燥(1分) AD(2分)
由题给信息知,Na2S2O4在潮湿空气中不稳定,易分解、燃烧、爆炸,所以应保存于干燥处。爆炸产生的粉末中含有盐类,故用干毛巾捂住口鼻减小吸入,并及时逆风远离现场,若用湿毛巾,则会形成溶液,可能会腐蚀皮肤。
22.(7分)
(1)A___Na__ B____Mg__ C___Al__ D_____ E____ F___ Cl___。
(每空0.5分,共3分)
(2)2P+3Cl2![]() 2PCl3 (2分)
2PCl3 (2分)
(3)1/3(2分)
23.(6分,每小题各2分)
(1)H2(g) +Cl2(g)=2 HCl (g);△H=-184.6kJ/mol
(2)④>②>①>③>⑤
(3)①
|
②正四面体(答四面体也给分)
24.(9分,每小题均为1分+2分)
(1) E:CuO,H2+CuO![]() Cu+H2O。
Cu+H2O。
(2) E:![]() ,3Fe+4H2O(g)
,3Fe+4H2O(g)
![]() Fe3O4+4H2。
Fe3O4+4H2。
(3) A: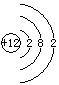 ,2Mg+CO2
,2Mg+CO2![]() 2MgO+C。
2MgO+C。
四.实验题(17分)
25. (17分)
[实验设计]
方法一:B;(1分)
![]()
![]()
![]() 中和反应方程式不写不扣分
中和反应方程式不写不扣分
(每个方程式2分,共4分)
方法二:⑦、⑨或⑦(写1个即可)、⑧、②(每空1分,共4分)
[探究思考]
(1)(共3分)由于Fe(OH)2部分被氧化,混入少量的Fe(OH)3(1分)
![]() FeO·Fe2O3·4H2O(2分)
FeO·Fe2O3·4H2O(2分)
(2)(共3分,各1分)打开,发生,Fe(OH)2·nH2O = Fe(OH)2+nH2O
(3)(共2分)向Fe2+和Fe3+的混合液中加入NaOH溶液后,观察生成的沉淀的颜色是否为灰绿色。(合理答案均给分)
五.计算分析题(10分)
26.⑴实验①中用去n(NaOH)=100 mL×(2.0 mol·L—1-1.0 mol·L—1)=0.1 mol
(1分)
无论是Al还是Al2O3,与NaOH溶液反应后都生成NaAlO2,铝热剂中
n(Al)=n(NaOH)×2=0.2 mol, m(Al)=5.4 g (2分,算出2.7 g给1分)
实验②所得溶液中,根据“电荷守恒”有n(H+)+2×n(Fe2+)+3×n(Al3+)=n(Cl-)
则n(Fe2+)=![]() =0.06 mol (2分)
=0.06 mol (2分)
铝热剂中n(Fe2O3)=n(Fe2+)×![]() ×2=0.06 mol,m(Fe2O3)=9.6 g
×2=0.06 mol,m(Fe2O3)=9.6 g
(2分,算出4.8 g给1分)
⑵根据上述计算结果,反应2Al+Fe2O3![]() 2Fe+Al2O3充分进行后所得固体混合物中含0.08 mol Al和0.12 mol Fe。
(1分)
2Fe+Al2O3充分进行后所得固体混合物中含0.08 mol Al和0.12 mol Fe。
(1分)
实验②中所得H2在标准状况下体积为
V(H2)=n(H2)×22.4 L·mol-1=[n(Al)×![]() ×
×![]() +n(Fe)×
+n(Fe)×![]() ]×22.4 L·mol-1=2.688 L
]×22.4 L·mol-1=2.688 L
(2分)